
- •Министерство образования и науки Российской Федерации
- •Введение
- •Тема 1 фазовые превращения вещества
- •1.1. Однокомпонентные системы
- •1.2. Двухкомпонентные системы
- •Краткий итог темы
- •Термины для запоминания
- •Вопросы для проверки знаний
- •Упражнения
- •Тема 2 дисперсные системы
- •2.1. Классификация дисперсных систем
- •Классификация дисперсных систем по размеру частиц дисперсной фазы
- •2.2. Поверхностное натяжение
- •2.3. Процессы на границе раздела фаз
- •2.4. Поверхностно-активные вещества
- •2.5. Наночастицы
- •Краткий итог темы
- •Термины для запоминания
- •Вопросы для проверки знаний
- •Упражнения
- •Тема 3 растворы
- •3.1. Способы выражения концентрации раствора
- •Решение
- •3.2. Термодинамика процесса растворения
- •Термодинамические параметры растворения газов в воде
- •Растворимость газов в воде (мл/100 г н2о) при парциальном давлении 1 атм и константе Генри (кг, мольл-1атм-1)
- •3.3. Физические свойства растворов. Закон Рауля
- •Краткий итог темы
- •Термины для запоминания
- •Вопросы для проверки знаний
- •Упражнения
- •Тема 4 растворы электролитов
- •4.1.Электролитическая диссоциация
- •Значения рН некоторых жидкостей
- •4.2. Реакции электролитов
- •1) Реакции диссоциации слабых кислот
- •3) Реакции гидролиза
- •4) Реакции осаждения (образование нерастворимой соли)
- •5) Реакции образования газообразного вещества
- •6) Окислительно-восстановительные реакции
- •Примеры химических соединений, участвующие в реакциях как окислители и восстановители
- •4.3. Превращение энергии химической реакции в электрическую энергию
- •4.4. Электродные потенциалы и электродвижущая сила
- •4.5. Источники превращения энергии химической реакции в электрическую энергию
- •4.6. Превращение электрической энергии в электролизерах
- •Электродные реакции при электролизе водных растворов электролитов
- •Краткий итог темы
- •Термины для запоминания
- •Вопросы для проверки знаний
- •Упражнения
- •Тема 5 металлы
- •Содержание основных элементов земной коры (по Ярошевскому)
- •Одна из химических классификаций минералов земной коры
- •5.1. Физические свойства металлов
- •5.2. Химические свойства металлов
- •Некоторые химические свойства металлов*
- •5.3. Металлы s-элементов
- •5.4. Металлы р-элементов
- •5.5. Металлы d-элементов
- •5.6. Коррозия металлов. Защита от коррозии
- •5.7. Металлы f-элементов
- •5.8. Ядерные реакции
- •Краткий итог темы
- •Термины для запоминания
- •Вопросы для проверки знаний
- •Упражнения
- •Тема 6 неметаллы
- •6.1. Элементы 18 группы. Благородные газы
- •6.2. Элементы 17 группы. Галогены
- •6.3. Элементы 16 группы. Кислород. Сера
- •6.4. Элементы 15 группы. Азот
- •6.5. Элементы 14 группы. Углерод. Кремний
- •Краткий итог темы
- •Термины для запоминания
- •Вопросы для проверки знаний
- •Упражнения
- •Тема 7 органические соединения
- •Некоторые продукты переработки нефти и природного газа
- •7.1. Классификация органических соединений
- •К Предельные (алканы)ПримерыСн4 метанСн3–сн3 этанСн3–сн2–сн3 пропан лассификация органических соединений по углеродному скелету
- •Непредельные
- •Органические соединения
- •7.2. Нефть и природный газ
- •7.3. Высокомолекулярные соединения (полимеры)
- •7.4. Биополимеры
- •Важнейшие α-аминокислоты растительных и животных белков*.
- •Функции некоторых белков в организме
- •Краткий итог темы
- •Термины для запоминания
- •Вопросы для проверки знаний
- •Упражнения
- •Список рекомендуемой литературы Основная
- •Дополнительная
- •Содержание
- •Тема 1. Фазовые превращения вещества………………………………...5
- •Тема 2. Дисперсные системы………………………………………........22
- •Тема 3. Растворы………………………………………............................47
- •Тема 4. Растворы электролитов………………........................................66
- •Тема 5. Металлы………………………………………………………..102
- •Тема 6. Неметаллы……………………………………………………...133
- •Тема 7. Органические соединения…………………………………….153
Упражнения
Нарисуйте модель кристаллической решетки металла. Покажите характер изменения состояния кристаллической решетки металла: а) при электропроводности; б) теплопроводности.
Нарисуйте схему электролизера и напишите электродные реакции, протекающие на катоде и аноде при получении металлического натрия.
Напишите реакцию восстановления железа из оксида железа в доменной печи.
Выскажите предположение, почему зола, образующаяся при сжигании каменного угля на электростанциях, имеет повышенную радиоактивность по сравнению с естественным радиоактивным фоном окружающей среды.
Вычислите время, необходимое для радиоактивного превращения металлического полония-210 на 99%, если известно, что период полураспада
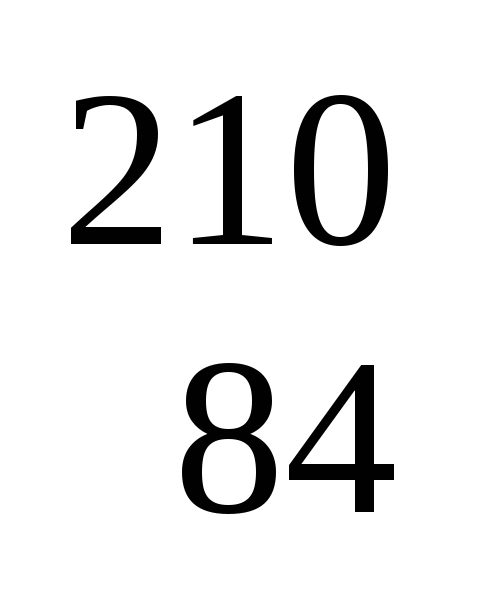 Ро
равен 138 дней. Какое вещество образуется
при радиоактивном распаде
Ро
равен 138 дней. Какое вещество образуется
при радиоактивном распаде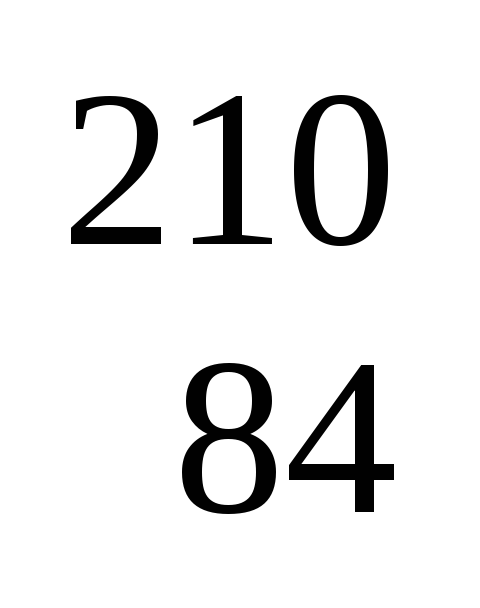 Ро,
если известно, что полоний-излучатель?
Ро,
если известно, что полоний-излучатель?
Тема 6 неметаллы
Неметаллы представлены 22 элементами периодической системы. За исключением водорода (s-элемента) остальные неметаллы – р-элементы. Кислород и кремний составляют почти 78 мас.% земной коры. В этом легко убедиться, если рассчитать долю кислорода и кремния в наиболее распространенных минералах горных пород (силикатах и алюмосиликатах), например, таких, как каолинит Al2[Si2O5](OH)4, ортоклаз К[AlSi3O8], анортит Ca[Al2Si2O8], кварцевый песок SiO2.
Отметим два признака, которые отличают неметаллы от металлов. В пределах одного периода:
1) радиусы атомов неметаллов меньше радиусов атомов металлов;
2) энергия ионизации атомов неметаллов больше энергии ионизации атомов металлов, поэтому в окислительно-восстановительных реакциях с металлами неметаллы выступают как окислители.
Положение металлов и неметаллов в периодической системе элементов является следствием заполнения электронных оболочек атомов в соответствии с квантовыми правилами. Периодичность изменения электронной конфигурации атомов приводит к повторению физических и химических свойств элементов через правильные интервалы. Каждый новый период открывается щелочным металлом и завершается благородным газом (неметаллом). Переход от одного периода к следующему происходит скачком. В этом легко убедиться, сравнивая изменение атомных радиусов и энергии ионизации от заряда ядра атома (рис. 51 и 52).
6.1. Элементы 18 группы. Благородные газы
Благородные газы (гелий He, неон Ne, аргон Ar, криптон Kr, ксенон Xe и радон Rn) входят в 18 группу периодической системы, они завершают периоды. Атомы элементов имеют электронную конфигурацию с полностью заполненной np6-орбиталью (у гелия 1s2-орбиталь). Такая конфигурация электронных оболочек определяет химическую инертность одноатомных благородных газов.
В природе благородные газы находятся в атмосфере, гидросфере и литосфере. Самым распространенным среди них является аргон, его содержание в атмосфере составляет 1 % по объему, точнее 0.934 об.%. Гелий He выделяют из гелионосных горючих газов. Радон получают как побочный продукт при переработке ураносодержащих руд. Неон, аргон, ксенон и криптон получают из воздуха как побочные продукты разделения воздуха на азот и кислород.
Гелий применяется в качестве носителя в хроматографии. Смесь кислорода и гелия используется вместо воздуха водолазами.
Аргон используется для создания инертной атмосферы при сварочных работах.
Неон и криптон используют в газоразрядных трубках (реклама).
Радон – радиоактивный газ (-излучатель). Период полураспада самого долгоживущего радионуклида Rn-222 3.8 сут.
