
- •Міністерство охорони здоров’я України
- •Загальна та неорганічна хімія
- •Частина II
- •Приклади розв’язування задач
- •Контрольні питання
- •Контрольні питання
- •Контрольні питання
- •Контрольні питання
- •Контрольні питання
- •Властивості d-елементів iв і iiв підгруп: Cu, Ag, Au, Zn, Cd, Hg
- •Контрольні питання
- •Властивості d-eлементів vib—viiib підгруп:
- •Контрольні питання
- •Література
- •69035, Г. Запорожье, пр. Маяковского, 26.
- •69035, Г. Запорожье, пр. Маяковского, 26.
Контрольні питання
41. Складіть рівняння реакцій, за допомогою яких можна здійснити наступні перетворення: Na2B4O7 ® H3BO3 ® B(OCH3)3 ® B2O3 ® B ® Mg3B2 ® B2H6.
42. Складіть рівняння реакцій, за допомогою яких можна здійснити наступні перетворення: Al ® AlN ® Al(OH)3 ® Na[Al(OH)4] ® Al2(SO4)3 ® AlCl3.
43. Складіть рівняння реакцій, за допомогою яких можна здійснити наступні перетворення: B2H6 ® Li[BH4] ® H3BO3 ® Na2B4O7 ® NaBO2 ® H3BO3 ® B(OCH3)3.
44. Складіть рівняння реакцій, за допомогою яких можна здійснити наступні перетворення: Al ® Na[Al(OH)4] ® Al2(SO4)3 ® Al(OH)3 ® Al2O3 ® Al.
45. Складіть рівняння реакцій, за допомогою яких можна здійснити наступні перетворення: B ® KBO2 ® H3BO3 ® B2O3 ® BF3 ® K[BF4] ® B ® BN.
46. Складіть рівняння реакцій, за допомогою яких можна здійснити наступні перетворення: Al ® Na[Al(OH)4] ® Al2(SO4)3 ® AlCl3.
47. Складіть рівняння реакцій, за допомогою яких можна здійснити наступні перетворення: H3BO3 ® Na2B4O7 ® NaBO2 ® H3BO3 ® B(OCH3)3 ® B2O3.
48. Складіть рівняння реакцій, за допомогою яких можна здійснити наступні перетворення: Al4C3 ® Al(OH)3 ® Al2O3 ® Al ® Na[Al(OH)4] ® AlCl3.
49. Складіть рівняння реакцій, за допомогою яких можна здійснити наступні перетворення: B2O3 ® B ® BF3 ® K[BF4] ® B ® B2O3.
50. Складіть рівняння реакцій, за допомогою яких можна здійснити наступні перетворення: Al ® AlCl3 ® Al(OH)3 ® NaAlO2 ® Al2(SO4)3 ® Al(OH)3.
51. Складіть рівняння реакцій, за допомогою яких можна здійснити наступні перетворення: C ® CH4 ® CO2 ® Na2CO3 ® NaHCO3 ® CaCO3 ® CO2.
52. Складіть рівняння реакцій, за допомогою яких можна здійснити наступні перетворення: SiO2 ® Si ® Mg2Si ® SiH4 ® SiCl4 ® SiO2 ® SiF4.
53. Складіть рівняння реакцій, за допомогою яких можна здійснити наступні перетворення: Sn ® Sn(NO3)2 ® Sn(OH)2 ® SnCl2 ® SnCl4 ® H2SnO3 ® SnO2.
54. Складіть рівняння реакцій, за допомогою яких можна здійснити наступні перетворення: Pb ® K2[Pb(OH)4] ® PbO2 ® PbCl4 ® PbCl2 ® PbS ® PbSO4.
55. Складіть рівняння реакцій, за допомогою яких можна здійснити наступні перетворення: C ® C2N2 ® HCN ® HCOONH4 ® HCOOH ® CO ® COCl2.
56. Складіть рівняння реакцій, за допомогою яких можна здійснити наступні перетворення: SiO2 ® Si ® SiC ® SiCl4 ® SiH4 ® Na2SiO3 ® SiO2×xH2O.
57. Складіть рівняння реакцій, за допомогою яких можна здійснити наступні перетворення: Pb(NO3)2 ® PbO ® Pb(CH3COO)2 ® PbO2 ® Na2[Pb(OH)6] ® H2[Pb(OH)6] ® PbO2.
58. Складіть рівняння реакцій, за допомогою яких можна здійснити наступні перетворення: Mg2Ge ® GeH4 ® Ge ® GeO2 ® Na2GeO3 ® GeO2 ® Ba[GeF6].
59. Складіть рівняння реакцій, за допомогою яких можна здійснити наступні перетворення: Mg2Sn ® SnH4 ® SnO2 ® Na2[Sn(OH)6] ® H2[Sn(OH)6] ® H2[SnCl6].
60. Складіть рівняння реакцій, за допомогою яких можна здійснити наступні перетворення: (NH4)2SnS3 ® SnS2 ® SnCl4 ® H2[Sn(OH)6] ® Sn(OH)4 ® SnO2 ® K2SnO3.
61. Складіть електронні і молекулярні рівняння реакцій: а)алюмінію з розчином лугу, б) бору з концентрованою HNO3.
62. Який процес називається алюмотермією? Складіть електронні і молекулярні рівняння реакції, на якій засновано використання терміту (суміш Al і Fe3O4).
63. Охарактеризуйте гідриди бору (борани), наведіть приклади їх одержання. Який зв’язок одержав назву «бананового зв’язку»?
64. Опишіть хімізм електролітичного одержання алюмінію. Наведіть приклади амфотерних властивостей алюмінію та його оксиду (тригідроксиду).
65. Охарактеризуйте кислоти бора, їх форми, існування у вільному стані. Наведіть приклади взаємодії ортоборної (борної) кислоти з лугами і бури з мінеральними кислотами.
66. Напишіть хімізм реакції одержання гідриду алюмінію (AlH3) і охарактеризуйте його властивості.
67. Які сполуки бора мають практичне значення у медичній практиці? Охарактеризуйте ці сполуки.
68. Дайте характеристику оксидів і гідроксидів галію, індію і талію. Як змінюються кислотно-основні властивості елементів IIIA підгрупи зверху вниз по групі? Наведіть приклади.
69. Наведіть приклади практичного застосування найважливіших сполук алюмінію, а також галузі їх використання.
70. Дайте коротку характеристику сполукам галію, індію і талію зі ступенем окислення +1.
71. На нейтралізацію продуктів гідролізу фосгену витрачено 27,5 см3 розчину лугу з CН=0,524. Обчисліть об’єм (н.у.) фосгену, який піддали гідролізу. Відповідь: 0,161 л.
72. Який об’єм метану CH4 (у літрах) необхідно спалити, щоб нагріти 1 л води від температури 20°C до кипіння? Термохімічне рівняння реакції горіння метану: CH4 + 2O2 ® CO2 + 2H2O; DH0=–892 кДж. Теплоємкість води дорівнює 4,18 кДж/(кг×°C). Відповідь: 8,4 л CH4.
73. У виробництві кальцинованої соди аміачним способом водний розчин NаCl насичується NH3 і CO2, осад NaHCO3, що утворюється при цьому, відфільтровують і прожарюють. Обчисліть витрати сировини — об’єм розсолу з вмістом 300 г NаCl на 1 л, NH3 і CO2 (у м3 за н.у.), які необхідні для виробництва 1 тонни кальцинованої соди, враховуючи, що лише 2/3 NаCl перетворюється у соду, а CO2, що утворюється при прожарюванні NaHCO3, без втрат повертається у виробничий цикл (процес). Відповідь: 5,52 м3; 422 м3 NH3; 211 м3 CO2.
74.
Обчисліть
теплоту
утворення
SiC на
підставі
рівняння
реакції:
SiO2
+ 3C ®
SiC + 2CO, DH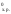 =510,9кДж.
Теплота
утворення
SiO2=–872,2
кДж/моль
і
CO=–110,5 кДж/моль.
Відповідь:
–140,3 кДж.
=510,9кДж.
Теплота
утворення
SiO2=–872,2
кДж/моль
і
CO=–110,5 кДж/моль.
Відповідь:
–140,3 кДж.
75. Обчисліть середню добову потребу у вапняку содового заводу, що працює за сульфатним способом з середньою місячною продуктивністю 2400 тонн кристалічної соди. При розрахунках прийняти вміст CaCO3 у вапняку 85% і втрати у виробництві 10%. Відповідь: 2,96 тонни.
76. Тальк містить 0,53% водню, 19,22% магнію, 29,63% кремнію та 50,62% кисню. Визначте формулу тальку. Відповідь: 3MgO×4SiO×H2O.
77. Скільки грамів кремнію, масова частка домішок у якому становить 8%, вступило в реакцію з водним розчином NaOH, якщо при цьому утворилося 5,6 л водню (н.у.)? Відповідь: 3,8 г.
78. Обчисліть об’єм розчину AgNO3 з CН=0,25, який слід витратити для осадження Cl–, що утворилися в результаті гідролізу 200 см3 фосгену (н.у.). Відповідь: 71,3 см3.
79. Розкладом 14,2 г суміші CaCO3 і MgCO3 одержали 6,6 г CO2. Обчисліть вміст карбонатів кальцію і магнію в суміші. Відповідь: 10 г CaCO3; 4,2 г MgCO3.
80. Скільки кілограмів борної кислоти H3BO3 і який об’єм 23% розчину Na2CO3 (густина 1,25 г/см3) необхідно витратити для одержання 1 тонни бури Na2B4O7×10H2O? Відповідь: 649 кг; 967 л.
Головна підгрупа VA групи: N, P, As, Sb, Bi
Атоми
цих
елементів
мають
на
зовнішньому
рівні
п’ять
електронів
ns2p3.
Такому
стану
відповідає
ступінь
окислення
елементів
–3, наприклад,
в
підрядах
EH3.
При
збудженні
атомів
відбувається
роз’єднання
s-електронів
і
один
із
них
переходить
на
d-підрівень
(за
винятком
атомів
азоту,
які
не
мають
d-підрівня!)
Валентних
електронів
стає
п’ять,
вони
знаходяться
в
стані
s1p3d1-збудження,
якому
відповідає
ступінь
окислення
в
сполуках
+5 (азот
утворює
чотириковалентні,
однозарядні
сполуки,
наприклад,
NH .
.
Азот і фосфор—типові неметали, у As переважають неметалічні властивості, у сурми (стибію) рівномірно спостерігаються (проявляються) металічні і неметалічні властивості, тоді як у Bi переважають металічні властивості. У звичайних умовах азот інертний, оскільки енергія потрійного зв’язку у його молекулі: NºN: велика (941,4 кдж/моль). При високих температурах азот вступає в реакцію з багатьма металами і неметалами (карбіди, нітриди і інші). Сполуки азоту із ступенем окислення +5, сильні окислювачі, наприклад, HNO3 і її солі.
Фосфор значно легше, ніж азот, окислюється, більш енергійно взаємодіє з металами (фосфіди). Сурма і вісмут при звичайних умовах стійки до окислення на повітрі, до дії води, але при нагріванні активність їх збільшується—реагують з галогенами і деякими металами. Усі елементи цієї групи утворюють кислотні оксиди E2O5, E2O3 і відповідні їм кислоти. As2O3, Sb2O3 і Bi2O5 амфотерні. Спостерігаються підсилення (збільшення) металічних властивостей у підгрупі зверху донизу.
