
- •3. Биологическая роль элементов в зависимости от положения в пс д.И. Менделеева.
- •4. Понятие о биогенных элементах. Макро- и микроэлементы в организме человека. Топография важнейших биогенных элементов в организме человека.
- •5. Общая характеристика s-элементов. Характеристика элементов I a группы. Биогенная роль данных элементов, применение их соединений в медицине. Радионуклид Cs-137.
- •6. Общая характеристика s-элементов II a группы. Их биогенная роль и применение соединений в медицине. Радионуклид Sr-90.
- •7. Общая характеристика p-элементов и их соединений. Характеристика элементов III a группы. Биогенная роль данных элементов, применение их соединений в медицине.
- •19. Характеристика энергетического состояния электрона в атоме системой квантовых чисел. Принцип Паули. Правило Хунда. Принцип минимума энергии.
- •21. Периодичность изменения радиусов атомов и ионов, энергии ионизации, сродства к электрону и электроотрицательности атомов.
- •22. Химическая связь. Природа и типы химической связи. Зависимость потенциальной энергии системы из двух атомов водорода от расстояния между их ядрами. Энергия и длина связи.
- •26. Ионная связь.
- •27. Водородная связь. Межмолекулярная и внутримолекулярная водородная связь. Роль водородной связи в процессе ассоциации молекул.
- •1) Вода
- •28. Комплексные соединения. Координационная теория Вернера. Центральный атом, лиганды. Координационное число центрального атома.
- •31. Комплексообразующая способность s-, p-, d- элементов. Реакции комплексообразования. Реакции разрушения комплексных соединений.
- •39. Метод нейтрализации (кислотно-основное титрование). Ацидиметрия и алкалиметрия. Стандартные растворы. Кислотно-основные индикаторы.
- •48. Энтропия: термодинамическое и статистическое толкование. Уравнение Больцмана. Расчет энтропийного фактора химической реакции по стандартным энтропиям вещества.
- •51. Смещение химического равновесия обратимых реакций при изменении температуры, концентрации и давления. Принцип Ле Шателье.
- •52. Предмет химической кинетики. Химическая кинетика как основа для изучения скорости и механизма биохимических процессов.
- •53. Скорость химической реакции для гомогенных и гетерогенных превращений. Механизм химических реакций; молекулярность реакций.
- •54. Закон действующих масс для скорости химической реакции. Константа скорости. Порядок реакции.
- •57. Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Температурный коэффициент реакции. Энергия активации. Уравнение Аррениуса.
- •58. Теория активного комплекса. Объяснение действия катализатора с позиций данной теории. Катализ и катализаторы. Автокаталитические реакции.
- •59. Кинетика ферментативных реакций. Уравнение Михаэлиса-Ментен. Молекулярная активность (число оборотов) фермента. Факторы, влияющие на активность ферментов.
- •60. Понятие о растворах. Классификация растворов. Роль растворов в жизнедеятельности организмов.
- •61. Способы выражения состава раствора: массовая доля, молярная концентрация, молярная концентрация эквивалента, молярная доля, объемная доля, титр.
- •62. Термодинамика растворения. Теплота растворения.
- •63. Насыщенный раствор. Растворимость. Факторы, влияющие на нее.
- •64. Растворимость газов в жидкостях. Уравнение Генри и Сеченова. Причина возникновения кессонной болезни. Растворимость газов в крови.
- •66. Растворимость жидкости в жидкости. Неограниченно смешивающиеся, несмешивающиеся и частично смешивающиеся жидкости. Закон распределения Нернста-Шилова. Экстракция из растворов.
- •67. Коллигативные свойства растворов. Давление насыщенного пара над раствором. Закон Рауля.
- •68. Криоскопический и эбулиоскопический законы. Криоскопия и эбулиоскопия как методы экспериментального определения молярной массы растворенного вещества.
- •69. Осмос и осмотическое давление. Уравнение Вант-Гоффа. Полупроницаемые мембраны в организме.
- •72. Основные положения теории слабых электролитов Аррениуса. Константа диссоциации, степень диссоциации. Закон разведения Оствальда.
- •74. Роль электролитов в жизнедеятельности человека. Ионный состав внутри- и внеклеточных жидкостей. Ионная сила плазмы крови.
- •77. Буферные системы, классификация, механизм их действия. Расчет рН буферных систем. Уравнение Гендерсона-Гассельбаха. Буферная емкость.
- •81. Метод электронного баланса и метод полуреакций при расстановке коэффициентов в уравнениях ов реакций. Важнейшие окислители и восстановители.
- •82. Устройство и принцип действия гальванических элементов. Ов, диффузные и мембранные потенциалы. Уравнение Нернста. Классификация электродов.
- •83. Потенциометрия. Потенциометрическое определение рН растворов. Хлорсеребряный электрод. Стеклянный электрод с водородной функцией.
- •86. Поверхностные явления и их значение в медицине и биологии. Поверхностная энергия и поверхностное натяжение. Определение поверхностного натяжения сталагмометрическим методом.
- •88. Твердые адсорбенты. Активная поверхность как важнейшая характеристика твердых адсорбентов. Классификация твердых адсорбентов. Биологическая роль пищевого волокна.
- •89. Адсорбция на твердых адсорбентах. Теория мономолекулярной адсорбции Ленгмюра. Уравнение Ленгмюра. Теория полимолекулярной адсорбции Поляни и бэт. Эмпирическое уравнение Фрейндлиха.
- •90. Адсорбция из растворов электролитов: избирательная, ионообменная. Правила Панета-Фаянса. Иониты, их применение в медицине и биологии.
- •91. Адсорбционная терапия. Гемо-, лимфо- и плазмосорбция. Энтеросорбция и энтеросорбенты.
- •92. Дисперсные системы. Их классификация. Методы получения и очистки коллоидных растворов.
- •93. Молекулярно-кинетические и оптические свойства дисперсных систем.
- •94. Электрокинетические явления. Электрофорез, электроосмос. Применение электрофореза в биологических и медицинских исследованиях.
- •95. Строение коллоидной мицеллы лиофобных золей. Двойной электрический слой. Электрокинетический потенциал коллоидной частицы и устойчивость коллоидного раствора.
- •98. Микрогетерогенные системы: эмульсии, аэрозоли, пены.
- •99. Высокомолекулярные соединения и их растворы. Природные и синтетические вмс. Методы получения вмс и их классификация.
- •101. Полиэлектролиты. Изоэлектрическое состояние и изоэлектрическая точка белка. Методы определения иэт.
22. Химическая связь. Природа и типы химической связи. Зависимость потенциальной энергии системы из двух атомов водорода от расстояния между их ядрами. Энергия и длина связи.
Химическая связь – результат взаимодействия двух или более атомов, приводящий к образованию устойчивой многоатомной системы. Природа сил, действующих в многоатомных системах, электрическая: притяжение разноименно заряженных частиц. Носителями зарядов в веществе являются ядра и электроны.
По характеру распределения заряженных частиц в веществе различают несколько типов химической связи.
![]()
 Энергия
связи (Е, кДж/моль) – это энергия,
необходимая для разрыва химической
связи в одном моль вещества, находящегося
в газообразном состоянии.Чем больше
энергия связи, тем прочнее химическая
связь. Энергетический подход к описанию
химической связи
Энергия
связи (Е, кДж/моль) – это энергия,
необходимая для разрыва химической
связи в одном моль вещества, находящегося
в газообразном состоянии.Чем больше
энергия связи, тем прочнее химическая
связь. Энергетический подход к описанию
химической связи
Образование химической связи энергетически выгодно, так как энергия связанной системы меньше, чем суммарная энергия изолиро-ванных атомов: А + В → АВ Е(A) + Е(B) > Е(AB)
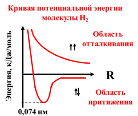 0,074
нм – это длина связи в молекуле H2.
Длина связи – это расстояние между
атомами в молекуле.
0,074
нм – это длина связи в молекуле H2.
Длина связи – это расстояние между
атомами в молекуле.
23. Описание ковалентной связи с позиций метода валентных связей. Валентность. Обменный и донорно-акцепторный механизмы образования ковалентной связи. Насыщаемость ковалентной связи. π- и σ-Связи.
Ковалентная связь (КС) – самый распространенный тип химической связи. В органических соединениях практически все связи являются ковалентными.
Существует два квантово-механических подхода к описанию КС: метод валентных связей (ВС) и метод молекулярных орбиталей (МО). Основные положения метода ВС. 1. В образовании КС участвуют только валентные электроны. Валентными называются электроны, наиболее удаленные от ядра. Валентность атома можно предсказать по числу неспаренных электронов в его стационарном и возбужденных состояниях.
![]()
![]()
![]()
2. Единичную КС образуют 2 электрона с антипараллельными спинами, принадлежащими двум атомам (общая электронная пара). Ковалентная связь – это химическая связь, образованная при помощи общих электронных пар, принадлежащих двум или более атомам.
![]()
![]() Донорно-акцепторный
механизм – атом-донор отдает неподеленную
электронную пару на вакантную орбиталь
атома-акцептора
Донорно-акцепторный
механизм – атом-донор отдает неподеленную
электронную пару на вакантную орбиталь
атома-акцептора
![]()
![]() 3.
С точки зрения волновых представлений,
образованию общей электронной пары
соответствует перекрывание АО
взаимодействующих атомов.
3.
С точки зрения волновых представлений,
образованию общей электронной пары
соответствует перекрывание АО
взаимодействующих атомов.
![]() Ось
молекулы – это условная линия,
соединяющая ядра атомов в молекуле
Ось
молекулы – это условная линия,
соединяющая ядра атомов в молекуле
![]()
При осевом перекрывании орбиталей образуется разновидность ковалентной связи, называемая σ- связью.
 При
боковом перекрывании орбиталей
образуется разновидность ковалентной
связи, называемая π-
связью. Чем
сильнее перекрываются орбитали, тем
прочнее КС. Вот почему σ-связи
прочнее π-связей.
При
боковом перекрывании орбиталей
образуется разновидность ковалентной
связи, называемая π-
связью. Чем
сильнее перекрываются орбитали, тем
прочнее КС. Вот почему σ-связи
прочнее π-связей.
4. Если в молекуле три и более атомов, то орбитали ее центрального атома, как правило, гибридизованы.
24. Понятие о гибридизации атомных орбиталей. Типы гибридизации. Направленность ковалентной связи. Конфигурация молекул.
Гибридизация – выравнивание орбиталей атома по форме и энергии в процессе образования КС.
![]() Гибридизация-
энергетически выгодный процесс,
обеспечивающий максимальное перекрывание
АО.
Гибридизация-
энергетически выгодный процесс,
обеспечивающий максимальное перекрывание
АО.


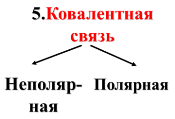 Неполярные
КС связывают атомы одного химического
элемента: Н-Н, О=О, N
≡ N.
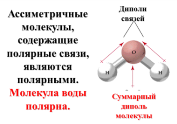
Полярные
КС связывают атомы разных химических
элементов: H-Cl,
H-O-H,
C≡O.
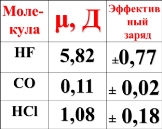
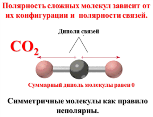
Полярность связи обусловлена смещением
общей электронной пары в сторону более
электроотрицательного атома. Полярная
молекула – это диполь, характеризующийся
величиной дипольного момента(μ).
μ
= ℓq,
ℓ
–
расстояние между центрами тяжести
положительного и отрицательного зарядов
в молекуле, q
– эффективный заряд.
Неполярные
КС связывают атомы одного химического
элемента: Н-Н, О=О, N
≡ N.
Полярные
КС связывают атомы разных химических
элементов: H-Cl,
H-O-H,
C≡O.
Полярность связи обусловлена смещением
общей электронной пары в сторону более
электроотрицательного атома. Полярная
молекула – это диполь, характеризующийся
величиной дипольного момента(μ).
μ
= ℓq,
ℓ
–
расстояние между центрами тяжести
положительного и отрицательного зарядов
в молекуле, q
– эффективный заряд.
![]()
25. Понятие о методе молекулярных орбиталей. Энергетические диаграммы образования простейших молекул (H2 N2, O2, F2, NO, CO) и молекулярных ионов (H2+и H2-).
Основные положения метода MO: 1.В образовании КС участвуют все электроны в атоме. 2. Электроны в молекулах занимают молекулярные орбитали (MO), подобно тому, как в атомах они занимают атомные орбитали (AO). 3. МО заполняются электронами в соответствии с принципом минимальной энергии, принципом Паули и правилом Гунда. МО есть результат сложения или вычитания волновых функций АО взаимодействующих атомов. При сложении АО образуется связывающая МО, энергия которой меньше энергии исходных атомных орбиталей. При вычитании АО образуется разрыхляющая МО, энергия которой больше энергии исходных атомных орбиталей.
![]()
![]() N
– число электронов на связывающих
орбиталях,
N'
– число электронов на разрыхляющих
орбиталях.
N
– число электронов на связывающих
орбиталях,
N'
– число электронов на разрыхляющих
орбиталях.
Молекула не образуется, если n = 0. Метод МО позволяет определить магнитные свойства молекул.
Парамагнитные молекулы, генерирующие электромагнитное поле, содержат неспаренные электроны на МО. Диамагнитные молекулы, не генерирующие собственное электромагнитное поле, не содержат неспаренных электронов на МО. Для описания молекул используются энергетические диаграммы.
 Молекула
диамагнитна, так как не содержит
неспаренных электронов на МО
Молекула
диамагнитна, так как не содержит
неспаренных электронов на МО
![]()
![]() Катион
парамагнитен,
так как содержит неспаренный электрон
на МО
Катион
парамагнитен,
так как содержит неспаренный электрон
на МО
![]()
 Анион
парамагнитен, так как содержит неспаренный
электрон на МО
Анион
парамагнитен, так как содержит неспаренный
электрон на МО
![]()

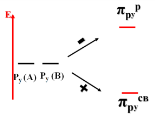
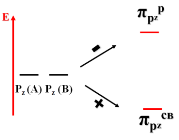

Молекула диамагнитна, так как не содержит неспаренных электронов на МО
![]()
