
1.3.1. Определения понятий атом и молекула
По современным представлениям:
Атом – это электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов.
Неправильно говорить, что «атом – наименьшая частица химического элемента, сохраняющая все его химические свойства», т. к. химический элемент – это вид частиц (атомов, ионов, ядер) с определенным зарядом ядра; поэтому элемент не состоит из атомов!
Кроме того, химические свойства – это энергетика и скорость химической реакции, а они зависят не только от состава реагирующей частицы, но и от ее энергетического состояния, геометрической формы и т. п., потому химическими свойствами обладают не атомы (и молекулы), а их совокупности – химические вещества.
Молекула – это электронейтральная наименьшая совокупность атомов, образующих определенную структуру посредством химических связей, определяющая состав вещества.
Согласно современным представлениям из молекул состоят вещества в газо- и парообразном состоянии. В твердом состоянии из молекул состоят лишь вещества, кристаллическая решетка которых имеет молекулярную структуру (большинство органических веществ; неметаллы, кроме бора, кремния, аллотропных модификаций углерода; углекислый газ СО2; вода Н2О).
Большинство же твердых неорганических веществ не имеет молекулярной структуры: их решетка состоит не из молекул, а из других частиц (ионов, атомов); они существуют в виде макротел (кристалл NaCl, друза кварца, кусок железа и др.). К веществам немолекулярного строения относятся соли, оксиды металлов, алмаз, кремний, металлы и др.
Химическая связь между молекулами у веществ с молекулярной структурой менее прочная, чем между атомами в молекуле, поэтому их температуры плавления и кипения сравнительно низкие. У веществ с немолекулярной структурой химическая связь между частицами весьма прочная, поэтому их температуры плавления и кипения высокие.
1.3.2. Массы атомов и молекул. Моль
Массы атомов и молекул чрезвычайно малы, поэтому для них используют специальную единицу измерения – атомную единицу массы (сокращенное обозначение «а. е. м.»):
1 а. е. м. = 1,66·10–27 кг.
Например, абсолютная масса атома алюминия:
mo(Al) = 4,482·10–26 кг = 27 а. е. м.
Чаще используют безразмерные величины – относительные атомные и молекулярные массы.
Относительная атомная масса Ar – число, показывающее, во сколько раз масса данного атома больше 1/12 массы атома углерода 12С.
Например:
Ar(Al)
=
 = 27.
= 27.
Относительная молекулярная масса Mr – число, показывающее, во сколько раз масса данной молекулы больше 1/12 массы атома углерода 12С.
Например:
Mr(SO2)
=
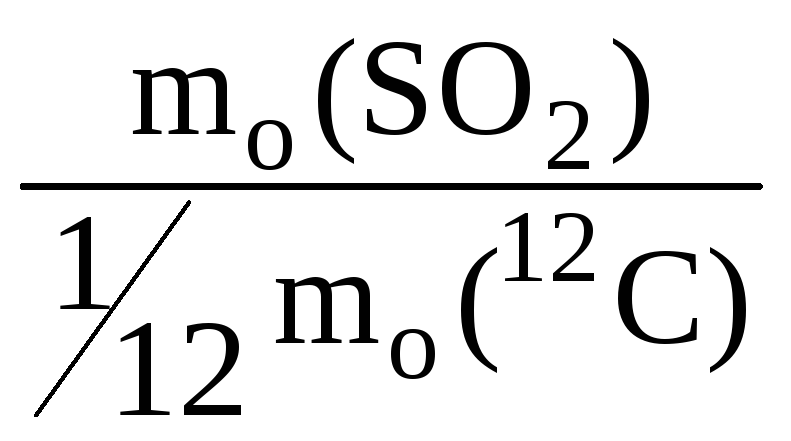 = 64.
= 64.
Наряду с единицами массы и объема, в химии пользуются также единицей количества вещества, называемой молем (сокращенное обозначение – «моль»).
Моль – это количество вещества, содержащее столько же структурных единиц (атомов, молекул, ионов, ядер, электронов, радикалов), сколько содержится атомов в 0,012 кг (12 г) углерода 12C.
В одном моле любого вещества содержится число Авогадро структурных единиц, а именно
NA = 6,02·1023 моль–1.
Моль вещества имеет определенную массу (молярную массу) и определенный объем (молярный объем).
Молярная (мольная) масса М – это масса 1 моль вещества, выраженная в единицах массы:
M(Al) = 27 г/моль; M(H2SO4) = 98 г/моль.
Молярный (мольный) объем Vm – объем 1 моль вещества, выраженный в единицах объема:
Vm(CO2) = 22,4 л/моль (н. у.)1; Vm(H2O) = 18 мл/моль.
Пример 1.1. Во время войны во Вьетнаме (1962–1971 гг.) американские войска широко использовали дефолианты в борьбе с партизанами. Дефолиант «agent orange» (оранжевый реактив) вызывает ускоренное опадание листьев деревьев. Всего над джунглями было распылено 57 тыс. т этого препарата, в котором в виде примеси содержалось до 170 кг диоксина. Сейчас этот дефолиант известен под названием 2,4-D (2,4-дихлорфеноуксусная кислота). Рассчитайте массу одной молекулы дефолианта (молекулярная формула С8Н6O3Cl2): а) в граммах; б) в атомных единицах массы.
Решение:
а). Для расчета массы молекулы 2,4-дихлорфеноуксусной кислоты необходимо знать ее молярную массу:
М(С8Н6O3Cl2) = 8 · 12 + 6 · 1 + 3 · 16 + 2 · 35,5 = 221 (г/моль).
Рассчитываем количество вещества по следующим формулам:
ν = m / M; ν = N / NA,
где m – масса, M – молярная масса, N – число атомов или молекул, NA = 6,02·1023 моль–1 – постоянная Авогадро.
Объединив эти формулы можно выразить массу через число молекул:
m
= ν
· M
=
![]() .
.
Подставляя в полученную формулу N = 1, M = 221 г/моль, NA, находим:
m(С8Н6O3Cl2)
=
![]() =
36,7·10–23
(г).
=
36,7·10–23
(г).
б). Абсолютная масса молекулы равна относительной молекулярной массе, умноженной на 1 а. е. м.
m(С8Н6O3Cl2) = 1 а. е. м. · Mr(С8Н6O3Cl2)
Относительная молекулярная масса численно равна молярной массе:
Mr(С8Н6O3Cl2) = 221;
m(С8Н6O3Cl2) = 1 а. е. м. · 221 = 221 а. е. м.
Пример 1.2. Сколько молекул содержится в 1 л воды?
Решение. 1. Массу 1 л воды можно вычислить, используя величину плотности (плотность воды при 4С равна 1 г/см3):
m(H2O) = V(H2O) · ρ(H2O);
V(H2O) = 1 л = 1 дм3 = 1000 см3;
m(H2O) = 1000 см3 · 1 г/см3 = 1000 г.
2. Дальнейшие рассуждения можно вести двумя способами.
1 способ: по количеству вещества.
Пользуясь формулами ν = m / M и ν = N / NA, находим:
ν(Н2О) = m(Н2О) / M(Н2О); ν(Н2О) = 1000 г / 18 г/моль = 55,6 моль.
N(H2O) = ν(Н2О) · NA; N(H2O) = 55,6 моль · 6,02·1023 моль–1 = 334,7·1023 = 3,35·1025.
2 способ: с помощью пропорции.
18 г (1 моль) H2O содержат 6,02·1023 молекул;
1000 г Н2О содержат N молекул.
N(H2O) = 1000 · 6,02·1023 / 18 = 3,35·1025.
Пример 1.3. Вычислите молярный объем алюминия, если его плотность составляет 2,7 г/см3.
Решение. Для вычисления молярного объема через плотность вещества необходимо знать его молярную массу:
ρ(Al)
=
![]() ;Vm(Al)
=
;Vm(Al)
=
![]() .
.
Vm(Al)
=
![]() = 10 см3/моль
= 0,01 л/моль.
= 10 см3/моль
= 0,01 л/моль.
