
- •Краткий курс
- •Карбоновые кислоты и их производные
- •1. Способы получения карбоновых кислот
- •1.1. Реакции окисления
- •1.2. Синтез карбоновых кислот из галогенопроизводных
- •1.2.1.Синтез карбоновых кислот через нитрилы
- •1.2.2. Синтез карбоновых кислот реакцией Гриньяра
- •1.3. Гидролиз производных карбоновых кислот
- •2. Химические свойства карбоновых кислот
- •2.1. Кислотно-основные свойства
- •2.2. Декарбоксилирование карбоновых кислот
- •2.3. Галогенирование карбоновых кислот
- •3. Производные карбоновых кислот
- •3.1. Реакции нуклеофильного замещения: механизм и реакционная способность
- •3.2. Сложные эфиры
- •3.1.1. Способы получения
- •3.1.2. Химические свойства
- •3.3. Галогенангидриды
- •3.4. Ангидриды
- •3.5. Амиды
- •3.5.1. Способы получения
- •3.5.2. Химические свойства
- •3.6. Нитрилы
- •4. Α,β-Ненасыщенные карбоновые кислоты
- •4.1. Способы получения
- •4.2. Химические свойства
- •5. Дикарбоновые кислоты
- •5.1. Способы получения
- •5.2. Свойства дикарбоновых кислот
- •5.3. Малоновый эфир
- •6. Задачи и упражнения
- •1. Способы получения
- •1.1. Восстановление азотсодержащих соединений
- •1.2. Алкилирование аммиака и аминов
- •2. Химические свойства
- •2.1. Основность аминов
- •2.2. Амины как нуклеофилы
- •2.2.1. Алкилирование и ацилирование аминов
- •2.2.2. Взаимодействие первичных и вторичных аминов с альдегидами и кетонами
- •2.2.3. Взаимодействие аминов с азотистой кислотой
- •2.3. Особенности химического поведения ароматических аминов
- •2.3.1. Реакции электрофильного замещения
- •2.3.2. Превращения первичных ароматических аминов через соли арилдиазония
- •3. Задачи и упражнения
2.3. Галогенирование карбоновых кислот
Для карбоновых кислот, имеющих атом водорода в α-положении к карбоксильной группе, возможно замещение этого атома на атом хлора или брома. Галогенирование осуществляют хлором или бромом соответственно в присутствии красного фосфора или трихлорида фосфора. Например, при взаимодействии масляной кислоты с бромом в присутствии красного фосфора образуется 2-бромбутановая кислота, а реакция фенилуксусной кислоты с хлором в присутствии трихлорида фосфора приводит к 2-фенил-2-хлорэтановой кислоте.
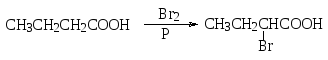

3. Производные карбоновых кислот
3.1. Реакции нуклеофильного замещения: механизм и реакционная способность
Наиболее характерными реакциями карбоновых кислот и их производных являются реакции нуклеофильного замещения при карбонильном атоме углерода. Общий механизм этих реакций выглядит следующим образом:

Нуклеофил Y¯ присоединяется к электрофильному атому углерода карбонильной группы с образованием аддукта, от которого затем отщепляется уходящая группа вместе с парой электронов. Таким образом, нуклеофильное замещение реализуется как двухстадийный процесс – присоединение с последующим отщеплением. Реакции могут катализироваться как кислотами (происходит протонирование карбонильной группы и увеличение электрофильности карбонильного атома углерода), так и основаниями (этот катализ позволяет генерировать более сильную нуклеофильную частицу из слабых нейтральных нуклеофилов, например, реакции с водой как нуклеофилом в нейтральной среде протекают медленнее, чем в щелочной, т.к. гидроксид-анион более нуклеофилен, чем вода).
Реакционная способность карбоновых кислот и их производных в реакциях нуклеофильного замещения зависит от электрофильности карбонильного атома углерода. Все производные карбоновых кислот по ацилирующей способности можно расположить в следующий ряд ее уменьшения:






Наиболее реакционноспособны галогенангидриды карбоновых кислот, в молекуле которых атом галогена проявляет сильный отрицательный индуктивный эффект, а сопряжение (+М-эффект) невелико. Уходящей группой при этом является галогенид-анион, низкая основность которого позволяет ему легко уйти. Затем по активности следуют ангидриды карбоновых кислот. Их реакционная способность несколько ниже, чем у галогенангидридов, поскольку атом кислорода проявляет бóльший по сравнению с атомом галогена положительный мезомерный эффект (следовательно, частичный положительный заряд на карбонильном атоме углерода меньше). Кроме того, карбоксилат-анион как уходящая группа более основен, поэтому он уходит труднее, чем атом галогена в галогенангидридах. Далее в ряду условно (поэтому в скобках) стоят карбоновые кислоты. Их реакционная способность достаточно высока, но только в кислой среде. Поскольку нуклеофилы являются также и основаниями, то кислотный катализ не всегда можно использовать, и в этом случае карбоновые кислоты реагируют с нуклеофилами как кислоты и депротонируются (например, в реакции с аммиаком или достаточно основными аминами при нормальных условиях), превращаясь в совершенно неактивные соли, стоящие в ряду реакционной способности на последнем месте. Действительно, от отрицательно заряженной частицы трудно ждать активности в реакции с нуклеофилами, т.к. известно, что одноименно заряженные частицы отталкиваются. Сложные эфиры по ацилирующей способности сравнимы с карбоновыми кислотами, но алкоксигруппа уходит труднее, чем гидроксильная, т.к. алкоксид-анион более основен, чем гидроксид-анион. И еще менее реакционноспособны в реакциях нуклеофильного замещения амиды, в которых аминогруппа проявляет более сильный +М-эффект, т.к. электроотрицательность азота меньше, чем кислорода.
