
- •Часть 3. Электричество
- •Электричество Литература
- •§1. Введение
- •Глава 1. Электростатика §2. Законы электростатики
- •§3 Электрическое поле в вакууме. Напряженность и потенциал
- •§4 Электростатическая теория Гаусса
- •§5 Проводники в электрическом поле.
- •§6 Диэлектрики в электрическом поле
- •§7. Энергия электрического поля. Конденсаторы.
- •§8. Законы постоянного тока
- •§9. Ток в металлах.
- •§10. Ток в электролитах
- •§11. Ток в газах.
- •Глава 3. Магнитное поле §12. Магнитное взаимодействие электрических токов
- •§13. Вычисление магнитных полей
- •§ 14. Действие магнитного поля на токи и движущиеся заряды
- •§15. Эффекты, возникающие при движении заряженных частиц в магнитном поле
- •§16. Электромагнитная индукция
- •§17. Поле в магнетиках. Диамагнетизм
- •§18. Пара - и ферромагнетики
- •§19. Уравнения Максвелла
- •Глава 4. Электромагнитные колебания и волны §20. Переменный ток
- •§21. Электрические колебания в колебательном контуре. Колебательные системы.
- •§22. Электромагнитные волны
- •Глава 5. Электрические явления в атмосфере §23. Электричество атмосферы
- •Оглавление
§10. Ток в электролитах
1. Электролиты жидкие или твердые вещества, в которых присутствуют ионы, обуславливающие возможность прохождения электрического тока. Из жидких электролитов наиболее важны водные растворы кислот, солей и щелочей.
Молекулы растворяющихся веществ и молекулы растворителей, образующих электролиты, полярны. Их взаимодействие приводит к распаду молекул растворяющихся веществ на ионы. Этот процесс называется электролитической диссоциацией. Суть ее в том, что полярная молекула растворимого вещества, например, NaCl, разрывается полярными молекулами растворителя, например, воды H2O (рис.56).
В ода
имеет высокую диэлектрическую
проницаемость,
ода
имеет высокую диэлектрическую
проницаемость,
![]() = 81.
Поэтому электрическое взаимодействие
между ионами молекул кислот, солей и
щелочей ослабляется настолько сильно,
что для распада молекул на отдельные
ионы достаточно тепловой энергии
движения молекул раствора.
= 81.
Поэтому электрическое взаимодействие
между ионами молекул кислот, солей и
щелочей ослабляется настолько сильно,
что для распада молекул на отдельные
ионы достаточно тепловой энергии
движения молекул раствора.
Молекулы воды являются жесткими диполями, они образуют вокруг свободных ионов устойчивую гидратную оболочку. Эта оболочка препятствует рекомбинации обратному соединению ионов в нейтральные молекулы, и увеличивают сопротивление движению иона в растворе.
Доля распавшихся на ионы молекул растворенного вещества обозначается и называется степенью электролитической диссоциации. Величина может измеряться неэлектрическими методами, например, по величине осмотического давления. (Часть 2, §19).
2. Законы разбавления. С уменьшением концентрации раствора п коэффициент растет. Зависимость (п) установил Вильгельм Оствальд в 1888г., исходя из условия динамического равновесия процессов диссоциации и рекомбинации.
Для одноступенчатой диссоциации, когда молекула распадается на два иона, число распадов в единице объема раствора пропорционально числу нераспавшихся молекул и равно А(1 )п, где А коэффициент.
С другой стороны, число актов воссоединения пропорционально концентрации положительных ионов и концентрации отрицательных ионов и равно В(п)2, где В коэффициент. В состоянии равновесия
А(1
)п = В(п)2,
![]() .
Закон разбавления Оствальда, 1888.
(10.1)
.
Закон разбавления Оствальда, 1888.
(10.1)
При п![]() 0
1.
0
1.
 1. Законы
электролиза. Электролизом называют
процесс прохождения через электролит
электрического тока. В это явление
входят также все процессы электрохимического
окисления восстановления, происходящие
на электродах в момент прохождения
электрического тока. В результате на
электродах выделяются продукты разложения
раствора.
1. Законы
электролиза. Электролизом называют
процесс прохождения через электролит
электрического тока. В это явление
входят также все процессы электрохимического
окисления восстановления, происходящие
на электродах в момент прохождения
электрического тока. В результате на
электродах выделяются продукты разложения
раствора.
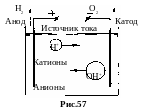
Например, при электролизе воды на катоде выделяется газообразный водород, а на аноде газообразный кислород (рис.57).
На катоде: 4H+ + 4e → 2H2↑
На аноде: 4OH - 4e → H2O + O2↑.
Положительные ионы, идущие на катод (отрицательный электрод), называются катионами. Отрицательные ионы, идущие на анод (положительный электрод), называются анионами.
а. Закон Ома для электролитов.
Плотность электрического тока при
направленном движении однозарядных
частиц одного знака определяется
формулой (9.5),
,
где
![]() - скорость дрейфа частиц в электрическом
поле. В электролитах есть заряды обоих
знаков, поэтому плотность тока есть
сумма:
- скорость дрейфа частиц в электрическом
поле. В электролитах есть заряды обоих
знаков, поэтому плотность тока есть
сумма:
![]() .
(10.2)
.
(10.2)
Если молекула распадается на два иона,
то n+ =
n
=n,
где n концентрация
молекул растворенного вещества,
их
степень диссоциации. Ионы двигаются в
вязкой среде, их скорости пропорциональны
напряженности поля
,
так что
![]() .
Здесь b+
подвижность положительных ионов, b
подвижность
отрицательных ионов. Так как скорость
отрицательных ионов
.
Здесь b+
подвижность положительных ионов, b
подвижность
отрицательных ионов. Так как скорость
отрицательных ионов
![]() противоположна скорости
положительных ионов
противоположна скорости
положительных ионов
![]() ,
то b
отрицательное число. Полагая е
=
е+= е,
получаем:
,
то b
отрицательное число. Полагая е
=
е+= е,
получаем:
![]() .
Закон Ома
для электролитов (10.3)
.
Закон Ома
для электролитов (10.3)
Оба слагаемые в скобках положительные числа. Коэффициент перед Е есть удельная электропроводность электролита.
Если в электролите не одно-, а многозарядные ионы с валентностью z, то коэффициент электропроводности увеличивается в z раз. g = zne(b+ b-). (10.4)
Например, в растворе CuSO4 z = 2, в растворе Al(NO3)3 z = 3.
С ростом температуры электропроводность электролитов увеличивается. В нешироком диапазоне температур эта зависимость приближается к линейной и может быть представлена эмпирической формулой: g = g25[1 + (t 25)]. (10.5)
Здесь g25 электропроводность при t = 25С, температурный коэффициент. Для сильных кислот = 0,0164, для сильных оснований = 0,0190, для солей = 0,0220.
Температурный рост электропроводности объясняется увеличением концентрации свободных ионов и увеличением их подвижности за счет падения вязкости раствора.
б. Законы Фарадея. Их два.
Первый закон: масса m выделившегося на электроде вещества пропорциональна заряду q, прошедшему через раствор, m = kq. (10.6)
Здесь k коэффициент пропорциональности, его наэывают электрохимическим эквивалентом вещества. Численно он равен массе вещества, выделившегося на электроде при прохождении через электролит 1 Кл электричества. Например, у серебра Ag k = 1,118 мгКл, у меди Cu k = 0,329 мгКл.
Второй закон: электрохимический
эквивалент вещества k
пропорционален его химическому
эквиваленту Э,
![]() .
(10.7)
.
(10.7)
Здесь F коэффициент, его называют числом Фарадея.
Рассмотрим содержание второго закона.
Если при осаждении на электроде массы
m вещества прошел
заряд q = Nez, где
N число
разрядившихся на электроде ионов,
z их
валентность, то k = mq = mNez.
Но число молекул в массе m
вещества равно N = NA(m/M),
где M
молярная масса вещества. Отсюда
![]() .
(10.8)
.
(10.8)
Очевидно, химический эквивалент вещества Э есть отношение молярной массы вещества к валентности, Э = Mz. Так, у водорода H Э = 1 гмоль, у кислорода O Э = 162 = 8 гмоль, у кальция Са Э = 402 = 20 гмоль и т.д.
Число Фарадея F есть заряд, необходимый для осаждения на электроде 1 химического эквивалента любого вещества. F = 1,610196 1023 = 9,6 104 Кл.
4. Определение заряда ионов. Пользуясь законами Фарадея, можно определить заряд ионов разных веществ. Для этого нужно провести такой электролиз, в результате которого эти ионы, окисляясь или восстанавливаясь на электроде (отдают или принимают электроны), выделяются в виде нейтрального вещества выводятся из электролита.
Если масса выделившегося вещества m, то из законов Фарадея
![]() .
(10.9)
.
(10.9)
Таким путем можно определить кратность заряда иона по отношению к элементарному заряду. Например, ион водорода H+, его заряд +1,61019 Кл, z = 1, ион однозарядный. Ион кислорода О , есть заряд 3,21019 Кл, z = 2, ион двухзарядный, и т.д.
5. Примеры электролиза. Это один из современных методов получения материалов и улучшения их свойств.
а. Промышленное получение алюминия. Электролит 10% раствор глинозема Al2O3 в криолите Na3AlF6 при температуре 950С. Анод и катод изготовлены из прессованных угольных брикетов. Анод опускается в электролит сверху, катод располагается на дне стальной ванны. На катоде выделяется алюминий, на аноде кислород.
Диссоциация: 2Al2 O3 4Al+++ + 6О .
На катоде: 4Al+++ + 12е- 4Al. На аноде: 6О 12е- 3O2,
3O2 + 3С 3СO2.
Плотность алюминия = 2,7103 кг/м3 больше плотности электролита. Поэтому чистый расплав алюминия собирается на дне ванны. Выделяющийся на аноде кислород соединяется с углеродом в оксиды 3СO2 и СO.
б. Промышленное получение едкого натра NaOH. Электролит раствор NaCl в воде, электроды металлическая платина. На аноде выделяется первичный продукт газообразный хлор, на катоде вторичный продукт газообразный водород.
Диссоциация: 2NaCl 4Na+ + 2Cl .
На катоде: 2Cl 2е Cl2. На аноде: 2Na+ + 2е 2Na,
2Na + 2H2O 2NaOH + H2.
Выделяющийся на катоде металлический натрий сразу взаимодействует с водой с образованием едкого натра NaOH. Постепенно раствор H2O + NaCl превращается в раствор H2O + NaOH.
в. Лабораторный метод получения металлического натрия повторяет предыдущую схему с той разницей, что катодом является не платина Pt, а металлическая ртуть Hg. Выделяющийся натрий растворяется в ртути, поэтому вторичной реакции натрия с водой нет. Процесс растворения может продолжаться до тех пор, пока раствор натрия в ртути не станет твердым. После достижения насыщения раствора Na + Hg реакция пойдет по схеме б.
Отделяется натрий от ртути обычно прокаливанием. Испаряющаяся ртуть конденсируется в холодильнике.
г. промышленное получение металлического натрия. Электролит эвтектическая смесь NaCl + СаCl2 при температуре несколько больше 5050С. Анод уголь, катод сталь. На аноде выделяется газообразный хлор, на катоде жидкий натрий.
Диссоциация: 2NaCl 2Na+ + 2Cl -.
На катоде: 2Cl - 2е Cl2. На аноде: 2Na+ + 2е 2Na.
В атомной энергетике натрий-калиевый сплав используют в качестве жидкометаллических теплоносителей в первичных контурах ядерных реакторов.
д. Электролитическая очистка цветных металлов (рафинирование) основана на том, что для выделения на катоде металлов из раствора требуется некоторое минимальное напряжение. Его называют напряжением разложения электролита. У разных металлов оно разное. При электролитическом рафинировании напряжение на электродах подбирается таким, чтобы на катоде осаждался основной металл, а примеси переходили в раствор или оседали на дне ванны.
Например, нормальный электродный потенциал меди относительно водородного электрода сравнения +0,346 В. У Au и Ag эта величина больше, а у Ni, Zn меньше. Если в электролит CuSO4 (15%) + H2SO4 (10%) + H2O в качестве анода погрузить медный слиток, полученный после огневой очистки, и пропускать при таком напряжении ток, то анод будет растворяться. Ионы меди будут осаждаться на катоде, благородные металлы не растворяясь, оседают на дно ванны, а ионы Ni++, Zn++ остаются в растворе.
Осаждая таким способом на готовые металлические изделия слои Au, Ag, Cu, Ni, Cr, Zn, можно создавать на поверхности этих изделий декоративные и защитные покрытия (гальваностегия).
д. Электродный потенциал. Между любым металлом, погруженным в любой электролит, и этим электролитом всегда возникает некоторая разность потенциалов. Потенциал металла относительно электролита называется электродным. У разных металлов электродные потенциалы разные.
Возникновение электродного потенциала можно объяснить так. Допустим, в водный раствор соли ZnSO4 погружен цинковый электрод. Молекулы ZnSO4 в растворе продиссоциировали на ионы Zn++ и SO4 . В результате диффузии некоторые анионы SO4 оказываются у поверхности электрода. Обладая сильным электроотрицательным полем, они “выдавливают” валентные электроны ближайшего атома цинка вглубь кристаллической решетки и соединяются с образовавшимся ионом Zn++ в молекулу ZnSO4.
Силы, удерживающие молекулу ZnSO4 на поверхности цинка, много меньше сил, удерживающей нейтральный атом цинка в кристаллической решетке.
Под действием теплового движения частиц раствора молекула ZnSO4 переходит в раствор и там диссоциирует. В результате на электроде появились два “лишних” электрона, а в растворе “лишний” положительно заряженный ион Zn++. Электрод заряжается отрицательно, раствор положительно.
П ереход
ионов металла из электрода в раствор
процесс обратимый. То есть могут
происходить и происходят обратные акты
переходы ионов металла из раствора на
электрод. С ростом потенциала
электрода относительно раствора
процесс отрывания ионов Zn++
от металла будет замедляться, а процесс
возвращения ионов цинка Zn++
из раствора к металлу будет нарастать.
При некотором значении потенциала эти
потоки сравняются, наступит равновесие.
ереход
ионов металла из электрода в раствор
процесс обратимый. То есть могут
происходить и происходят обратные акты
переходы ионов металла из раствора на
электрод. С ростом потенциала
электрода относительно раствора
процесс отрывания ионов Zn++
от металла будет замедляться, а процесс
возвращения ионов цинка Zn++
из раствора к металлу будет нарастать.
При некотором значении потенциала эти
потоки сравняются, наступит равновесие.
Вблизи поверхности отрицательно заряженного металла концентрация его положительных ионов максимальна. Говорят, возникает двойной электрический слой (рис.58).
Электродный потенциал металла зависит от концентрации раствора, но не зависит от типа анионов. Например, электродный потенциал цинка в растворах равных концентраций разных солей ZnSO4, ZnCl2, Zn(NO3)2 и т.д. один и тот же.
Договорились в качестве характеристики вещества электрода указывать нормальный электродный потенциал, соответствующий концентрации раствора соли 1 эквивалент на литр (нормальный раствор).
В таблице 10.1 приведены значения нормальных электродных потенциалов для систем металл/раствор соли того же металла при 25С.
Таблица 10.1 |
|||||
Электролит |
, В |
Электролит |
, В |
Электролит |
, В |
Литий LiLi+ Калий KK+ Натрий NaNa+ Магний MgMg++ Алюминий AlAl+++ Цинк ZnZn++ |
-3,045 -2,925 -2,714 -2,37 -1,66 -0,763 |
Железо FeFe++ Кадмий CdCd++ Кобальт CoCo++ Никель NiNi++ Олово SnSn++ Свинец PbPb++ |
-0,440 -0,403 -0,277 -0,250 -0,136 -0,126 |
Водород H2H+ Медь CuCu++ Медь CuCu+ Ртуть HgHg+ Серебро AgAg+ Золото AuAu+++ |
0,0000 +0,337 +0,521 +0,798 +0,799 +1,50 |
К ак
видно из таблицы, наряду с преобладанием
процесса растворения металла, когда
его ионы переходят в электролит (Li,
K…Pb), может преобладать и обратный
процесс, когда ионы из раствора осаждаются
на металл (Cu, Hg…Au). В этом
случае металл заряжается положительно,
электролит
отрицательно (рис.59).
ак
видно из таблицы, наряду с преобладанием
процесса растворения металла, когда
его ионы переходят в электролит (Li,
K…Pb), может преобладать и обратный
процесс, когда ионы из раствора осаждаются
на металл (Cu, Hg…Au). В этом
случае металл заряжается положительно,
электролит
отрицательно (рис.59).
7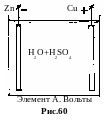 .
Химические источники тока. Подбирая
пары металлов с достаточно большой
разностью электродных потенциалов,
получают химические источники тока или
гальванические элементы (по имени
итальянца Луиджи Гальвани, открывшего
в 1786 году появление электричес-кого
тока в тканях лягушки при контакте
разнородных металлов). ЭДС химических
источников тока получается как разность
электродных потенциалов веществ,
образующих элемент.
.
Химические источники тока. Подбирая
пары металлов с достаточно большой
разностью электродных потенциалов,
получают химические источники тока или
гальванические элементы (по имени
итальянца Луиджи Гальвани, открывшего
в 1786 году появление электричес-кого
тока в тканях лягушки при контакте
разнородных металлов). ЭДС химических
источников тока получается как разность
электродных потенциалов веществ,
образующих элемент.
Рассмотрим наиболее известные гальванические элементы:
а. Элемент А.Вольты, 1794г. Первый химический источник тока, нашедший широкое практическое применение. Состав: медь Cu, цинк Zn, водный раствор серной кислоты H2SO4 (рис.60). Это необратимый элемент. Энергия в нем вырабатывается за счет реакции раство-рения цинка в кислоте. ЭДС элемента Вольты E =(Cu) (Zn) = 0,337(0,763) = 1,1 В.
б .
Элемент Д.Даниэля, 1836г.
Состав: медь Cu, цинк
Zn, раствор сульфата
меди CuSO4,
раствор сульфата цинка ZnSO4.
Растворы CuSO4
и ZnSO4
разделены перегородкой из необожженной
глины (рис.61). Перегородка не мешает
прохождению ионов, но предохраняет
растворы от быстрого перемешивания.
Это обратимый элемент.
.
Элемент Д.Даниэля, 1836г.
Состав: медь Cu, цинк
Zn, раствор сульфата
меди CuSO4,
раствор сульфата цинка ZnSO4.
Растворы CuSO4
и ZnSO4
разделены перегородкой из необожженной
глины (рис.61). Перегородка не мешает
прохождению ионов, но предохраняет
растворы от быстрого перемешивания.
Это обратимый элемент.
С цинкового электрода ионы цинка Zn++ переходят в раствор, а ионы меди Cu++ переходят из раствора на медный электрод. Поэтому в окрестности медного электрода образуется избыток ионов SO4 , а в районе цинкового их недостаток. Ионы SO4 мигрируют от Cu к Zn через пористую перегородку.
Э лемент
Даниэля первый
источник довольно устойчивого постоянного
тока его ЭДС 1,1 В.
лемент
Даниэля первый
источник довольно устойчивого постоянного
тока его ЭДС 1,1 В.
в. Элемент Лекланше, 1865г. В цинковый стакан, являющийся отрицательным электродом заливается 15% - й раствор хлористого аммония NH4Cl (рис.62). положительный электрод угольный стержень, окруженный деполяризатором MnO2. Современные технические модификации элемента Лекланше широко применяются как бытовые химические источники тока. ЭДС элемента 1,5 В.
г. Ртутно-кадмиевый нормальный элемент (элемент фирмы Вестон), 1892г. Нормальный - от слова норма - эталон для проверки. Его ЭДС устойчива к изменению температуры. Состав: кадмий Cd, ртуть Hg, анальтама кадмия (раствор Cd + Hg), растворы CdSO4 и HgSO4 в воде (рис.63). Широко применяется в точных измерениях для калибровки потенциометров. Его ЭДС 1,0186 В.
1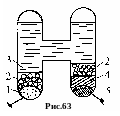 -амальгама
кадмия (10%Сd+90%Hg) (отрицательный
электрод), 2-кристаллы 3CdSO48H2O,
3- электролит (насыщенный водный
раствор CdSO4),
4- деполяризатор (паста из Hg2SO4,
5- жидкая ртуть (положительный электрод).
-амальгама
кадмия (10%Сd+90%Hg) (отрицательный
электрод), 2-кристаллы 3CdSO48H2O,
3- электролит (насыщенный водный
раствор CdSO4),
4- деполяризатор (паста из Hg2SO4,
5- жидкая ртуть (положительный электрод).
8. Поляризация гальванических элементов это изменение электродных потенциалов при наличии тока в цепи.
Если замкнуть на некоторое сопротивление R элемент Вольты, то с течением времени ток в цепи будет уменьшаться. Причина этого в том, что ионы водорода диффундируют в электролите от цинка к меди и выделяются на медном электроде. В результате на меди появляется пленка водорода, увеличивающая электрическое сопротивление элемента. Кроме того, медный электрод как бы заменяется водородным электродом с меньшим потенциалом. Вместо +0,337(Cu) становится 0,00(Н2)(cм. Табл.10.1).
Устранение поляризации (деполяризация) достигается с помощью пористых перегородок (элемент Даниэля) или с помощью химических деполяризаторов веществ, являющихся сильными окислителями. Деполяризаторы переводят выделяющийся водород в воду. Например, оксид марганца (IV) в элементе Лекланше, Н2 + MnO2 Н2O + MnO.
9. Аккумуляторы химические источники электрического тока многоразового использования. В основе их действия лежит явление поляризации. Работа аккумуляторов включает в себя режим зарядки и режим разрядки. Рассмотрим их принцип действия на примере свинцового (кислотного) аккумулятора.
а. Зарядка. Допустим, в ванну с водой Н2O опустили два электрода решетчатых контейнера из свинца, заполненных сульфатом свинца PbSO4. Часть соли растворится в воде с образованием ионов Pb++ и SO4 . Потенциалы электродов одинаковы. ЭДС элемента равна нулю.
Подключим к электродам внешний источник постоянного тока и проведем электролиз.
На аноде, то есть электроде, присоединенном к “плюсу” источника тока, потенциал положителен. Это значит, что источник тока “вытягивает” из анода электроны. Так как анионы SO4 очень прочные, они не отдают в цепь свои электроны. Электроны теряют ионы свинца, переходя из двух- в четырехвалентное состояние. Pb+2 2е Pb+4. Поскольку сульфата 4-х валентного свинца не существует, то переход PbSO4 Pb(SO4)2 не реализуется. Вместо этого анод взаимодействует с молекулами воды.
PbSO4 + 2Н2O 2е = PbO2 + Н2SO4 + 2Н+.
На одну молекулу соли требуется две молекулы воды. В результате реакции образуется молекула диоксида свинца PbO2, молекула серной кислоты, которая переходит в раствор и там диссоциирует, и два иона водорода. Анодное пространство в электролите приобретает положительный заряд.
На катоде, то есть электроде, присоединенном к “минусу” источника тока, потенциал отрицателен. Это значит, что источник тока посылает в катод электроны. В результате ионы свинца восстанавливаются в атомы металлического свинца, высвобождая в раствор отрицательные анионы SO4 : PbSO4 + 2е = Pb + SO4 .
Околокатодное пространство приобретает отрицательный заряд. На два атома свинца, изменивших свое состояние (один на аноде, другой на катоде) образуется две молекулы серной кислоты. В целом электролит остается нейтральным.
б. Разрядка. Если отсоединить источник тока и замкнуть электроды аккумулятора проводником, то в цепи пойдет ток противоположного направления, а реакции пойдут в обратную сторону. Дело в том, что в результате электролиза аккумулятор поляризовался. Разность потенциалов системы PbO2 Н2SO4 Pb в конце зарядки достигает 2,7 В.
На практике при изготовлении аккумуляторов рассмотренная схема не применяется. Для получения анода в контейнеры заформовывают свинцовый сурик Pb3O4 (ярко красное вещество, используемое также для изготовления красок), а для получения катода свинцовый тлёт PbO красновато-желтый порошок. После заливки 2530% -го раствора серной кислоты Н2SO4 аккумулятор тренируют подвергают несколько раз зарядке и разрядке.
Наряду с кислотными в настоящее время широко применяются щелочные железо никелевые аккумуляторы [Ni(OH)3 (анод) 20% КОН Fe(катод)].
