
- •II. Реакции окисления
- •III. Термические превращения алканов
- •53. Алкены. Изомерия и номенклатура. Электронное строение. Р-ции в боковой цепи. Использование в лабораторной практике и промышленности.
- •Галогенирование Механизм электрофильного присоединения.
- •Гидрогалогенирование
- •Присоединение протонных кислот и воды
- •Реакция полимеризации
- •7. Реакции замещения (реакции радикального замещения аллильного атома водорода). Реакция алкенов в боковой цепи.
- •54. Алкены. Р-ции присоединения по двойной связи (гидрогенирование, галогенирование, гидрогалогенирование, гидратация, полимеризация, окисление) мех-мы и основные закономерности.
- •55. Алкины. Изомерия и номенклатура. Применение алкинов. Образование ацетиленид-анионов и их использование в орг синтезе.
- •56. Реакции присоединения по кратной связи алкинов (гидрогенирования, галогенирования, гидрогалогенирования, гидратации, полимеризации, окисления): механизмы и основные закономерности.
- •57. Алкадиены. Классификация, номенклатура, изомерия, электронное строение. Химические свойства, понятие о термодинамическом и кинетическом контроле реакций присоединения к сопряженным диенам.
- •II. Пространственная
- •58. Арены. Номенклатура, изомерия. Ароматичность, правило Хюккеля. Полициклические ароматические системы.
- •58А. Реакции боковой цепи аренов, представление о механизме, закономерности галогенирования и окисления.
- •60. Реакции бензола и его конденсированных аналогов с нарушением ароматичности (гидрогенирование, окисление, галогенирование).
- •61. Примеры синтетич. Использования р-ций аренов(нитрования, галогенирования, сульфирования, ацилирования, алькилирования по Фриделю Крафтцу). Синтез жирноароматических альдегидов и кетонов
- •62. Представление о реакциях нуклеофильного замещения и элиминирования как конкурентных процессах в ряду монофункционально замещенных углеводородов (галогеналканы, спирты, амины).
- •63. Представление о механизмах мономолекулярного и бимолекулярного нуклеофильного замещения. Факторах, влияющих на направление процесса.
- •65. Взаимодействие галогеналканов с металлами. Представление о строении и использовании в синтезе металлорганических соединений.
- •66. Номенклатура, строение, применение галогеналканов, хим. Св-ва. Р-ции нуклеофильного замещения (с о-, Hal-, n-, с- нуклеофилами). Элиминирование.
- •67. Одноатомные и многоатомные спирты. Номенклатура, изомерия. Физические и медико-биологические свойства. Химические св-ва: реакции нуклеофильного замещения, элиминирования и ацилирования.
- •69. Фенолы. Номенклатура, строение, изомерия. Химические свойства: кислотность (влияние заместителей), р-ции по он-группе (в сравнении с алканами) и ароматическому кольцу (в сравнении с аренами).
- •71. Особенность поведения ароматических аминов. Основность и нуклеофильность аминов. Использование аминов в органическом синтезе.
- •72. 73. Альдегиды и кетоны. Изомерия и номенклатура. Физические и медико-биологические свойства. Взаимодействие альдегидов и кетонов с водородом и нуклеофильными реагентами.
63. Представление о механизмах мономолекулярного и бимолекулярного нуклеофильного замещения. Факторах, влияющих на направление процесса.
Механизм бимолекулярного нуклеофильного замещения (SN2) участвует 2 молекулы субстрата и реагента. Механизм синхронный.
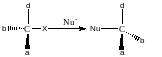
Х – нуклеофуг, уходящая частица. Nu атакует с тыльной стороны (обратной нуклеофугу) ,при этом через переходное состояние образуется продукт замещения. Синхронно! В мех-ме SN1 в скоростеопределяющей р-ции участвует 1 молекула.
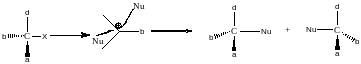
50% 50%
Механизм двухстадийный. 2я стадия быстро, 1я – медленно (скоростеопределяющая). Атака с обеих сторон относительно плоскости катиона равновероятна. Происходит рацимизация.
Доказательства механизма:
Кинетическое. В SN1 V1 = [S] т е реакция имеет 1й порядок
В SN2 V = [S]* [R] т е реакция имеет 2й порядок. Бимолекулярный процесс.
Но! Реакции 1го порядка могут идти по SN2 механизму. Когда концентрация реагента незначительно меняется , но мы не можем зафиксировать это.
Стереохимическое. В SN2 процессе происходит инверсия конфигурации. При этом из оптически чистого вещества образуются другие энантиомеры.

В SN2 процессе с участием хирального субстрата происходит рацимализация.
Факторы, влияющие на протекание:
Строение субстрата. Т. к. в SN2 атака нуклеофила идет с тыла, лимитирующим скорость фактором является размер заместителей. Чем больше атомов Н у реакционного центра, тем быстрее протекает реакция. Быстрее всего реагируют субстраты CH3X > R – CH2 – X
SN1 поскольку > стабильности карбкатион образуется быстрее, при возможном образовании увеличивается стабильность карбкатиона при SN1.
Влияние растворителей. Полярные ускоряют SN1 и SN2
Протонные(кислоты, вода, спирты), апротонные (простые и сложные эфиры). Апротонные лучше сольватируют незаряженные частицы, а протонные растворяют заряженные частицы, то протонные спос. Протеканию SN1, апротонные - SN2
Природа нуклеофила и нуклеофуга. Сильные нуклеофилы и слабые нуклеофуги спос SN2, наоборот – SN1
65. Взаимодействие галогеналканов с металлами. Представление о строении и использовании в синтезе металлорганических соединений.
Металлорганические соединения являются нуклеофильными реагентами, с помощью которых можно наращивать углеводородную цепь.
Взаимодействие с Li,Mg


Реакция Вюрца
Взаимодействие с карбонильными соединениями и производными карбоновых кислот
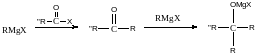
С донорами протонов
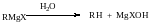
Взаимодействие металлов с дигалогеналканами
66. Номенклатура, строение, применение галогеналканов, хим. Св-ва. Р-ции нуклеофильного замещения (с о-, Hal-, n-, с- нуклеофилами). Элиминирование.
R-H + X. = R-X . Для алканов характерна реакция радикального замещения (галогенирования). Используется Cl, Br, F. I не взаимодействует с алканами.
CH4 + Cl2 = CH3Cl + HCl (хлорметан). Реакция идет далее с образованием дихлорметана, трихлорметана(хлороформ), тетрахлорметана . Механизм проходит в 3 стадии: зарождение цепи, развитие цепи, обрыв цепи.
Г. Никогда не выступают в качестве заместительной группы. Для некоторых г-алканов используют названия в соответствии с рациональной номенклатурой
CH3Cl2 – хлорметан (заместительная)
- метилхлорид (рациональная)
- хлористый метил
Г-алканы вызывают мутагенез. CHCl3 - хлороформ, растворитель каучуков, смол, имеют низкие t температуры кипения.
Характерны реакции алкилирования, нуклеофильного замещения.
Г-нуклеофилы: R-Г1+ Г2 = RГ2 + Г1-
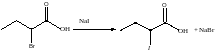
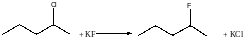
О- нуклеофилы (H2O):Ph-CH2-Cl = Ph-CH2-OH

С щелочами:

N-нуклеофилы: г-алканы используются для алкилирования NH3 и аминов
R-Г + NH3 = R-NH2 = R2-N-H = R3-N (амины)
Элиминирование: получение соединений с = связью.
