
 -----------
-----------
+ -
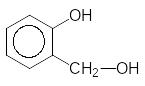
HCH=O + --------- 2-Гідроксибензиловий спирт
-----------

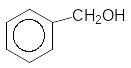
НО 4-Гідроксибензиловий спирт
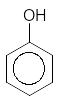
Однак, якщо оцінювати конденсацію, рахуючи субстратом альдегід, а реагентом фенол, то її теж можна віднести до типу АN відносно формальдегіду.
Іі Реакції оліго- і полімеризації
 Це
тип реакцій характерний, в основному,
для альдегідів. При тривалому зберіганні
вони здатні піддаватися циклічній три-
чи тетрамеризації
Це
тип реакцій характерний, в основному,
для альдегідів. При тривалому зберіганні
вони здатні піддаватися циклічній три-
чи тетрамеризації
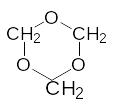
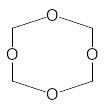
3НСН=О ------------
Формальдегід
Триоксан
4НСН=О ----------
Тетраоксан
 Ацетальдегід
залежно від умов теж може давати різні
олігомери:
Ацетальдегід
залежно від умов теж може давати різні
олігомери:
200C
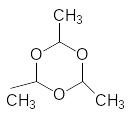
3CH3-CH=O ---------
Паральдегід
00C
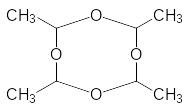
4СH3-CH=O -----------
Метальдегід
Метальдегід використовується як паливо – так званий “сухий спирт”.
Формальдегід легко полімеризується з утворенням полімера лінійної будови – параформа, який є білим порошком, що при нагріванні знову розкладається на формальдегід. Ця властивість використовується при зберіганні та транспортуванні мурашиного альдегіду.
полімеризація
NHCH=O ------------------ HO-(CH2-O)n-H
Параформ (n = 10-12)
ІІІ Реакції відновлення
При відновленні альдегідів утворюються первинні спирті, а кетоні – вторинні:
[H]
R-CH=O --------------- R-CH2-OH,
Альдегід Первинний спирт
[H]
R-C(О)-R1 --------------- R-CH(OH)-R1.
Кетон Вторинний спирт
Як відновники використовують різні сполуки.
1) Відновлення комплексними гідридами – алюмогідридом літію Li[AlH4], борогідридом натрію Na[BH4] та їх похідними, наприклад триметоксиалюмогідридом літію Li[AlH(OCH3)3] чи триетилборогідрид натрію Na[BH(C2H5)3]. Відновники цього типу особливо цінні при відновлюванні ненасичених карбонільних сполук. Оскільки вони селективно відновлюють групу >CH=O, не займачу звязків С=С і СС. У той же час комплексними гідридами не можливо відновлювати деякі гетерофункціональні оксосполуки, що містять цианогрупу -СN, нітрогрупу – NO2, естерну групу – СООR, які відновлюються легше карбонільної групи >CH=O.
Реакцію з Li(AlH4] проводять в апротонних (неполярних розчинниках, оскільки алюмогідрид розкладається водою і навіть спиртами, а з Na[BH4], більш стійкому до дії апротонних розчинників, - у спиртовому чи водному середовищі, наприклад:
Li[AlH4]
CH2=CH-CH=O + H2 ------------------- CH2=CH-CH2-OH
Акролеїн етер Аліловий спирт
Na[BH4]
C6H4-C-CH3 + H2 ------------------- C6H5-CH-CH3
етер
О ОН
Ацетофенон -Фенілетанол
2
 )
Каталітичне
гідрування
проводиться воднем за жорстких умов,
тому може відновлювати не тільки
карбонільну групу, але і кратні звязки
та інші функціональні групи (
-CN, -NO2,
-COOR):
)
Каталітичне
гідрування
проводиться воднем за жорстких умов,
тому може відновлювати не тільки
карбонільну групу, але і кратні звязки
та інші функціональні групи (
-CN, -NO2,
-COOR):
500C, 70 Атм
+ 2H2 ---------------------
Ni
Циклопентен-3-он Циклопентанол
3) Відновлення за реакцією Клемменсена амальгамовим цинком у концентрованій соляній кислоті при нагріванні. Відновлює карбонільну групу до метиленової (-СН2-):
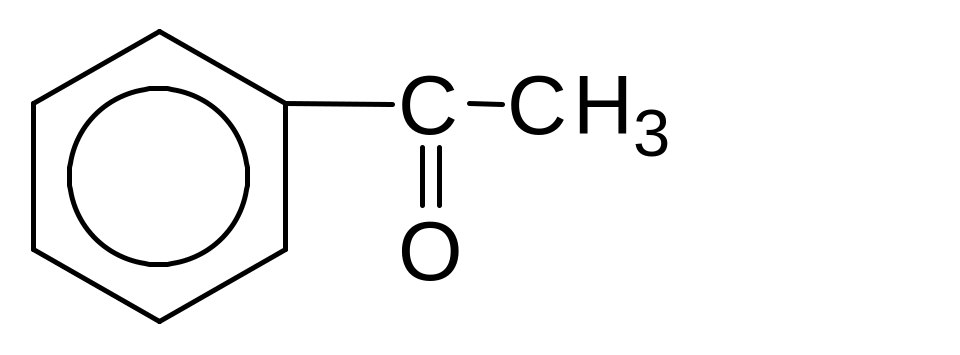
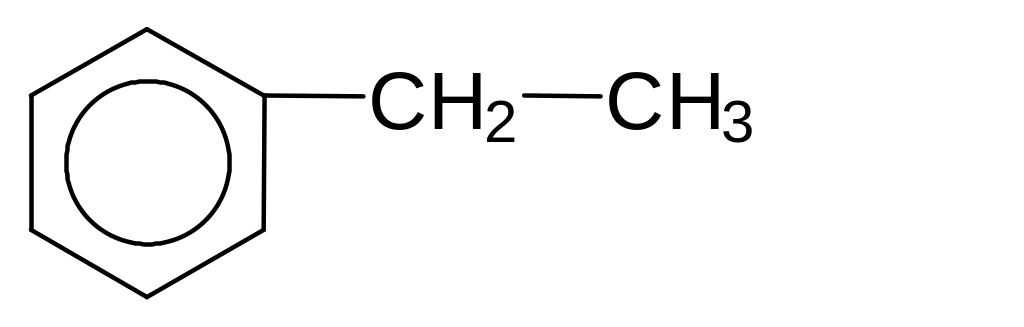 1000C
1000C
+ 2Zn + 4HCl ------- +2ZnCl2 +H2O

 Hg
Hg
НО НО
4-Гідроксиацетофенон 4-Етилфенол
4) Відновлення за реакцією Кіжнера-Вольфа гідразином у лужному середовищі у присутності розчинника з високою температурою кипіння (наприклад, етиленгліколь)
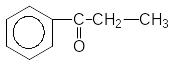
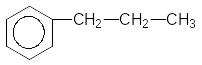 KOH,
2000C
KOH,
2000C
+ N2H4 ------------------- + N2 + H2O
C2H4(OH)2
1-Фенілпропанон-1 Пропілфенол
Дві останні реакції – за Клемменсеном і Кіжнером-Вольфом доповнюють одна одну, оскільки дозволяють відновлювати гетерофункціональні альдегіди і кетони, що містять групи. Чутливі до кислого чи до лужного середовища. Залежно від цього можна відновлювати карбонільні сполуки найзручнішим методом.
ІV Реакції окиснення
Альдегіди окиснюються значно легше, ніж кетони. При окисненні альдегідів утворюються відповідні карбонові кислоти, а окиснення кетонів звичайними окисниками найчастіше проходить деструктивно, із розривом звязків у вуглецевому ланцюгу і дає суміш продуктів, які належать до різних класів:
O [O] O
R-C ---------- R-C
H H
Альдегід Карбонова кислота
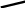 [O],
t0
O O
[O],
t0
O O
 R-C
–CH2-R1
----------
R-C + R1-C
R-C
–CH2-R1
----------
R-C + R1-C
H OH
O
Кетон Суміш карбонових кислот
[O], t0 O
R-C –-CH-R1 ---------- R-C + СН3-С-R1
ОH
O СН3 О
Із загальної закономірності вибивається мурашиний альдегід, який при окисненні яе правило перетворюється не у карбонову кислоту, а в оксид карбону (ІV).
O [O]
 H-C
---------
CO2
+ H2O.
H-C
---------
CO2
+ H2O.
H
Формальдегід
Для окиснення альдегідів використовують лужний чи нейтральний розчин KMnO4, сірчанокислий розчин K2Cr2O7 або CrO3, а для окиснення кетонів – пероксидні сполуки, що містять пероксидну місткову групу –О-О-, наприклад, пероксиоцтова кислота СН3-С(О)-ООН, мононадсірчана H2SO3 і особливо трифторпероксиоцтова CF2-C(O)-OOH.
 O
О
O
О
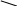 3CH3-C
+ 2KMnO4
+ H2O
3CH3-C
+ 2MnO2
+ 2KOH
3CH3-C
+ 2KMnO4
+ H2O
3CH3-C
+ 2MnO2
+ 2KOH
H Н
Ацетальдегід Оцтова кислота
O O
CH3-CH2-C-CH3 + CF3-C ------- CH3-CH2-C + CF3COOH
O-OH O-CH3
O
Бутанон Трифторперокси- Метилпропінонат Трифтор-
оцтова кислота (естер) оцтова кислота
Якісні реакції на альдегідну оксогрупу базуються саме на відновлювальній здатності альдегідів. Кетони в такі реакції не вступають. Існує декілька відомих якісних реакцій, в яких застосовуються різні якісні реагенти:
Реактив Толенса – оксид срібла у вигляді аміачного комплексу дає яскраву реакцію “срібного дзеркала”:
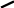 O
t0
O
O
t0
O
R -C
+ 2[Ag(NH3)2]OH
--------
R-C + 2Ag
+ 4NH3
+ H2O
-C
+ 2[Ag(NH3)2]OH
--------
R-C + 2Ag
+ 4NH3
+ H2O
H OH
Альдегід Реактив Толенса Кислота
Реактив Толенса не є специфічним реагентом лише на альдегіди, він окиснює сполуки і деяких інших класів – багатоатомні феноли, амінофеноли, ароматичні аміни, гідроксикетони, вуглеводи з альдегідними оксогрупами.
Реактив Фелінга, або фелінгова рфдина – комплекс гідроксида міді (ІІ) із змішаною калієво-натрієвою сіллю (тартаратом) натрія, калія або сегнетовою сіллю.
COOK KOOC
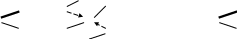 H
H
O CH-O O-CH O
R-C + 2 Cu + 2H2O ------ R-C + Cu2O +
H CH-O O-CH OH
H
