
- •Занятие №6 иммунодефицитные состояния Основные учебные вопросы:
- •1. Иммунодефицитные состояния (идс), определение понятия, принципы классификации.
- •2. Молекулярно-генетические дефекты идс. Клинические «маски» иммунодефицитных болезней.
- •6. Первичная недостаточность фагоцитов. Причины, механизмы развития, основные проявления.
- •Физиология и патология фагоцитоза
- •7. Наследственно обусловленные дефекты системы комплемента. Этиология, патогенез, основные проявления.
- •9. Ятрогенные иммунодефицитные состояния.
- •Осложнения после прививок — разновидность ятрогенной патологии
- •10. Принципы диагностики и иммунотерапии идс.
10. Принципы диагностики и иммунотерапии идс.
Различные компоненты иммунной системы могут принимать неодинаковое участие в элиминации микробов из макроорганизма. Поэтому по характеру инфекционного процесса можно также предварительно судить о том, какой компонент иммунитета работает недостаточно. Так, при развитии в течение первых дней жизни ребенка гнойно-воспалительных процессов кожи и слизистых оболочек, вызываемых пиогенными кокками, есть повод думать о наличии врожденных дефектов фагоцитарной системы. Для них также характерно очень медленное заживление пупочной раны и отпадение пупочного канатика. Инфекционные процессы, связанные с дефектом антителообразования, развиваются, как правило, во втором полугодии жизни ребенка после исчезновения из кровяного русла материнских иммуноглобулинов. Чаще всего эти инфекции вызываются инкапсулированными пиогенными микроорганизмами (стрептококками, пневмококками, Haemophiluls influlenzae и др.), поражающими верхние и нижние отделы респираторного тракта. Упорные нейссериальные инфекции часто ассоциируются с врожденными дефектами в компонентах комплемента С5-С9. Частые инфекционные процессы, вызываемые вирусами и другими внутриклеточными возбудителями, дают основание предполагать наличие дефекта в Т-системе иммунитета. Об этом также может свидетельствовать кожно-слизистый кандидоз. Триада — хронические пневмонии, длительная, трудно поддающаяся лечению диарея и кандидоз — всегда служит основанием для предположения о наличии врожденных дефектов Т-лимфоцитов. Для комбинированных дефектов Т- и В-систем иммунитета характерно необычайно тяжелое течение инфекционных процессов, которые развиваются в первый месяц жизни ребенка. Без соответствующего лечения ребенок погибает, как правило, в течение первого года жизни.
Лабораторно-иммунологическое обследование проводится с целью идентификации конкретного нарушения иммунной системы и подтверждения клинического диагноза. Первичная диагностика может осуществляться с помощью панели скрининговых лабораторных тестов.
Применение панели скрининговых лабораторных тестов возможно практически в любой областной или городской больнице, где имеется клинико-диагностическая лаборатория. Однако углубленный анализ можно провести лишь в специализированном лечебно-профилактическом учреждении, имеющем современную лабораторию клинической иммунологии.
В настоящее время идентифицировано более 70 врожденных дефектов иммунной системы, и, вероятно, их число по мере совершенствования методов молекулярной иммунодиагностики будет расти. ПИД — это относительно редкие заболевания: их частота составляет в среднем 1/25000-1/100000. Исключением является селективный IgA-дефицит, встречающийся с частотой 1/500-1/700. Изучение ПИД представляет большой интерес для теоретической и прикладной иммунологии. Анализ молекулярно-генетических механизмов, лежащих в основе этих дефектов, дает возможность выявлять принципиально новые механизмы функционирования иммунной системы и, следовательно, разрабатывать новые подходы к иммунодиагностике и иммунотерапии заболеваний, связанных с нарушениями иммунной системы.
Диагностика иммунодефицитных болезней
Широко распространены бактериологическая, иммунологическая (антитела, антигены) и генная диагностика инфекций. Однако состояние СИ при этом не тестируется. Для выявления ИД используются методы оценки иммунного статуса:
I этап. Клинико-лабораторное обследование. Предварительный диагноз иммунопатологии.
II этап. Оценка иммунодефицитного статуса – 1-й уровень:
– определение процента и абсолютного количества Т-лимфоцитов методами с мАТ к CD3, CD4, CD8, CD25
– определение В-лимфоцитов (CD19, CD22, CD72 или Ig+B);
– определение Ig G, М, А, Е в крови и sIgA в слюне;
– фагоцитоз, НСТ-тест нейтрофилов крови;
– определение циркулирующих иммунных комплексов (ЦИК);
– антитела против распространенных бактерий и вирусов;
– определение гемолитической активности комплемента (С50) и/или его компонентов;
– внутрикожные пробы с распространенными антигенами бактерий и грибов (туберкулин, стрептокиназа и др.).
III этап (по показаниям):
– определение ферментов, отсутствующих при первичных ИД (аденозиндезаминазы, пуриннуклеозидфосфорилазы, альфафетопротеин при атаксии; гранул лейкоцитов при гранулематозной болезни);
– оценка интерферонового статуса: концентрация интерферонов в крови; уровень интерферона-альфа и гамма в культуре лимфоцитов крови после стимуляции;
– HLA-типирование;
– выявление цитокинов, в крови методом ИФА и в клетках СИ (системы иммунитета) – методами проточной цитометрии;
– определение общей гамма-цепи рецепторов цитокинов при тяжелом комбинированном иммунодефиците (ТКИД) методом проточной цитометрии.
Принципы лечения иммунодефицитных болезней
Лечение первичных тяжелых ИД и синдромов после уточнения диагноза должно проводиться в специализированных центрах. В России предложены стандарты их лечения с учетом механизмов развития.
Необходимо соблюдать общие принципы лечения ИДБ и обосновывать адекватную терапию.
Терапия больных с иммунодефицитными болезнями включает :
1) устранение симптомов клинических синдромов, в том числе инфекционных;
2) коррекцию самого иммунодефицита;
3) профилактику рецидивов и осложнений иммунодефицита.
Каждое из этих направлений требует своих методов и подходов. Поэтому схемы лечения ИДБ – это комплекс медикаментозных и немедикаментозных мероприятий.
Терапия инфекционных осложнений. Так как ИДБ (иммунодефицитные болезни) проявляются инфекционными осложнениями, противомикробная терапия занимает ключевое место в их лечении. Выбор препаратов зависит от вида микрофлоры и особенностей ИД. Часто бывает необходима комплексная терапия из-за наличия ассоциаций микроорганизмов.
Антибактериальная терапия по существу является иммуностимулирующей. Бактерии, которые разрушаются антибиотиками, выделяют большое количество липополисахаридов (ЛПС) клеточной стенки, которые являются мощными стимуляторами клеток СИ (*СИ- система иммунитета) (макрофагов, нейтрофилов, Тх), активируя в первую очередь макрофаги, выделяющие цитокины (ИЛ-1, ФНОальфа и др.), что при нормальном ответе сопровождается лихорадкой. Так как антибактериальная терапия в большинстве случаев является эмпирической, то часто разрушаются аутологичные бактерии, «невиновные» в патологическом процессе, в первую очередь – кишечная палочка. Однако если был относительный иммунодефицит, то нормально реагирующая СИ активируется ЛПС и больной быстро выздоравливает. При наличии абсолютного ИД этого не поисходит, несмотря на интенсивную антибактериальную терапию наблюдаются обострения, затяжные и хронические процессы. Необходима иная иммунокоррекция.
Следовательно, антимикробные средства не только уменьшают дозу инфектов (*Инфицирующая доза — минимальное количество жизнеспособных возбудителей, необходимых для развития инфекционной болезни), но и, разрушая их, создают «аутовакцины», стимулирующие СИ. Особенно эффективны препараты, которые не только не угнетают, но и параллельно стимулируют развитие иммунитета, хотя большинство антибиотиков угнетают те или иные звенья иммунитета.
Противовирусные препараты, препятствующие репликации вирусов, освобождают их нуклеиновые кислоты для индукции интерферонов, а капсидные белки – для активации антителогенеза. При наличии вирусной инфекции рекомендуются антивирусные препараты в комбинации с интерферонами или интерфероногенами, а также Т-миметики. Это не исключает применения стимуляторов синтеза антител, особенно при чувствительных к ним инфекциях.
Реконструктивная иммунотерапия. Для восстановления СИ у больных с генетическими дефектами необходимы трансплантация жизнеспособных стволовых клеток СИ донора или генная терапия. Материалом для трансплантации могут служить полипотентные гемопоэтические стволовые клетки крови, костного мозга или эмбриональной печени, фетальный тимус или культивируемый тимический эпителий.
Генная терапия осуществляется путем переноса нормального гена с помощью вектора в клетки больного.
Применение иммуномодуляторов при первичных иммунодефицитах. При большинстве среднетяжелых и тяжелых первичных ИД иммуномодуляторы не эффективны и необходима пересадка костного мозга или заместительная терапия иммуноглобулинами. Однако в некоторых случаях они могут быть полезны как средства, усиливающие компенсаторные возможности СИ.
При первичной общей вариабельной иммунной недостаточности (ОВИН) с преимущественным нарушением гуморального звена иммунитета в комплексе лечения был испытан полиоксидоний. На этом фоне удалось уменьшить антибактериальную терапию, получить более длительную ремиссию. Отмечено увеличение количества лейкоцитов, лимфоцитов, фагоцитоза.
Особенности лечения вторичных иммунодефицитных болезней (ВИБ). Лечение ИДБ зависит от клинических и патогенетических особенностей и включает: 1) устранение причин, их вызвавших; 2) антибактериальную терапию (по показаниям); 3) иммунокорригирующую терапию; 4) традиционные методы терапии клинических синдромов.
Ориентирами лечения может служить следующий протокол :
I. Этап иммунокорригирующей терапии (острый период):
1. Вирусиндуцированные Т-клеточные ИД:
- Противовирусные препараты (ацикловир);
- Интерфероны (альфа, гамма, лейкинферон);
- ?Т-миметики (тактивин, тималин и др.);
- ?Т-цитокины (ИЛ-2-ронколейкин и др.).
1. В-клеточные, ассоциированные с бактериальными инфекциями ИД:
- ?Антибактериальные (противогрибковые) препараты;
- ?Иммуноглобулины (антитела) при тяжелом течении внутривенно;
- ?В-миметики (миелопид и др.);
- ?Иммунокорректоры широкого спектра, комплекс цитокинов.
2. Фагоцитарные:
- ?Антибактериальные (противогрибковые препараты);
- ?Иммуностимуляторы широкого спектра, цитокины;
- ?Интерфероны;
- ?Витамины (С и др.), микроэлементы.
II. Этап противорецидивной иммунореабилитации (при ремиссии):
1. Адаптогены (женьшень, элеутерококк и др.).
2. Иммуностимуляторы растительного происхождения (иммунофан и др.).
3. Санаторно-курортное лечение.
4. Физиотерапия (КВЧ, ультразвук и др.).
5. Иммуностимулирующие вакцины широкого спектра (ликопид, рибомунил, стафилококковый анатоксин и др.).
Вид иммунокоррекции (общая и местная) и ее конкретный метод (физический, химический, биологический) определяются природой дефицита и его принадлежностью к тому или другому варианту нарушения ИС, а в целом – диагнозом ВИБ (рис. 3).
Наиболее эффективно лечение начальных форм иммунодефицитов, для чего необходима ранняя диагностика нарушений в СИ.
Антибактериальная терапия необходима при наличии явных очагов инфекции. Причем в ряде случаев предпочтительно местное лечение (тонзиллогенной и других инфекций). Средства пассивной или заместительной терапии – иммуноглобулины используют по показаниям. При затихании острых явлений и в период ремиссии при отсутствии гнойных очагов применяют неспецифическую активную и пассивную иммунотерапию. Среди средств иммуномодулирующей терапии показаны препараты из органов иммунитета (тактивин, тималин, миелопид и др.). Широко применяются иммуномодуляторы, в том числе физические факторы. Последние полезны при затяжных и хронических процессах. Они стимулируют СИ, в том числе факторы местного иммунитета и предпочтительны при наличии лекарственной аллергии.
Для активной неспецифической и полуспецифической терапии используют условно-патогенные микроорганизмы в виде гетеровакцин, состоящих из микробов, колонизирующих дыхательные пути (препараты типа рибомунила), или назначают иммуностимуляторы (ликопид, полиоксидоний). Выбор средств определяется вариантом иммунодефицита, нарушением его определенных звеньев.
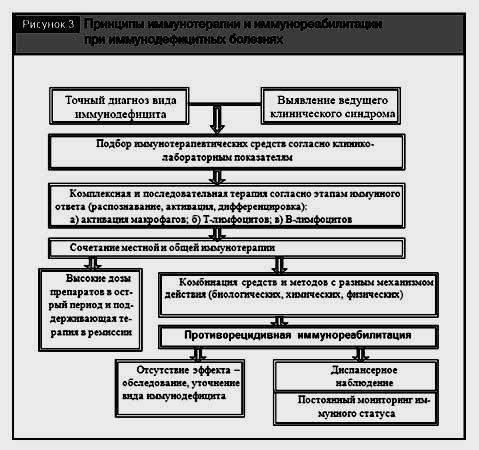
Сочетание местной и общей иммунокорригирующей терапии позволяет достичь наибольшего клинического эффекта. Комбинированная иммунокоррекция может включать совокупность 3–4 средств и способов различного воздействия, преимущественно влияющих на разные звенья иммунитета.
Важным этапом в лечении больных является противорецидивная иммуно-профилактика, проводимая в период ремиссии. Она включает весь арсенал иммунотерапевтических средств и, по существу, представляет собой иммунореабилитацию.
Применение «мягких» иммуностимуляторов в случаях достаточно сохраненной реактивности СИ предупреждает рецидивы заболевания, т.е. обеспечивает иммунореабилитацию. С этой целью в период ремиссии назначают перорально адаптогены, иммуностимуляторы растительного происхождения (эхинацея, женьшень и др.), а также витамины и микроэлементы. Используют курсы физиоиммунотерапии (КВЧ, магнитотерапию и др.).
Главной стратегией борьбы с инфекциями как следствием иммунодефицитов в 21-м веке должно быть иммунопрофилактическое повышение популяционной и индивидуальной неспецифической и специфической резистентности – иммунитета у людей.
У больного с подозрением на ПИД (первичного иммунодефицита) изучение иммунного статуса при иммунодефицитах должно включать изучение количества и функциональной активности основных компонентов иммунной системы, играющих главную роль в противоинфекционной защите организма. К ним относятся фагоцитарная система, система комплемента, Т- и В-системы иммунитета. Методы, применяемые для оценки функционирования этих систем, условно разделены Петровым Р. В. с соавт. (1984) на тесты 1-го и 2-го уровней.
К тестам 1-го уровня для оценки фагоцитоза относится определение:
абсолютного числа нейтрофилов и моноцитов;
интенсивности поглощения микробов нейтрофилами и моноцитами;
способности фагоцитов убивать микробы.
К тестам 2-го уровня (дополнительным) оценки фагоцитоза можно отнести определение:
интенсивности хемотаксиса фагоцитов;
экспрессии молекул адгезии (CD11a, CD11b, CD11c, CD18) на поверхностной мембране нейтрофилов.
К тестам 1-го уровня оценки B-системы иммунитета можно отнести определение:
иммуноглобулинов G, A, M в сыворотке крови;
иммуноглобулина E в сыворотке крови;
определение процента и абсолютного количества B-лимфоцитов (CD19, СD20) в периферической крови.
Определение уровня иммуноглобулинов — это по-прежнему важный и надежный метод оценки B-системы иммунитета. Его можно считать главным методом диагностики всех форм иммунодефицитов, связанных с биосинтезом антител.
К тестам 2-го уровня оценки В-системы иммунитета можно отнести определение:
субклассов иммуноглобулинов, особенно IgG;
секреторного IgA;
соотношения каппа- и лямбда-цепей;
специфических антител к белковым и полисахаридным антигенам;
способности лимфоцитов давать пролиферативный ответ на B-(стафилококк, липополисахарид энтеробактерий) и T-B-(митоген лаконоса) митогены.
К тестам 1-го уровня оценки T-системы иммунитета можно отнести определение:
общего числа лимфоцитов;
процента и абсолютного числа зрелых T-лимфоцитов (CD3) и двух основных их субпопуляций: хелперов/индукторов (CD4) и киллеров/супрессоров (CD8);
пролиферативного ответа на основные T-митогены: фитогемагглютинин и конканавалин A.
К тестам 2-го уровня для оценки T-системы иммунитета мы относим определение:
продукции цитокинов (интерлейкина-2, (ИЛ-2), ИЛ-4, ИЛ-5, ИЛ-6, гамма-интерферона, фактора некроза опухоли (ФНО) и др.);
активационных молекул на поверхностной мембране T-лимфоцитов (CD25, HLA-DR);
молекул адгезии (CD11a, CD18);
пролиферативного ответа на специфические антигены, чаще всего на дифтерийный и столбнячный анатоксины;
аллергической реакции с помощью кожных тестов с рядом микробных антигенов.
К скрининговым лабораторным тестам относится определение:
Абсолютного количества лейкоцитов, нейтрофилов, лимфоцитов и тромбоцитов
Сывороточных иммуноглобулинов IgG, IgA, IgM
Гемолитической активности комплемента CH50
Гиперчувствительности замедленного типа (кожные тесты)
С помощью скрининг-тестов можно выявить следующие виды ПИД:
Х-сцепленную агаммаглобулинемию
Общую вариабельную иммунологическую недостаточность (ОВИН)
Гипер-IgM-синдром
Селективный дефицит IgA
Тяжелый комбинированный иммунодефицит
Синдром Вискотта-Олдрича
Дефициты в системе комплемента
Иммунотерапия. Применение иммуномодуляторов при иммунодефицитах
Лечение ПИД. Иммуномодулирующая терапия является неэффективной или малоэффективной при ПИД. Основные методы их лечения — это антимикробная и заместительная терапия. За рубежом применяется реконструктивная терапия, заключающаяся в пересадке больным детям костного мозга. Также интенсивно разрабатываются методы генной терапии.
Лечение ВИД. Применение иммуномодуляторов более оправданно и целесообразно при ВИД. Назначение последних должно всегда проводиться на основании клинического и иммунологического обследования. В зависимости от результатов этого обследования можно выделить две группы людей:
имеющих клинические признаки нарушения иммунитета в сочетании с выявленными с помощью иммунологических методов конкретными изменениями его параметров;
имеющих только клинические признаки нарушения иммунитета без изменения параметров иммунитета.
Главным критерием при назначении иммуномодуляторов является клиническая картина. Иммуномодуляторы можно (или целесообразно) использовать в комплексной терапии больных как первой, так и второй групп.
Громадная клиническая практика показывает, что оба вида активации иммунитета могут с успехом применяться в комплексном лечении больных с ВИД. Особенно наглядным примером является применение иммуномодуляторов для лечения хирургических инфекций, которые могут служить типичным примером индуцированной формы ВИД. Практически все препараты, оказывающие влияние на иммунитет и разрешенные к медицинскому применению (левамизол, продигиозан, пирогенал, нуклеинат натрия, диуцифон, тактивин, тимоген и др.), были использованы для лечения этих инфекций, и все они в целом показали неплохие клинические результаты. В настоящее время врач-иммунолог имеет большой выбор иммуномодуляторов для лечения ВИД, и только после применения в клинической практике в конечном итоге будут отобраны наиболее эффективные препараты, которые, как аспирин, сердечные гликозиды, антибиотики и др., надолго войдут в арсенал врача-иммунолога. Как правило, при хронических инфекционно-воспалительных процессах в стадии обострения врач назначает антибиотики. Мы считаем, что в этих случаях является целесообразным также одновременное назначение иммуномодуляторов. При одновременном применении антибиотика и иммуномодуляторов достигается больший терапевтический эффект, чем при их раздельном введении. Антибиотик убивает или подавляет функциональную активность возбудителя; иммуномодулятор прямо (полиоксидоний, ликопид, миелопид) или опосредованно (тактивин, имунофан и др.) повышает функциональную активность фагоцитов, усиливая их бактерицидный эффект. По возбудителю заболевания наносится двойной удар, за счет чего и достигается большая эффективность комплексного лечения.
Подводя итог вышесказанному, мы считаем, что использование иммуномодуляторов в комплексе с другими лекарственными средствами поможет врачам-иммунологам более эффективно лечить больных с признаками ВИД.
*****************
