
14
.docxВариант 14
Задача 1.1(6) Биомасса продуцентов в экологической системе составляет А т. Определите возможную биомассу консументов порядков, указанных в вашем варианте.
|
Вариант |
Биомасса продуцентов, А, т |
Порядок консументов |
|
6 |
2500 |
2 |
Решение. Используем правило «10 % Линдемана»: с одного трофического уровня экологической пирамиды на другой, более высокий ее уровень, переходит в среднем около 10 % энергии (биомассы), поступившей на предыдущий уровень.
Биомасса продуцентов I трофического уровня равна 2500 т.
Тогда биомасса консументов 1 порядка, занимающих II трофический уровень, составит: 0,1 × 2500 т = 250 т;
Биомасса консументов 2 порядка, занимающих III трофический уровень, составит: 0,1 × 250 т = 25 т.
Ответ: Возможная масса консументов 2 порядка 25 т.
Задача 1.2(13) Популяция включает в себя М=100 особей. Ежегодно человеком изымается Х=65 особей. В результате размножения популяция увеличивается на Y= 27 % в год. Определите какое количество животных будет содержать популяция через Z=3 лет, если не принимать во внимание другие причины уменьшения численности.
Решение.
Для
вычисления численности популяции через
Z
лет (обозначим ее МZ)
используем формулу: МZ
= М (1 +
 – Z∙Х.
– Z∙Х.
МZ = 100 (1+ 27/100)3 – 3*65 = 9,8 ≈9 особей будет содержать популяция через 3года.
Ответ: 9 особей.
Задача 1.5(1) Для каких экосистем лимитирующим фактором является свет?
Ответ. Свет определяет существование автотрофных организмов (синтез хлорофилла), составляющих важнейший уровень в трофических цепях. Этот фактор является для растений источником энергии фотохимических реакций и как регулятор развития. Его избыток, также как и недостаток, может быть причиной серьезных нарушений развития. Поэтому свет является лимитирующим фактором.
Задача 2.1(10) Определите общую жесткость (Ж) воды по массе содержащихся в воде солей.
|
Вариант |
Объем воды, л |
Ca(HCO3)2, мг |
Mg(HCO3)2, мг |
CaCl2, мг |
MgCl2, мг |
|
10 |
0,55 |
17,1 |
2,0 |
12,1 |
10,0 |
Решение. Выразим жесткость воды (ммоль/л) через массу двухзарядных катионов металлов Ca2+, Mg2+ и соответствующих им солей, содержащихся в 1 л воды:
Ж =

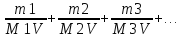
где m1, m2, m3 – массы двухзарядных катионов металлов (или соответствующих им солей) в воде, мг; М1, М2, М3 – молярные массы эквивалентов катионов металлов (или соответствующих им солей); V – объем воды, л.
Определяем молярные
массы эквивалентов солей, обусловливающих
жесткость воды: Ca(HCO3)2
:
 = 81,05 мг/моль;
= 81,05 мг/моль;
Mg(HCO3)2:
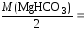
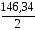 = 73,17 мг/моль;
= 73,17 мг/моль;
CaCl2:
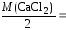
 = 55,49 мг/моль;
= 55,49 мг/моль;
MgCl2:
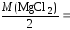
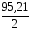 = 47,60 мг/моль.
= 47,60 мг/моль.
Общая жесткость данного образца воды равна сумме временной и постоянной жесткости и обусловливается содержанием в ней солей, придающих ей жесткость; она равна
Жобщ. = [17.1/81.05*0.55]+[2.0/73.17*0.55]+[12.1/55.49*0.55]+[10/47.60*0.55]=1.211
Один градус жесткости соответствует 0,357 ммоль катионов двухзарядных металлов. Общая жесткость образца воды в градусах жесткости равна(1,211/0,357)=3,395 о. Вода данного образца считается мягкой.
Задача 2.2(5) Определите временную и постоянную жесткость по известково-содовому методу.
|
Вариант |
Объем воды, л |
m(Ca(OH)2), г |
m(Na2CO3), г |
|
5 |
40 |
7,5 |
4,6 |
Решение. Добавлением в воду гашеной извести (Ca(OH)2) можно удалить временную жесткость, а введением соды (Na2CO3) устранить постоянную жесткость. Данные процессы идут по следующим реакциям:
Me(HCO3)2 + Ca(OH)2 = MeCO3 + CaCO3 + 2H2O;
Me(NO3)2 + Nа2CO3 = MeCO3 + 2NaNO3,
где Me2+: Ca2+, Mg2+.
Временную жесткость воды Жвр. измеряют количеством гидроксида кальция, участвующего в реакции, а постоянную жесткость Жпост. – количеством карбоната натрия.
Жвр.
=
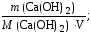 Жпост.
=
Жпост.
=

M(Ca(OH)2) = M/2 = 74,09/2 = 37,04 моль/л;
M(Na2CO3) = M/2 = 106,00/2 = 53,0моль/л;
Жвр = 7500/(37,04×40) = 5 ммоль/л;
Жпост.= 4600/(53×40) = 2,17 ммоль/л;
Жобщ.= Жвр+ Жпост = 5 + 2,17 = 7,17 ммоль/л (вода средней жесткости).
Ответ. Временная жесткость равна 5 ммоль/л, постоянная жесткость равна 2,17 ммоль/л.
Задача 2.3(3) Для умягчения Х л воды потребовалось Y г Na2CO3. Чему равна постоянная жесткость воды?
|
Вариант |
Х л воды |
Y г Na2CO3 |
|
3 |
100 |
14,5 |
Решение. Постоянную жесткость Жпост. – количеством карбоната натрия.
Жпост.
=
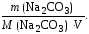 ; M(Na2CO3)
= M/2
= 106,00/2 = 53,0 моль/л;
; M(Na2CO3)
= M/2
= 106,00/2 = 53,0 моль/л;
Жпост. = 14500/(53*100) = 2,73 ммоль/л < 4 ммоль/л. Значит, вода мягкая.
Задача 3.1(1). Определите вид сточной воды (кислая или щелочная), если концентрация ионов ОН равна (моль/л).
|
Вариант |
[ОН], моль/л |
|
1 |
410-3 |
Решение.
Известно, что ионное произведение воды
равно: [H+]∙[OH ]
= 10-14.
]
= 10-14.
Отсюда [H+] = 10-14/(410-3) = 25*10-13 моль/л.
Определяем рН сточной воды: рН = –lg[H+] = –lg 25*10-13 = 11,6
Сточная вода щелочная, так как рН >9.
Задача 3.2(1). Определите соответствие санитарно-токсикологическим нормам воды в водоеме, если в водоем вместимостью 120 м3 с дождевыми водами объемом 1,5 м3 занесен 2 кг удобрения сульфат аммония ((NH4)2SО4), используемого на полях.
Решение.1. Запишем уравнение диссоциации аммиачной селитры в воде
(NH4)2SO4
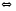 2NH
2NH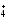 + SO4-2.
+ SO4-2.
Следовательно,
оценить соответствие водоема
санитарно-токсикологическим нормам
можно по концентрации двух ионов: NH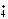 и SO4-2.
и SO4-2.
2. Определяем массу
иона NH ,
попавшего в водоем:
,
попавшего в водоем:
m
(NH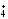 )
=
)
=

Молярная масса
(NH4)2SО4
равна 132 г/моль; молярная масса иона NH равна 18 г/моль.
равна 18 г/моль.
m
(NH )
= (2000 г * 18 г/моль ) / 132 г/моль = 272,75 г = 272750
мг.
)
= (2000 г * 18 г/моль ) / 132 г/моль = 272,75 г = 272750
мг.
3. Определяем массу иона SO4-2, попавшего в водоем:
m
(SO4-2)
=
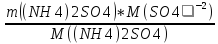
Молярная масса иона SO4-2 равна 132 г/моль.
m (SO4-2) = (2000 г * 132 г/моль ) / 80 г/моль = 3300 г = 3300000 мг.
4. Рассчитаем объем воды в водоеме:
V = Vводоема + Vдожд. воды = 120 м3 + 1,5 м3 = 121.5 м3 = 121500 л.
5. Определяем
концентрацию ионов NH в мг/л:
в мг/л:
В 121500 л содержится
27275 мг ионов NH
В 1 л –« – Х – « – – « –
Х = 27275 /121500 = 2,25 мг/л;
6. Определяем концентрацию ионов SO4-2 в мг/л:
В 121500 л содержится 3300000 мг ионов SO4-2
В 1 л –« – Х – « – – « –
Х = 3300000/121500 = 27,16 мг/л.
7. Вода в водоеме соответствует санитарно-токсикологическим нормам в случае выполнения условия:
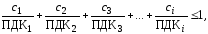
Определяем
соответствие воды санитарно-токсикологическим
нормам по ионам NH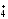 и SO4-2
:
и SO4-2
:
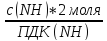 +
+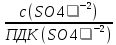 =
(2,25*2/0,39) + (27,16/100)=11,8
=
(2,25*2/0,39) + (27,16/100)=11,8
Таким образом, по
ионам NH и SO4-2
вода не соответствует санитарно-токсикологическим
нормам.
и SO4-2
вода не соответствует санитарно-токсикологическим
нормам.
Задача 3.4(10) При электролизе сточной воды объемом 1,5 м3 выделился Hg+ массой 600 г. Определите количество электричества, необходимое для электролиза сточной воды. Выход по току 84 %.
Решение.
По закону Фарадея масса выделившегося на катоде вещества пропорциональна количеству электричества, прошедшего через раствор (расплав).
m = k∙Q,
где k – электрохимический эквивалент вещества, г/А∙ч; Q – количество электричества, прошедшего через раствор (расплав).
k = АMe/nF,
где АМе – атомная масса металла, г/моль; n – число электронов, от-данных металлом на катоде; F – число Фарадея, F = 96500 Кл/моль.
Q = I ∙ τ ∙ η,
где I – сила тока, А; τ – время, с; η – выход по току, %.
Определяем количество электричества, прошедшего через раствор:
Формула : Q=(m*n*F)/(AMe* η)=(600*1*96500)/(200,6*0,84)= 168,504 Кл.
Задача 4.1(13) В состав природных геохимических соединений входят различные минералы. Рассчитайте процентное содержание (массовую долю ω, %) элементов, входящих в состав Гадолинита [Be2Y2FeII(SiO4)2O2].
Решение.1. Определяем молярную массу минерала.
М [Be2Y2FeII(SiO4)2O2] =9*2+89*2+56+2*(28+4*16)+2*16= 468 г.
2. Рассчитываем процентное содержание каждого элемента, входящего в состав минерала (массовую долю ω, %) принимая молярную массу гадолинита за100 %.
468 г минерала составляют 100 %
9 г Be –«– –«– –«– Х
ω (Be), % = Х = (2*9*100)/468 = 4 %.
Аналогично рассчитывается процентное содержание каждого элемента.
ω (Y), % = (89*2*100)/468 = 38 %.
ω (Fе), % = (1*56*100)/468= 11,9 %.
ω (Si), % = (2*28*100)/468 = 11,9 %.
ω (O), % = (10*16*100)/468 = 34,2 %
Ответ: % содержание элементов (массовая доля) в каините составляет: Ве – 4%;
О –34,2%; Y – 38%; Fe – 11.9%, Si-11,9%.
Задача 4.2(3) Для повышения плодородия почвы на площади 8 га требуется внесение удобрения – Сульфат аммония (NH4)2SO4. Рассчитайте массу элемента N, полученного почвой при норме внесения данного удобрения 0,025 кг/м2 .
Решение. 1. Рассчитаем массу Сульфата аммония, вносимого на 8 га.
0,025 кг/м2×8 га = 0,025кг/м2×8×104 м2 = 2000 кг.
2. Определим соотношение молярных масс:
М(N) = 14 г/моль; М((NH4)2SO4) = 132 г/моль;
М(N)/ М((NH4)2SO4)=14*2/132=0,2
3. Масса магния, вносимого на площади 10 га при указанной норме сульфата магния, составит: m (N) = 2000кг × 0,2= 400 кг.
Задача 4.3(10) Используя данные табл., определите, какое из приведенных веществ, входящих в состав твердых отходов, является наиболее вредным, за счет какого элемента. Приведите класс опасности и ПДК этого вещества. Опишите воздействие его на человека.
|
Вариант |
Вещество |
||
|
10 |
KF |
NaNO3 |
CdSO4 |
Решение. По степени воздействия на организм человека вещества I класса опасности являются чрезвычайно опасными, II класса – высоко опасными, III класса – умеренно опасными, IV класса – малоопасными. Пользуясь данными табл. П.1 приводим класс опасности и ПДК указанных веществ в виде таблицы
|
№ |
Формула вещества |
Класс опасности |
ПДК, мг/м3 |
|
1 |
CdSO4 |
I |
0,01 |
|
2 |
KF |
II |
0,2 |
|
3 |
NaNO3 |
III |
5 |
Из анализа приведенных данных наиболее вредным веществом следует считать сульфат кадмия. Вредность CdSO4 обусловлена токсичным действием при вдыхании или контакте с кожей, появляется затруднение дыхания, кашель, нередко — ларингит, трахеит, бронхит и т. д. Данный элемент, отнесен к I группе опасности. Выбор наиболее вредного из трех рассматриваемых веществ подтверждается значениями ПДК. Так, наименьшее значение данного параметра установлено для NaNO3. По степени воздействия на организм CdSO4 является чрезвычайно опасным, KF - высокоопасным, NaNO3– умеренно опасным веществом.
Задача 4.4(11) Опишите механизм метода седиментации в присутствии коагулянтов и принципиальную схему аппарата, применяемого для отделения твердой фазы.
Ответ. Промышленными исследованиями установлен высокий эффект очистки вод применением метода седиментации в присутствии коагулянтов.
Седиментация – процесс, посредством которого взвешенные вещества отделяются от воды под действием гравитации и осаждаются на дно контейнера или резервуара.

1-песколовка; 2-реагентное хозяйство; 3-вихревой смеситель; 4-тстойник;
5-коалесцирующий фильтр; 6-фильтр; 7-нефтесборное устройство;
8-сорбционный фильтр; 9-реагентное хозяйство; 10-резервуар чистой воды;
11-насосная станция; 12-гидрофобный фильтр; 13-накопитель нефти;
14-отстойник промывной воды; 15 - иловая площадка.
Принцип работы установки (рисунок) заключается в следующем. Пластовая вода подается в тангенциальную песколовку 1 для извлечения крупных взвешенных веществ. Далее в воду дозируют коагулянт (флокулянт) с помощью реагентного хозяйства 2, реагент перемешивают с водой в вихревом смесителе 3, смесь подают в отстойник с тонкослойными блоками 4. В отстойной части от воды отделяются взвешенные вещества, удаляемые из приямков, и нефтепродукты, удаляемые с помощью пеносборного устройства 7. Предварительно очищенная вода проходит сквозь коалесцирующую загрузку 5, при этом происходит укрупнение капель нефти и их всплытие на поверхность воды. Доочистка происходит в фильтрующем блоке 6, выполненном из природных материалов с гидрофобными свойствами. После дозирования бактерицидного реагента с помощью реагентного хозяйства 10 вода накапливается в резервуаре чистой воды 11 и подается насосной станцией 15 в оборотную систему промпредприятия.
Задача 5.1(24) При абсорбции Cl2 жидкостью поглотилось 1,1 кг его. Сколько л Ca(OH)2 израсходовано, если концентрация жидкости 10 % (масс.), а плотность ρ=1,12 г/мл? Напишите уравнение реакции.
Решение. Записываем уравнение реакции:
Cl2 + 6(Ca(OH)2) = 5CaCl2 + Ca(ClO3)2 + 6H2O
По уравнению реакции 1 моль Cl2 реагирует с 6 молями Ca(OH)2. Рассчитываем молярные массы участников реакции:
М(Cl2) = 35,5*2= 71 г/моль; М(Ca(OH)2) = 40+2*(16+1) = 74 г/моль.
1,1 кг Cl2 составляет: (1,1*1000)/71= 15,5 моль Cl2.
Значит, количество необходимого Ca(OH)2 составляет 15,5*6=93 моль, т. е. 74*93= 6882 г. Рассчитываем массу Ca(OH)2:
в 100 г раствора содержится 10 г Ca(OH)2
в Х -«- -«- -«- -«- 6882 г
Х = 68820 г.
Рассчитываем объем израсходованного Ca(OH)2: V =68820/1,12=61446,4 мл
Задача 5.2(6) Какой объем промышленного газа, содержащего ω=10% загрязнителя СO нужно подвергнуть каталитической очистке, чтобы получить 4 м3СН4 продукта?
Решение. 1. Записываем уравнение реакции: СО + 3Н2 → СН4 + Н2О.
По уравнению реакции из 1 моля СO получается 1 моль СН4. Так как 1 моль любого газа при нормальных условиях занимает объем 22,4 л, то соотношение объемов газов в уравнении реакции равно соотношению числа их молей в реакции. Т. е. объем СO равен объему полученного СН4 V(СО) = 4 м3.
2. Находим, какой объем промышленного газа затрачен на получение 4 м3 СН4?
В 100 м3 содержится 10м3 СО
В Х -«- -«- -«- 4 м3 СО,
Х = 40 м3 (промышленного газа).
Задача 5.4(30) Вычислите объем кислорода (Х), который расходуется и объем «парникового» газа (углекислого) (Y), выделяющегося при полном сгорании фенилэтилена С14Н12 (ж) объемом 235г.
Решение. Составляем уравнение реакции полного сгорания фенилэтилена С14Н12. Расставляем коэффициенты. С14Н12 + 17О2 → 14СО2 + 6Н2О.
Из уравнения реакции следует, что при сгорании 1 моля фенилэтилена расходуется 17молей кислорода и выделяется 14 молей СО2. Молярная масса фенилэтилена М(С14Н12) = 180 г. Число молей фенилэтилена равняется (235 г/110 г) = 1,3 молей.
При нормальных условиях 1 л любого газа занимает объем 22,4 л (закон Авогадро).
Для полного сгорания 1 моля С14Н12 расходуется 17×22,4 л О2
Для -«- -«- -«- 1,3 молей -«- -«- -«- Х л О2
Х = 17×22,4 л×1,3 = 495 л О2;
При полном сгорании фенилэтилена выделяется:
14×22,4 л×1,3 = 407,68 л СО2.
Задача 6.1(10) Для схемы круговорота C дайте ответы на вопросы 4-6:
4. Объясните механизм физико-химических или биохимических превращений.
5. Антропогенный фактор.
6. Задачи перед человеком, связанные с рассматриваемым процессом.
ОТВЕТ.4. Миграция углекислого газа в биосфере Земли протекает двумя путями. Первый путь заключается в поглощении его в процессе фотосинтеза с образованием органических веществ и в последующем захоронении их в литосфере в виде торфа, угля, горных сланцев, рассеянной органики, осадочных горных пород. По второму пути миграция углерода осуществляется созданием карбонатной системы в различных водоемах, где CO2 переходит в H2CO3, HCO31-, CO32-. Затем с помощью растворенного в воде кальция (реже магния) происходит осаждение карбонатов CaCO3 биогенным и абиогенным путями. Возникают мощные толщи известняков. Наряду с этим большим круговоротом углерода существует еще ряд малых его круговоротов на поверхности суши и в океане.
В пределах суши, где имеется растительность, углекислый газ атмосферы поглощается в процессе фотосинтеза в дневное время. В ночное время часть его выделяется растениями во внешнюю среду. С гибелью растений и животных на поверхности происходит окисление органических веществ с образованием CO2. Особое место в современном круговороте веществ занимает массовое сжигание органических веществ и постепенное возрастание содержания углекислого газа в атмосфере, связанное с ростом промышленного производства и транспорта.
5. Под влиянием человеческой деятельности происходят большие изменения в распределении углерода в биосфере, естественная и антропогенная трансформация веществ, а также переход химических элементов с одних соединений к другому. Естественный биологический кругооборот веществ возбужденный человеком на площади, которая достигает почти половины всей поверхности суши: антропогенные пустыни, индустриальные и городские земли, сады, вторичные низкопродуктивные леса, изможденные пастбища и т. д. Изменению геологического кругооборота углерода оказывают содействие такие факторы:
1. Эрозия почвенного покрова и возрастания твердого стока в океан;
2. Перемещения огромных масс земной коры;
3. Добыча из недр немалых количеств руд, горючих и
других ископаемых;
4. Перераспределение соли в грунтах, грунтовых и речных водах под влиянием оросительного земледелия;
5. Применение минеральных удобрений и ядохимикатов;
6. Загрязнения среды сельскохозяйственными, промышленными и коммунальными отходами;
7. Попадания в естественную среду энергетических загрязнений.
6. Актуальной задачей становятся природоохранные мероприятия, которые человечество должно применять как можно чаще. Вся территория нашей планеты подвержена разным антропогенным влияниям. Серьезный характер приобрели следствия разрушения биоценозов и загрязнения среды. Вся биосфера находится под все более возрастающим давлением деятельности человека.
Задача 6.2(29) Рассчитайте долю испарения воды за счет культурной растительности в общем круговороте воды, дайте характеристику ее роли в этом процессе.
Ответ.
|
Наименование |
Количество |
|
Суммарное испарение с земной поверхности за счет процесса транспирации: - вся растительность, тыс. км3 - культурная растительность, тыс. км3 |
16 2,5 |
Объем воды в биосфере составляет 1386 млн.км3
Рассчитаем поступление и вывод воды из круговорота. В расчете потоков не учитываем переносы, стоки.
1. Поступление воды в круговорот:
- осадки над океанами 2920 мм/год;
- Транзит влаги через континенты 34500 км3/год;
- Количество переносимой с океанов на сушу влаги 106600 км3/год:
Всего: 141100 км3/год.
2.Вывод воды из круговорота:
- Суммарное испарение с земной поверхности 18,5 тыс. км3;
- Суммарное непродуктивное испарение с материков 55 тыс. км3;
- Суммарное водопотребление 2600 км3/год;
- Объем безвозвратного водопотребления населением 5 м3/год∙чел;
- Суммарный водозабор на промышленные нужды 510 км3/год;
- Суммарные затраты воды на орошение 1900 км3/год;
- Суммарные затраты воды на орошение 3560 км3/год;
Всего: 82075 км3 /год.
Поступление превышает вывод: 141100-82075=59025 км3/год.
Доля в общем превышении поступления:(2,5/59025)*100%=0,004%. Эти процессы занимают незначительную долю в общем превышении поступления воды в круговорот. Доля испарения воды за счет культурной растительности в общем поступлении в круговорот: (2,5/141100)*100% = 0,0017%.
Доля испарения воды за счет культурной растительности в выводе из круговорота: (2,5/82075)*100% = 0,003%.
Задача 7.1(21) Сколько нужно съесть халвы, чтобы компенсировать суточную потребность человека в кальцие?
Суточная потребность кальция–900 мг, в 100г продукта содержится 211 мг кальция.
Решение. Составляем и решаем пропорцию:
100 г халвы содержат 211 мг кальция
Х -«- -«- -«- 900 мг кальция
Х = (900*100)/211 = 426,5 г.
Ответ. Нужно съесть 426,5 г халвы.
Задача 7.2(8) Рассчитайте энергетическую ценность яиц.
|
Вариант |
Продукт питания |
Содержание пищевого вещества, % |
|||||
|
|
|
Белки |
Жиры |
Усвояе-мые углеводы |
Пищевые волокна |
Органи- ческие кислоты |
Вода |
|
8 |
Варенье клубничное |
0,4 |
- |
74,5 |
- |
1,2 |
23,9 |
Решение.
ЭЦ = Б×4,0 + Ж×9,0 + У×4,0 + ОК×3,0
1. Подставляем в формулу данные задачи.
ЭЦ = 0,4×4,0 + 0×9,0 +74,5×4,0 + 1,2*3,0= 303,2 ккал.
