
- •Ферменты. Строение, механизм действия, классификация.
- •3.1. Энергия активации. Катализаторы
- •3.1.1. Ферменты как биологические катализаторы
- •3.2. Отличие ферментов от неорганических катализаторов
- •3.3. Условия действия ферментов в клетке
- •3.4. Строение ферментов
- •3.5. Активный центр ферментов
- •3.5.1. Особенности функционирования активного центра
- •3.5.2. Особенности состава и структуры активного центра
- •3.6. Механизм действия ферментов
- •3.6.1. Ферменты понижают энергию активации химической реакции
- •1) Как и любые катализаторы, ферменты повышают скорость химической реакции за счёт снижения энергии активации реакции (энергетического барьера) реакции.
- •1. Первая стадия: образование фермент-субстратного комплекса, т. Е. Присоединение субстрата к макромолекуле фермента.
- •3.7. Внутриклеточное распределение ферментов
- •3.8. Классификация и номенклатура ферментов
- •2. Трансферазы - ферменты, ускоряющие реакции переноса органических радикалов или целых молекулярных остатков с одного соединения на другое.
- •3. Гидролазы - ферменты катализируют расщепление внутримолекулярных связей при помощи молекул воды:
3.5.1. Особенности функционирования активного центра
1) Связывание субстрата с активным центром осуществляется в результате образования слабых нековалентных взаимодействий, таких как ионные, гидрофобные и водородные связи.
2) Существование активного центра обусловлено наличием у молекулы белков глобулярной структуры.
3) В процессе формирования третичной структуры белка происходит сближение и стабилизация радикалов аминокислот, принимающих участие в формировании активного центра, при помощи дисульфидных связей и множественных слабых нековалентных взаимодействий.
!!! Денатурация нарушает связи, стабилизирующие третичную структуру, активный центр разрушается, и каталитические свойства фермента полностью или частично подавляются.
В активном центре выделяют две части: центр связывания (связывающий участок) и каталитический центр (каталитический участок) (Рис. 3.3):
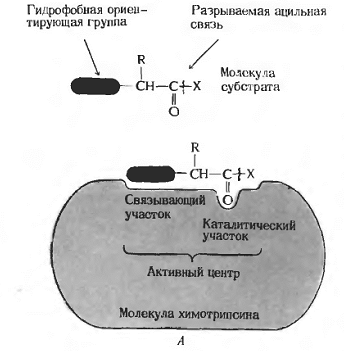
Рис. 3.3. Структура активного центра фермента
Функция центра связывания: радикалы аминокислот, входящие в центр связывания, обеспечивают фиксацию субстрата, подвергающегося ферментативному воздействию.
!!! Связывание ферментом субстрата - это именно тот процесс, благодаря которому реализуется принцип специфичности действия ферментов.
5) Функция каталитического центра: радикалы аминокислот и (или) коферменты, входящие в каталитический центр, обеспечивают непосредственно протекание каталитической реакции.
На рисунке 3.4 представлен активный центр рибонуклеазы А – фермента, гидролизующего молекулу РНК:
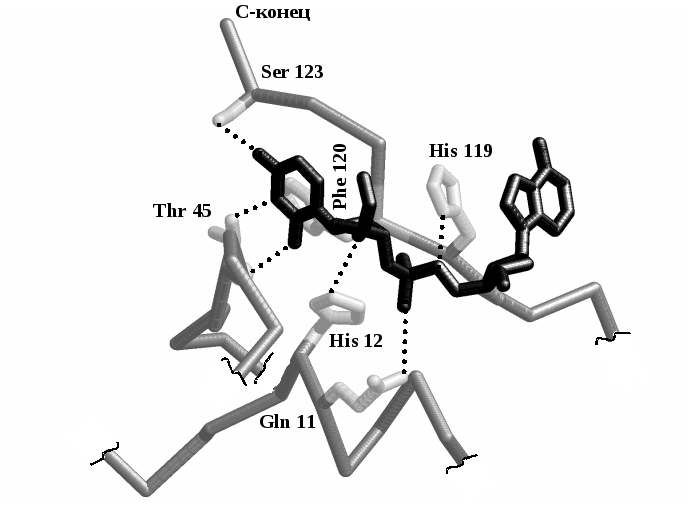
Рис. 3.4. Трехмерная структура активного центра рибонуклеазы А по данным рентгено-структурного анализа. Для удобства показаны лишь участки полипептидной цепи несущие связывающие и каталитические группы. Полипептидые цепи представлены ходом пептидного остов (темно-серые), связывающие и каталитические группы — палочковыми моделями (светло-серые), модель субстрата [уридилил-(3'→5')-аденозин] — черной палочковой моделью. Водородные связи обозначены пунктиром.
Молекула РНК состоит из множества мононуклеотидов, связанных фосфодиэфирной связью.
а) аминокислотные остатки, формирующие центр связования: аминокислотные остатки: Гли 11, Тир 45 и Сер 123, которые образуют водородные связи с атомами мононуклеотида и тем самым фиксируют молекулу субстрата.
б) аминокислотные остатки, формирующие активный центр: Гис 12 и Гис 119.
Оба эти гистидина участвуют в процессе катализа, причём Гис 12 образует связь с гидроксильной группой рибозы, а Гис 119 взаимодействует с соседним фосфатом.
!!! Связь между гидроксильной группой рибозы и остатком фосфорной кислоты при этом разрывается.
3.5.2. Особенности состава и структуры активного центра
1) В состав активных центров многих ферментов входит ограниченное количество аминокислотных остатков.
К ним относятся только аминокислоты, содержащие полярные и заряженные группы: гистидин, серин, тирозин, цистеин, лизин и некоторые другие аминокислоты.
2) В состав активных центров сложных ферментов всегда входят простетические группы или коферменты.
Иными словами, у сложных ферментов активный центр также является сложным по составу – двухкомпонентным, состоящим из аминокислотных остатков, соединённых с небелковой частью молекулы.
