
- •Федеральное агенство по образованию
- •Введение
- •1. Литературный обзор
- •1.1 Оптические свойства
- •1.2 Поглощение в германии
- •1.3 Редкоземельные элементы
- •1.4 Размещение лантаноидов в соотвеетствии с их электронным строением и периодическим законом мендлеева
- •2. Теоретичекая часть
- •2.1 Методы определения коэффициентов пропускания поглощения.
- •2.2 Закон бугера – ламберта – бера
- •3 .Экспериментальная часть
- •3.1. Четырехзонодный метод
- •3.2 Точечно-контактный метод определения типа проводимости
- •3.3 Приготовление образцов для оптических исследований.
- •3.4 Спектрофотометр инфракрасный икс – 29
- •3.5 Ход эксперимента и результаты.
- •Литература.
1.4 Размещение лантаноидов в соотвеетствии с их электронным строением и периодическим законом мендлеева
Открыв периодический закон, Менделеев, сравнивая элементы не только по сходству, но и по различию, дал необычно точное его выражение в периодической системе элементов. Эта весьма стройная и продуманная в мельчайших деталях система обладает рядом принципиальных особенностей, отличающих ее от современных форм выражения периодического закона.
В последнем издании «Основ химии» (СПб., 1906, стр. vii) Менделеев пишет: «Между Се = 140 и Та = 183 недостает целого большого периода, но ряд редких элементов (изучение их неполно), например Рг=141, Nd=144,
Sm = 150, Еu=152, Сd = 157, Тb = 160, Hо = 165, Еr=166, Тu=171 и Yb = 173, представляет по современным сведениям вес атома, как раз выполняющий этот промежуток, а потому в указанном месте периодическая система элементов представляет своего рода разрыв, требующий новых изысканий». Менделеев, не зная точно числа лантаноидов, равного, как теперь известно, 14, и не имея достаточно подробных данных об их свойствах, естественно, и не мог точно расположить эти элементы по группам, тем более что нарастание их атомных весов с увеличением атомного номера происходит аномально. Однако он совершенно определенно указал, что они должны быть размещены в восьмом, девятом и десятом рядах 6-го периода и черточками отметил, где именно. Такое размещение лантаноидов и актиноидов было сделано Менделеевым еще в 1870 г. по совершенно принципиальным соображениям и сохранилось без изменения во всех его трудах вплоть до последнего издания «Основ химии. Он не допускал возможности какого-либо иного решения вопроса и ни в одной из своих многочисленных работ по периодическому закону не отступал от этой принципиальной точки зрения.
Если исходить из общей закономерности, что сумма электронов вне заполненных оболочек для элементов главных подгрупп и d-переходных металлов однозначно определяет номер группы, то для группировки лантаноидов необходимо суммировать не только их внешние d- и s-электроны, но и электроны, находящиеся на более внутренних незаполненных f-уровнях. Как и в случае d-переходных металлов, необходимо исключать из этой суммы электроны заполненной оболочки f14, а также, согласно правилу Гунда, электроны, образующие конфигурацию f7 , отвечающую семи неспаренным электронам наполовину заполненной оболочки f14.
Размещение лантаноидов по группам, сделанное на основании их электронного строения, т. е. по сумме f-, d-, s-электронов вне устойчивых конфигураций, представлено в таблице.
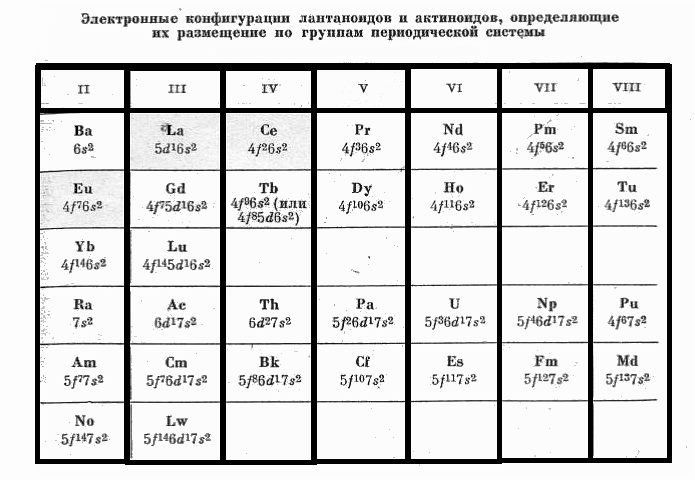
Цезий, имеющий один электрон на 6s-уровне, относится к I группе, барий с двумя электронами на этом же уровне — ко второй, а лантан (d1 s2) — к третьей. Церий с двумя электронами на внутренней незаполненной 4f-оболочке и двумя электронами на внешней 6s-оболочке является элементом IV группы. У европия 4f-оболочка заполнена наполовину, и вследствие устойчивости группы из семи неспаренных электронов (4f7) групповыми валентными электронами оказываются лишь внешние два 6s-электрона, поэтому европий представляет элемент II группы. Вследствие устойчивости группы 4f7 дополнительный электрон у следующего элемента — гадолиния занимает не 4f-, а 5d-уровень. Гадолиний с внешней электронной конфигурацией 5d1 6s2 представляет, следовательно, элемент III группы.
Легко видеть, что размещение лантаноидов по группам периодической системы по сумме электронов вне заполненных оболочек и стабильных конфигураций 4f7 является нонвариантным решением лантаноидной проблемы. Так как именно периодическое повторение электронного строения атомов при возрастании атомного номера является единственной причиной периодического повторения свойств и, следовательно, сущностью периодического закона, то указанное размещение лантаноидов по группам 6-го периода исключает возможность иных решений. Это решение, полученное на основе современных данных атомной физики о строении электронных оболочек, совершенно точно соответствует идеям Менделеева.
Теперь выясним, к каким подгруппам относятся лантаноиды. Заполнение оболочек s2р6 отвечает элементам главных подгрупп а, т.е. щелочным металлам (Ia), щелочноземельным металлам (IIa), элементам подгрупп бора (IIIa), углерода (IVa), азота (Va), кислорода (VIa), фтора (VIIa) и инертным газам (VIIIa). Заполнению Зd-, 4d- и 5d- оболочек десятью электронами отвечают побочные b подгруппы d-переходных металлов — от подгруппы скандия (IIIb) до подгруппы цинка (IIb). При этом, так как групп всего восемь, а элементов с заполняющейся d10-оболочкой в каждом большом периоде по десять, то в одной из групп, а именно в восьмой, размещаются триады. Поскольку в последовательностях лантаноидов и актиноидов происходит заполнение глубинных f-оболочек, эти металлы не могут быть ни аналогами элементов главных подгрупп с заполняющимися s,p-оболочками, ни аналогами d-переходных металлов. Отсюда следует необходимость выделения их в третьи самостоятельные подгруппы (c) f-переходных металлов. Это означает, что элемент IV группы церий не является аналогом титана или углерода, а возглавляет собственную IVc подгруппу, состоящую иа церия, тербия, тория и берклия.
Таким образом, все f-переходные металлы выделяются в самостоятельные подгруппы с, отличающиеся от подгрупп а и b, что приводит к периодической системе с тремя подгруппами. При этом поскольку 14 лантаноидов и 14 актиноидов должны быть размещены в восьми группах, то в каждой группе, кроме первой, оказывается по паре лантаноидов и по паре актиноидов, что отвечает заполнению первой и второй половины 4f14- и 5f14-оболочек.
Так как элементы подгруппы европия оказываются менее электроположительными, чем щелочноземельные металлы, но более электроположительными, чем цинк, кадмий и ртуть, то подгруппа IIc располагается между IIa и IIb подгруппами. Поскольку элементы подгруппы гадолиния менее электроположительны, чем лантан, но более электроположительны, чем галлий, индий и таллий, подгруппа IIIc находится правее подгруппы IIIb и левее подгруппы IIIa. Электроположительность элементов возрастает от подгрупп углерода и титана к подгруппе церия, поэтому подгруппа IVc должна располагаться слева от подгрупп титана (IVb) и углерода (IVa). Периодическая система элементов с вертикальными столбцами подгрупп a, b и c полностью удовлетворяет периодическому закону, поскольку в ней все без исключения элементы расположены в последовательности возрастания атомных номеров и размещены по группам. В то же время все лантаноиды и актиноиды выделены в самостоятельные подгруппы с, правильно расположенные относительно подгрупп a и b.
Возникает вопрос: мог ли Менделеев, которому к 1906г. были известны 11 из 14 лантаноидов (все, кроме прометия, диспрозия и лютеция), расположить их на местах, которые он для них резервировал в системе. Ответ на это может быть только отрицательным. Уверенность, с которой Менделеев исправил атомные веса и нашел места в системе всем известным элементам и предсказал существование и свойства многих не открытых еще элементов, основывалась па тщательном сопоставлении их атомных весов, физико-химических свойств и, главное, на уверенности в том, что периодический закон есть общий закон природы, не имеющий исключений.
