
- •Министерство образования и науки российской федерации
- •Содержание Введение
- •Критерии оценки лабораторно-практических работ студентов
- •Общие требования к выполнению и оформлению лабораторно-практических работ
- •Основные правила по технике безопасности при выполнении лабораторных работ
- •При химических ожогах
- •Практическое занятие № 1 Тема: Основные понятия и законы
- •Теоретический материал
- •Алгоритм решения задач
- •Примеры решения задач
- •Задания для самостоятельной работы
- •Практическое занятие № 2 Тема: Классификация химических реакций
- •Теоретический материал
- •Алгоритм анализа химического уравнения
- •Задания для самостоятельной работы
- •Лабораторное занятие №1 Тема: Приготовление растворов заданной концентрации
- •Теоретический материал
- •Лабораторное занятие №2 Тема: Решение экспериментальных задач по распознаванию неорганических веществ
- •Теоретический материал
- •Лабораторное занятие №3 Тема: Решение экспериментальных задач по распознаванию органических веществ
- •Теоретический материал
- •1 Вариант
- •Волокна растительного происхождения Хлопок
- •Список литературы
- •230115 Программирование в компьютерных системах
Задания для самостоятельной работы
Решите представленные задачи, используя алгоритм решения.
Составьте уравнение реакции горения магния и вычислите массу оксида магния
 ,
который получится при сгорании 6 г
металла.
,
который получится при сгорании 6 г
металла.В реакцию с водой вступило 28 г оксида кальция
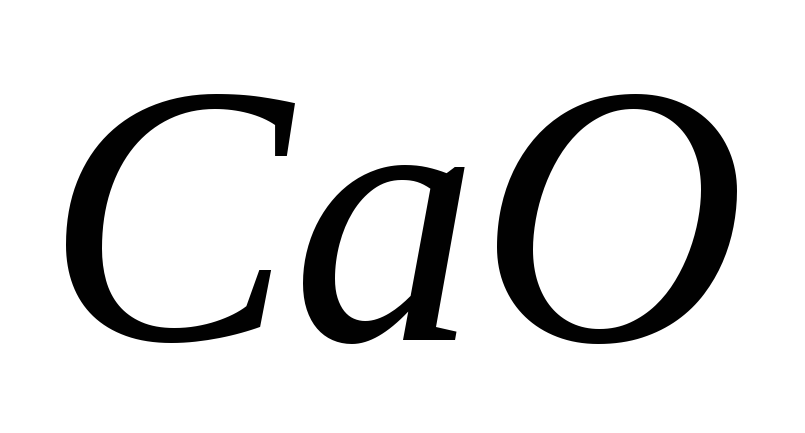 .
Рассчитайте массу образовавшегося
вещества.
.
Рассчитайте массу образовавшегося
вещества.Рассчитайте, какая масса кислорода образуется при разложении 54 г воды.
Рассчитайте массу оксида меди
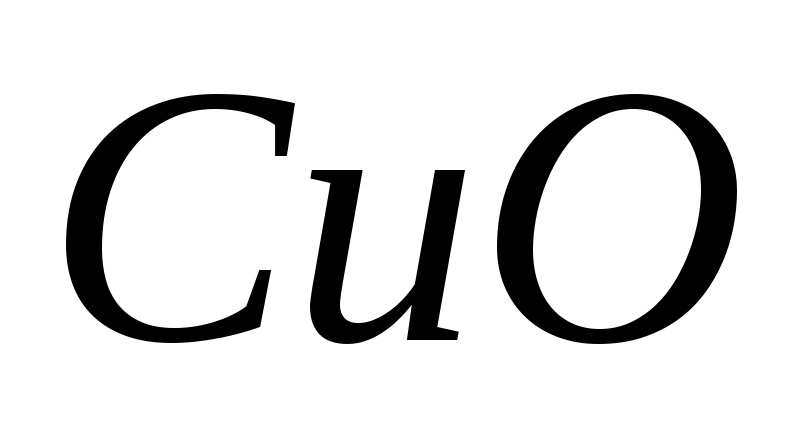 ,
образующегося при разложении 49 г
гидроксида меди
,
образующегося при разложении 49 г
гидроксида меди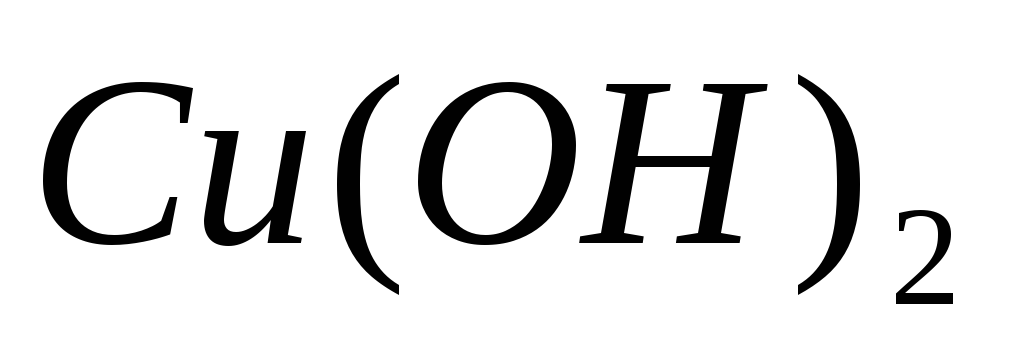 .
.В реакцию с азотной кислотой
 вступило 20 г гидроксида натрия
вступило 20 г гидроксида натрия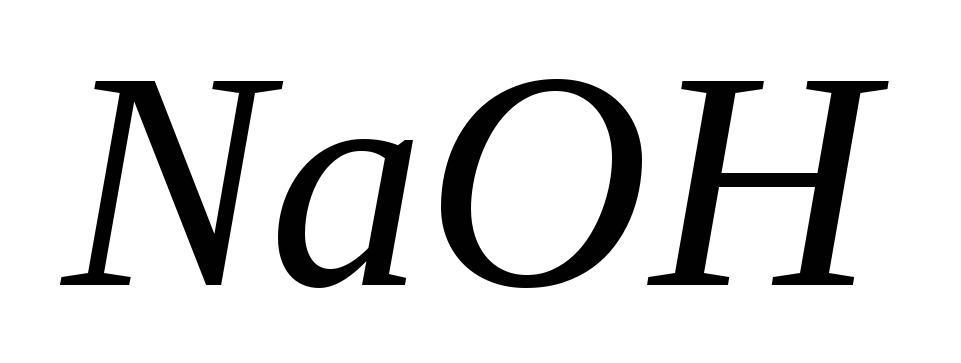 .
Рассчитайте массу образовавшейся соли.
.
Рассчитайте массу образовавшейся соли.Рассчитайте объем водорода (н.у.), образующегося при разложении 54 г воды.
Какой объем водорода (н.у) потребуется для полного восстановления меди из оксида меди
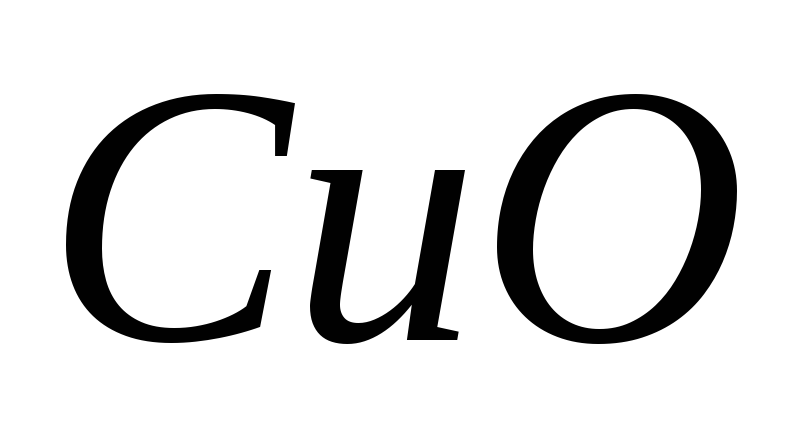 массой
8 г.
массой
8 г.Составьте уравнение реакции горения фосфора (при этом получается оксид фосфора (V)
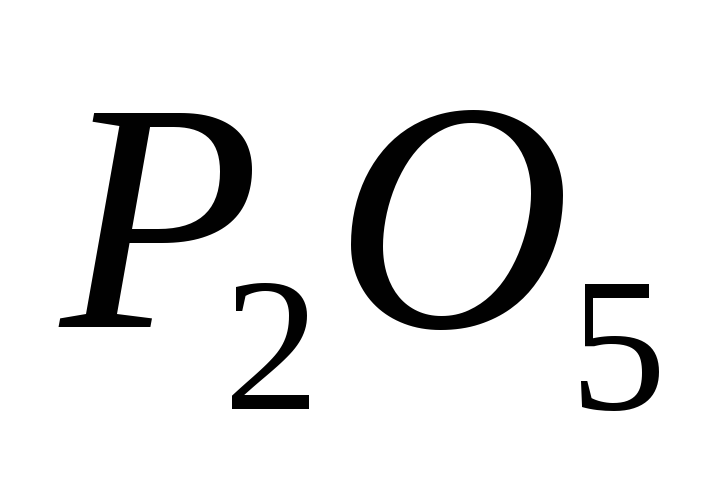 )
и вычислите, хватит ли 10 г кислорода на
сжигание 6,2 г фосфора.
)
и вычислите, хватит ли 10 г кислорода на
сжигание 6,2 г фосфора.
Контрольные вопросы:
Как формулируется закон сохранения массы веществ?
Чем объясняется сохранение массы веществ в химических реакциях?
Что такое химическое уравнение?
Как называются числа перед формулами веществ в химических уравнениях?
Что показывают коэффициенты перед формулами веществ в уравнениях химических реакций?
Рекомендуемая литература: 1.1 – 1.5, 2.1 -2.9
Практическое занятие № 2 Тема: Классификация химических реакций
Цель: формирование умений применять признаки классификации химических реакций для описания реакций различных типов по алгоритму.
Время выполнения: 2 часа
Теоретический материал
Химические реакции можно классифицировать по следующим признакам: изменению степени окисления атомов, входящих в состав реагирующих веществ (окислительно-восстановительные реакции); числу и составу исходных и образующихся веществ (реакции соединения, разложения, замещения, обмена); тепловому эффекту (экзотермические и эндотермические реакции); признаку обратимости (обратимые и необратимые реакции).
Алгоритм анализа химического уравнения
Определите степень окисления элементов в веществах и сделайте вывод, является ли данная реакция окислительно-восстановительной (ОВР). Если данная реакция является ОВР, составьте электронный баланс, определите окислитель и восстановитель.
Если данная реакция протекает в растворе, составьте полное и сокращенное ионные уравнения.
Проведите классификацию данной реакции по числу и составу исходных и образующихся веществ.
Проведите классификацию по тепловому эффекту.
Проведите классификацию по признаку обратимости.
Проведите классификацию по наличию катализатора (каталитическая и некаталитическая реакция).
Задания для самостоятельной работы
Пользуясь алгоритмом, дайте характеристику каждой из пяти предложенных химических реакций. Расставьте, если необходимо, коэффициенты реакции.
I вариант
![]() t,
Pt
t,
Pt
1.
SO2
+ O2
![]() SO3
+ Q
SO3
+ Q
t
2. AgNO3 Ag + NO2 + O2 – Q
3. Fe + CuSO4( р) FeSO4( р) + Cu
4. HNO3 (р) + Ba (OH)2 ( р) Ba (NO3)2 + H2O + Q
5. Li + N2 Li3N
II вариант
1.
KI(
р
) + Pb
( NO3
)2 (р)
PbI2
![]() + KNO3
+ KNO3
t
2. TiCl4 + Mg Ti + MgCl2 + Q
3.
CO
( г)
+ H2O
( г)
![]() СO2
( г)
+ H2
( г)
СO2
( г)
+ H2
( г)
4. CuO + HCl ( p) CuCl2 + H2O
MnO2
5. H2O2 H2O + O2 + Q
III вариант
t
1. CrO3 Cr2 O3 + O2 - Q
2.
K2 S (
р)
+ CuCl2 (
р)
CuS
![]() + KCl
+ KCl
3. NO ( г) + O2 ( г) NO2 ( г) + Q
4. WO3
+ H2 (г)
![]() W + H2O - Q
W + H2O - Q
t, Cr2 O3
5. KCl O3 KCl + O2 - Q
IV вариант
1. N2O N2 + O2 - Q
2. Cl2 + NaBr ( р ) Br2 + NaCl
3. Cr2 O3 ( к ) + Al ( к ) Al2O3 + Cr + Q
Fe![]()
4. N![]() 2
(г)
+ H2
(г)
2
(г)
+ H2
(г)
![]() NH3
( г)
+ Q
NH3
( г)
+ Q
5. Na2CO3 ( р ) + H2SO4 ( р) Na2SO4 + H2O + CO2
Контрольные вопросы:
По каким признакам классифицируют химические реакции?
На какие типы делятся химические реакции по: а) признаку изменения степеней окисления; б) знаку теплового эффекта; в) обратимости?
На какие типы делятся химические реакции по числу и составу исходных веществ и продуктов реакции?
Какие реакции называются реакциями соединения?
Какие реакции называются реакциями замещения?
Какие реакции называются реакциями обмена?
Рекомендуемая литература: 1.1 – 1.5, 2.1 -2.9
