
- •Вводное лабораторное занятие Основы техники лабораторных работ
- •Основные правила техники безопасности при работе в лаборатории
- •Требования к оформлению результатов лабораторно – практического занятия.
- •Лабораторная работа № 1 Химический состав организма человека. Качественные реакции на функциональные группы в составе органических соединений Общая биохимия
- •Химический состав организма человека
- •Лекция 1. Тема: Введение в биохимию. Химический состав организма человека. Общие закономерности обмена веществ
- •Элементный состав организмов
- •3.Молекулы и ионы, входящие в состав организма человека, их содержание и функции.
- •Молекулярный состав клетки
- •4.Уровни структурной организации химических соединений живых организмов
- •Регуляция водного баланса и его нарушения.
- •Общие закономерности обмена веществ и энергии в организме человека
- •6. Особенности протекания обменных процессов при различных состояниях организма
- •Диссимиляция и ассимиляция
- •Регуляция обмена веществ
- •Нарушения обмена веществ
Требования к оформлению результатов лабораторно – практического занятия.
Результаты лабораторной работы аккуратно оформляются в рабочей тетради в соответствии со схемой, предлагаемой в методических указаниях по изучаемой теме.
По каждому лабораторно-практическому занятию в тетради студента должны быть следующие записи:
- Дата и название темы занятия.
- Название лабораторной работы.
- Название опыта. В каждом опыте отмечается теоретическое обоснование; схема химического процесса, происходящего в пробирке; наблюдения, оформленные в виде вывода или таблицы.
- Письменные ответы на вопросы, предлагаемые для самостоятельной работы. В конце занятия студент обязательно подает выполненную работу на подпись преподавателю.
Лабораторная работа № 1 Химический состав организма человека. Качественные реакции на функциональные группы в составе органических соединений Общая биохимия
Общая биохимия изучает биохимические основы процессов жизнедеятельности. В её структуре выделяют два раздела: статическая и динамическая биохимия.
Статическая биохимия рассматривает химический состав организма (элементарный, ионный и молекулярный), классификацию, строение и биологическую роль основных биоорганических соединений.
Динамическая биохимия – науки о путях и механизмах биохимических процессов, протекающих в клетке.
Химический состав организма человека
Цель работы:
- изучить химические элементы и химические вещества, входящие в состав организма человека;
- выявить с помощью химических реакций функциональные группы в составе биоорганических молекул.
Общие сведения по теме.
Все многообразие веществ животного и растительного мира построено из сравнительно небольшого количества исходных составных частей. Это химические элементы и химические вещества. Из 107 известных химических элементов в живых организмах обнаружено 60, однако в концентрациях, позволяющих не считать этот элемент случайной примесью, только 22. Все химические элементы, встречающиеся в живых организмах, в соответствии с их концентрацией в клетках делят на три группы:
- макроэлементы: C, H, O, N, P, S, Cl, Na, K, Ca. На их долю приходится более 0,01%. Количество макроэлементов показано в таблице 1;
- микроэлементы: Fe, Mg, Zn, Cu, Co, J, Br, V, F, Mo, Al, Si и др. На их долю приходится от 0,01 до 0,000001%;
- ультрамикроэлементы: Hg, Au, Ag, Ra и др. На их долю приходится менее 0,000001%.
Таблица 1. Содержание химических элементов в живом организме
|
Элементы |
С |
О |
Н |
N |
Ca |
P |
K |
S |
Na |
Cl |
|
% |
18 |
65 |
10 |
3 |
2 |
1,1 |
0,35 |
0,25 |
0,15 |
0,15 |
Установлено, что химические элементы концентрируются в организме человека в разных тканях и органах. Большинство их задерживается в печени, цинк концентрируется в гипофизе и половых железах, никель – в поджелудочной железе, кадмий – в почках, молибден – в белом веществе мозга, кальций и стронций – в костях, барий – в сетчатке глаз, литий - в легких, хром – в гипофизе, бор – в тканях, содержащих жировые вещества.
Недостаток отдельных химических элементов в почве и воде может служить причиной разнообразных заболеваний у людей. Например, недостаток йода вызывает отклонения в работе щитовидной железы, нехватка фтора приводит к заболеваниям зубов, высокое содержание стронция провоцирует подагру.
Рассмотрим биологическое значение важнейших химических элементов.
Кальций составляет вместе с фосфором основу костной ткани, активирует деятельность ряда ферментов, регулирует процессы мышечного сокращения, свертывания крови, уплотнения коллоидов. Кроме того, кальций содействует выведению воды из организма.
Фосфор – важнейший элемент, входящий в состав белков, нуклеиновых кислот, макроэргических соединений (аденозинтрифосфорной кислоты, креатинфосфата). С превращениями последних связана мышечная и умственная деятельность, жизнеспособность организма.
Магний участвует в формировании костей, регуляции работы нервной ткани, в обмене углеводов, энергетическом обмене.
Натрий участвует в регуляции кровяного давления, водного обмена (способствует набуханию коллоидов тканей, что задерживает воду в организме), активации пищеварительных ферментов, регуляции работы нервной и мышечной тканей.
Калий регулирует кислотно –щелочное равновесие крови, участвует в передаче нервных импульсов, активирует работу ферментов. Считают, что калий обладает защитным действием против нежелательного действия избытка натрия и нормализует давление крови. Калий способен усиливать выделение мочи.
Хлор участвует в образовании желудочного сока, формировании плазмы, активирует ряд ферментов.
Сера входит в состав белков, некоторых витаминов и гормонов.
Железо участвует в образовании гемоглобина, некоторых ферментов.
Цинк входит в состав молекулы гормона инсулина, регулирующего обмен углеводов.
Для живого организма характерно избирательное отношение к окружающей среде. Живое состоит на 90% из С, Н, О, N, Р, S, тогда как неживое - из А1, Si, О, Fe, Ca, Na. Живая материя в целом напоминает Вселенную, построенную, главным образом, из легких элементов.
Несмотря на имеющиеся качественные отличия по элементарному составу, на этом уровне организации материи нет принципиальных отличий живого от неживого. Отличия начинают ясно просматриваться на молекулярном уровне. Вещества, входящие в состав живых организмов, подчиняются всем законам химии и физики. Их делят на две группы: органические и неорганические (табл. 2).
Таблица 2. Содержание различных веществ в организме человека, в %
|
Вода |
Сухой остаток 20-40 % | ||||
|
Белки и нуклеиновые кислоты |
Жиры и жироподобные вещества |
Сложные углеводы |
Низкомолекулярные органические вещества |
Минеральные вещества | |
|
60-80 |
15-20 |
3-20 |
1-5 |
1 |
1-3 |
Неорганические вещества представлены в организме человека водой и минеральными солями. На долю воды в организме взрослого человека приходится примерно 70 %, что при массе тела в 60 кг составляет 42 кг, а при массе тела в 70 кг – 49 кг. Вода, являясь основной составной частью внутренней среды организма, активно участвует в обмене веществ.
Минеральные соли встречаются в виде молекул, например, третичный фосфат кальция – Са3(Р04)2, карбонат кальция – СаСО3 и ионов (Na+, К+, Fe+2, Fe+3, Са+2, Mg+2, Ca+2, F-, Cl -, Br -, J-, SO4-2, HCO3-, H2P04-, H2P04-2). Ионный состав организма во многом сходен с ионным составом морской воды. Это свидетельство того, что первичные организмы возникли и развивались в первобытном океане, и на протяжении всей эволюции в наземных условиях в жидкостях и клетках нашего организма сохранился ионный баланс первобытного океана.
Более 100 ионов имеют биологическое значение. Ионы обеспечивают:
- осмотическую работу организма (Nа+, К+, Cl-);
- регуляцию активности ферментов (Cl-, Nа+, Mg+2, Ca+2);
- пространственную структуру биополимеров (Zn+2, Fe+2, Сu+2, Мn+2, Со+2, Mg+2);
- сохранение постоянства внутренней среды организма (НСО3-, Н2РО4-, НРО4-2);
- проницаемость клеточных мембран (К+, Nа+);
- обезвреживающую функцию печени (SO4-2).
Органические вещества отличает большое многообразие молекул. Так, количество разновидностей только белковых молекул приближается к миллиону. Основа этого многообразия – уникальная способность атомов углерода соединяться между собой, образуя цепи любого размера с бесконечно разнообразной структурой. Связи между атомами углерода могут быть простыми (одинарные -С-С-С-) и кратными (двойные - С = С - либо тройные - С ≡ С -). Большое значение имеет четырехвалентность углерода: три валентности могут быть использованы для построения трехмерного скелета, а четвертая – для включения в состав молекулы группы атомов, обладающей повышенной реакционной способностью. Эта группа называется функциональной и в совокупности с радикалом определяет химические свойства органических соединений (табл. 3).
Таблица 3. Классификация органических соединений по функциональным группам
|
Название класса |
Формула |
Название класса |
Формула |
|
Углеводороды |
R - H |
Карбоновые кислоты |
О || R – C | ОН |
|
Спирты |
R - OH |
Простые эфиры |
R - O - R1 |
|
Альдегиды |
О
||
R |
Сложные эфиры |
О || R - C | O - R1 |
|
Кетоны |
R1 | R - C || О |
Амины |
R - NН2 |
Номенклатура спиртов, фенолов и их производных. По номенклатуре ИЮПАК названия простых спиртов образуются от названий соответствующих алканов с добавлением суффикса «-ол», положение которого указывается арабской цифрой.
Для распространенных спиртов, имеющих простое строение, используют упрощенную номенклатуру: название органической группы преобразуют в прилагательное (с помощью суффикса и окончания «овый») и добавляют слово «спирт».
![]() Классификация спиртов разнообразна и
зависит от того, какой признак строения
взят за основу.
Классификация спиртов разнообразна и
зависит от того, какой признак строения
взят за основу.
1. В зависимости от количества гидроксильных групп в молекуле спирты делят на:
а) одноатомные (содержат одну гидроксильную ОН-группу), например, метанол СН3ОН, этанол С2Н5ОН, пропанол С3Н7ОН;
б) многоатомные (две и более гидроксильных групп), например, этиленгликоль
HO–СH2–CH2–OH, глицерин HO–СH2–СН(ОН)–CH2–OH, пентаэритрит С(СН2ОН)4.
Соединения, в
которых у одного атома углерода
![]()
![]() есть
две гидроксильных группы, в большинстве
случаев нестабильны и легко превращаются
в альдегиды, отщепляя при этом воду:
RCH(OH)2
RCH=O + H2O
есть
две гидроксильных группы, в большинстве
случаев нестабильны и легко превращаются
в альдегиды, отщепляя при этом воду:
RCH(OH)2
RCH=O + H2O
Спирты, содержащие
три группы ОН у одного атома углерода
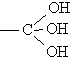
 ,
не существуют.
,
не существуют.
2. По типу атома углерода, с которым связана группа ОН, спирты делят на:
а) первичные, у которых ОН-группа связана с первичным атомом углерода. Первичным называют атом углерода (выделен красным цветом), связанный всего с одним углеродным атомом. Примеры первичных спиртов – этанол СH3–CH2–OH, пропанол СH3–CH2–CH2–OH;
б) вторичные, у которых ОН-группа связана с вторичным атомом углерода. Вторичный атом углерода (выделен синим цветом) связан одновременно с двумя атомами углерода, например, вторичный пропанол, вторичный бутанол (рис. 1).
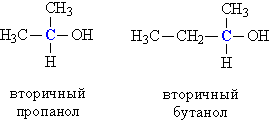
Рис. 1. Строение вторичных спиртов
в) третичные, у которых ОН-группа связана с третичным атомом углерода. Третичный углеродный атом (выделен зеленым цветом) связан одновременно с тремя соседними атомами углерода, например, третичный бутанол и пентанол (рис. 2).
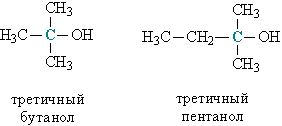
Рис. 2. Строение третичных спиртов
В соответствии с типом углеродного атома присоединенную к нему спиртовую группу также называют первичной, вторичной или третичной.
У многоатомных спиртов, содержащих две или более ОН-групп, могут присутствовать одновременно как первичные, так и вторичные НО-группы, например, в глицерине или ксилите (рис. 3).

Рис. 3. Сочетание в структуре многоатомных спиртов первичных и вторичных он-групп
3. По строению органических групп, связанных ОН-группой, спирты подразделяют на предельные (метанол, этанол, пропанол), непредельные, например, аллиловый спирт СН2=СН–СН2–ОН, ароматические (например, бензиловый спирт С6Н5СН2ОН), содержащие в составе группы R ароматическую группу.
Непредельные спирты, у которых ОН-группа «примыкает» к двойной связи, т.е. связана с атомом углерода, участвующим одновременно в образовании двойной связи (например, виниловый спирт СН2=СН–ОН), крайне нестабильны и сразу же изомеризуются (см. ИЗОМЕРИЗАЦИЯ) в альдегиды или кетоны:
CH2=CH–OH CH3–CH=O
Номенклатура спиртов. Для распространенных спиртов, имеющих простое строение, используют упрощенную номенклатуру: название органической группы преобразуют в прилагательное (с помощью суффикса и окончания «овый») и добавляют слово «спирт»:
Таблица undefined
В том случае, когда строение органической группы более сложное, используют общие для всей органической химии правила. Названия, составленные по таким правилам, называют систематическими. В соответствии с этими правилами, углеводородную цепь нумеруют с того конца, к которому ближе расположена ОН-группа. Далее используют эту нумерацию, чтобы указать положение различных заместителей вдоль основной цепи, в конце названия добавляют суффикс «ол» и цифру, указывающую положение ОН-группы (рис. 4):
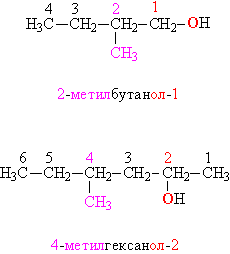
Рис. 4. Систематические названия спиртов.
Функциональные (ОН) и замещающие (СН3) группы, а также соответствующие им цифровые индексы выделены различающимися цветами. Систематические названия простейших спиртов составляют по тем же правилам: метанол, этанол, бутанол. Для некоторых спиртов сохранились тривиальные (упрощенные) названия, сложившиеся исторически: пропаргиловый спирт НСС–СН2–ОН, глицерин HO–СH2–СН(ОН)–CH2–OH, пентаэритрит С(СН2ОН)4, фенетиловый спирт С6Н5–CH2–CH2–OH.
Номенклатура альдегидов. Алифатические альдегиды называют по самой длинной углеродной цепи, прибавляя к названию алифатического углеводорода окончание -аль. Наличие в соединении двух альдегидных групп обозначается окончанием -диаль. Нумерацию цепи начинают от углеродного атома, принадлежащего альдегидной группе. В названии номер при альдегидной группе, как правило, не ставят.
Если в соединении имеется другая группа, имеющая преимущество в перечислении как главная группа, то альдегидную группу в алициклических соединениях называют, используя префикс формил-:Циклические соединения с альдегидной группой в боковой цепи рассматривают как замещённые алифатические альдегиды. Название производят от названия алифатического альдегида и радикала в качестве приставки (допускаетсятривиальное названиеальдегида).
Для альдегидов допускаются тривиальные названия, если соответствующая кислота имеет тривиальное название:
CH2O - формальдегид
CH3-CHO - ацетальдегид
CH3-CH2-CHO - пропиональдегид
CH3-CH2-CH2-CHO - бутиральдегид
(CH3)2-CH-CHO - изобутиральдегид
CH3-(CH2)3-CHO - валеральдегид
(CH3)2CH-CH2-CHO - изовалеральдегид
CH2=CH-CHO - акролеин (акрилальдегид)
CH3-CH=CH-CHO - кротональдегид
С6H5-CHO - бензальдегид
Номенклатура кетонов. Названия алифатических и алициклических кетонов образуют, прибавляя суффикс -он или -дион (для дикетонов) к названию родоначального углеводорода. Допускается название кетонов по радикальному признаку, при этом называют радикалы при кетогруппе в порядке возрастания сложности и в конце названия ставят -кетон (например, метилэтилкетон — CH3-CO-CH2-CH3).
Если в соединении имеется другая группа, имеющая преимущество в перечислении как главная, то для обозначения карбонильной группы используется префикс оксо. Карбоциклические кетоны с кетонной группой в боковой цепи называют по радикалам. Кроме того, допускаются названия по алифатическому кетону или по циклической структуре. В последнем случае боковая цепь называется как остаток кислоты. Название имеет суффикс -офенон, -онафтон (допустимо только для бензола и нафталина соответственно).
Для некоторых кетонов допускаются тривиальные названия:
CH3-CO-CH3 - ацетон
(CH3)2C=CH-CO-CH3 - окись мезитила
CH3-CO-CO-CH3 - диацетил
C6H5-CO-CO-C6H5 - бензил (дибензоил)
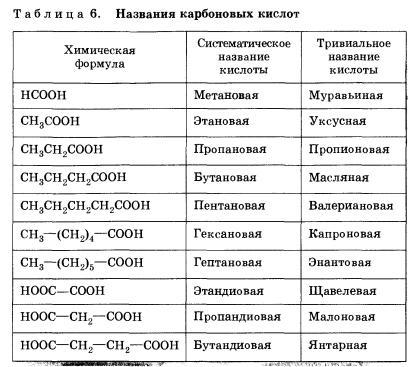
Общие принципы образования названий карбоновых кислот,как и других органических соединений, мы уже рассматривали. Остановимся подробнее на номенклатуре одно- и двухосновных карбоновых кислот. Название карбоновой кислоты образуется от названия соответствующегоалкана(алкана с тем же числом атомов углерода в молекуле) с добавлением суффикса -ов, окончания-аяи слова кислота. Нумерация атомовуглероданачинается с карбоксильной группы. Например:
Номенклатура простых эфиров. Если группы R и R' в простом эфире одинаковы, то его называют симметричным, если разные – несимметричным. В название эфира включают названия органических групп, упоминая их в алфавитном порядке, и добавляют слово эфир, например, C2H5OC3H7 – пропилэтиловый эфир. Для симметричных эфиров перед названием органической группы вводят приставку «ди», например, C2H5OC2H5 – диэтиловый эфир. Для многих эфиров часто используют тривиальные (упрощенные) названия, сложившиеся исторически. К простым эфирам иногда относят соединения, которые содержат эфирный фрагмент С–О–С в составе циклической молекулы (рис. 1), одновременно их причисляют к другому классу соединений – гетероциклическим соединениям. Есть также соединения (см. АЛЬДЕГИДЫ И КЕТОНЫ), в состав которых входит фрагмент С–О–С, но к классу эфиров их не относят, это полуацетали – соединения, содержащие одновременно алкокси- и гидрокси-группу у одного атома углерода: >C(OH)OR, а также ацетали – соединения, где у одного атома углерода находятся одновременно две RО-группы: >C(OR)2 (рис. 1). Наличие у одного атома углерода сразу двух химически связанных атомов О делает эти соединения непохожими по химическим свойствам на простые эфиры.
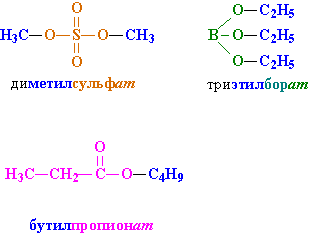
Номенклатура сложных эфиров. Название создается следующим образом: вначале указывается группа R, присоединенная к кислоте, затем – название кислоты с суффиксом «ат» (как и в названиях неорганических солей: карбонат натрия, нитрат хрома). Примеры на рис. 2
Номенклатура аминов. к названию органических групп, связанных с азотом, добавляют слово «амин», при этом группы упоминают в алфавитном порядке, например, СН3NHС3Н7 – метилпропиламин, СН3N(С6Н5)2 – метилдифениламин. Правила допускают также составлять название, взяв за основу углеводород, в котором аминогруппу рассматривают как заместитель. В таком случае ее положение указывают с помощью числового индекса: С5Н3С4Н2С3Н(NН2)С2Н2С1Н3 – 3-аминопентан (верхние числовые индексы синего цвета указывают порядок нумерации атомов С). Для некоторых аминов сохранились тривиальные (упрощенные) названия: С6Н5NH2 – анилин (название по правилам номенклатуры – фениламин).
В некоторых случаях применяют устоявшиеся названия, которые представляют собой искаженные правильные названия: Н2NСН2СН2ОН – моноэтаноламин (правильно – 2-аминоэтанол); (ОНСН2СН2)2NH – диэтаноламин, правильное название – бис(2-гидроксиэтил)амин. Тривиальные, искаженные и систематические (составленные по правилам номенклатуры) названия довольно часто сосуществуют в химии.
По значениям величины молекулярной массы органические вещества делятся на низкомолекулярные и высокомолекулярные.
К низкомолекулярным органическим веществам относятся: спирты, альдегиды, кетоны, карбоновые и другие органические кислоты, углеводороды, аминокислоты, азотистые основания, глицерин, глюкоза, АТФ, витамины и др. Они являются строительными блоками - мономерами, которые ковалентными связями соединяются в макромолекулы, т.е. высокомолекулярные вещества.
К высокомолекулярным органическим веществам относятся: белки, липиды, полисахариды и нуклеиновые кислоты. Белки построены из аминокислот, нуклеиновые кислоты из нуклеотидов, жиры из глицерина и жирных карбоновых кислот, полисахариды из моносахаридов. Нуклеиновые кислоты и белки являются индивидуальными для каждого организма. Они отличаются по составу даже в пределах одного вида. Углеводы и липиды почти одинаковы в самых разнообразных организмах.
Молекулы органических веществ, входящих в состав живых организмов, выполняют разнообразные функции. Рассмотрим основные из них.
1. Структурная, или пластическая. Например, белки и липиды входят в состав мембран органоидов клетки, минеральные соли - составная часть скелета.
2. Энергетическая. Макромолекулы, разрушаясь в организме, служат источником энергии для осуществления различных жизненных процессов, в том числе и для выполнения мышечной работы. Наибольшее энергетическое значение имеют углеводы и липиды.
3. Регуляторная. Она выполняется белками-ферментами, витаминами, а также ионами минеральных веществ и некоторыми промежуточными продуктами обмена веществ.
4. Сократительная. Ее выполняют специфические белки, (например, актин, миозин), которые, взаимодействуя друг с другом, передвигаются в пространстве и вызывают сокращение и расслабление мышц.
5. Транспортная. При участии ряда соединений происходит перенос веществ в организме. Например, белок гемоглобин транспортирует по крови кислород; другие белки связывают и доставляют к органам и тканям витамины, жирные кислоты, гормоны, кальций и т.д.; желчные кислоты, связываясь с жирными карбоновыми кислотами, способствуют их всасыванию из пищеварительного тракта.
6. Защитная. Специфические белки-антитела являются основой гуморального иммунитета; белок фибриноген участвует в процессах свертывания крови.
7. Хранение и передача наследственной информации. Белки и нуклеиновые кислоты непосредственно связаны с наследственностью организма, т.к. участвуют в хранении и передаче генетической информации.
Особую функцию выполняют макроэргические соединения: АТФ, АДФ, ЦТФ, УТФ, ГТФ и др., которые способны накапливать потенциальную энергию химических связей и трансформировать ее в различные виды работы: механическую, осмотическую, тепловую, электрическую.
Большинство органических молекул выполняют в организме не одну, а несколько функций. Например, сократительный белок миозин одновременно является ферментом, ускоряющим расщепление АТФ; аминокислоты используются не только как мономеры в белковых молекулах, но и сами являются биологически активными веществами (гистидин, холин, метионин); мононуклеотиды - мономеры в молекулах нуклеиновых кислот одновременно аккумуляторы энергии в клетке. В этом проявляется принцип молекулярной экономии, свойственный живому.


 - C
|
Н
- C
|
Н