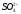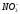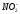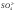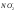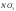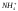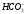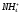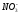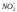- •Гидрогеология и основы геологии
- •Введение
- •Задание 1 Построение гидрогеологического разреза по скважинам
- •В таблице 1 приведены номера скважин и водомерных постов для построения гидрогеологических разрезов по вариантам.
- •Задание 2 Построение схематической геолого-литологической карты
- •Задание 3 Построение карты гидроизигипс
- •Задание 4 Построение карты глубин залегания уровня грунтовых вод (карты гидроизобат)
- •Задание 5 Состав подземных вод
- •Задание 6 Расчет коэффициента фильтрации по результатам опытной откачки. Определение удельного дебита
- •Рекомендуемая литература
Задание 4 Построение карты глубин залегания уровня грунтовых вод (карты гидроизобат)
Снять копию карты (рисунок 1, 2) в соответствии с выполняемым вариантом. Около всех скважин на карту выписать глубины уровня первого от поверхности горизонта грунтовых вод. Эти глубины определяются по разности между абсолютной отметкой устья данной скважины и абсолютной отметкой уровня грунтовых вод в этой скважине.
Для контроля и повышения точности построения линии равных глубин, следует также на эту карту перенести с карты гидроизогипс все точки пересечения горизонталей с гидроизогипсами и около них поставить глубину до воды в метрах (разность между абсолютными отметками горизонтали и гидроизогипсы). Выписав глубины уровня воды по всем скважинам, имеющимся на данной карте, следует дальше интерполировать по всей площади карты между скважинами и указанными выше точками пересечения горизонталей с гидроизогипсами. Найдите с помощью интерполяции точки, где глубина уровня грунтовых вод будет 0,5; 1,0; 2,0; 3,0; 5,0; 10,0 и т.д. через пять метров.
Начинать интерполяцию следует от берегов реки. У самого берега считать глубину равным нулю, по мере удаления от реки она изменяется в основном в зависимости от рельефа. Интерполяцию следует проводить независимо на правобережных и левобережных участках.
Точки с одинаковыми глубинами, полученные при интерполяции, соедините тонкими линиями. Площади между этими линиями (гидроизобатами) закрашиваются в разные цвета (смотри рисунок 8).
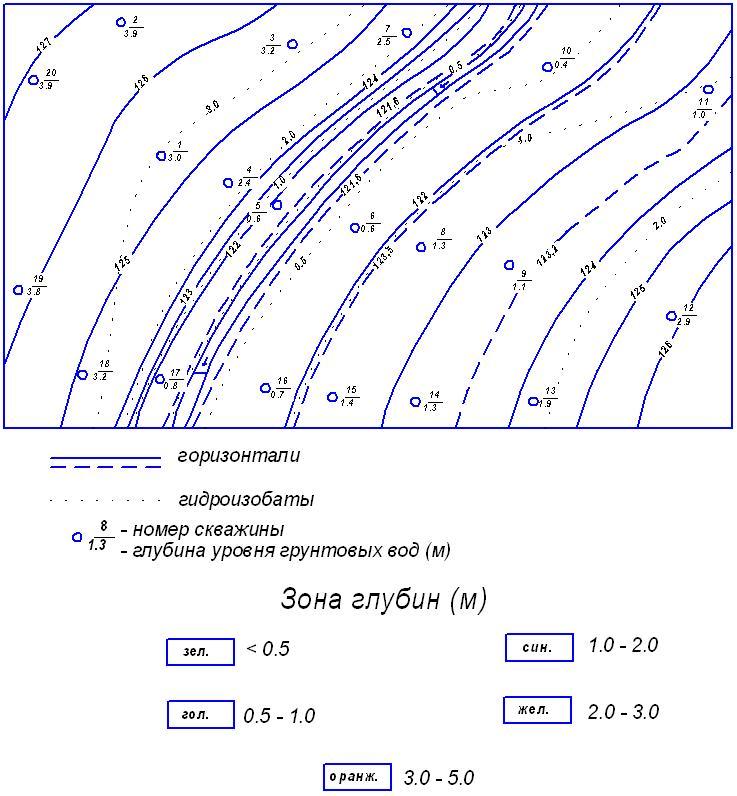
Рисунок 8 – Карта гидроизобат
Задание 5 Состав подземных вод
В таблице 8 приведены результаты сокращенного анализа грунтовых вод. Используя их (в соответствии с номером варианта) выполните следующее:
пересчитайте содержание ионов из мг/л в мг-экв/л и мг-экв%/л;
запишите результаты анализа в виде формулы М.Г.Курлова;
запишите результаты анализа в виде формулы солевого состава;
изобразите результаты анализа на диаграммах-треугольниках и диаграмме-квадрате;
оцените состав воды по общей минерализации, величине рН, химическому составу, жесткости и агрессивности по отношению к бетону.
Запишите данные анализа воды по своему варианту в форме таблицы 9.
Пересчет ионной формы в эквивалентную производится по схеме:
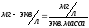 ,
(4)
,
(4)
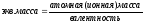
На практике содержание каждого иона в мг/л умножается на пересчетный для каждого иона коэффициент (таблица 7). Коэффициент представляет собой величину, обратную эквивалентной массе данного иона. Результаты пересчетов, содержание каждого иона в мг-экв/л суммируется отдельно для катионов и анионов. Эти суммы должны быть близки друг другу.
Таблица 7 – Коэффициенты для пересчета из ионной формы (мг/л) в эквивалентную (мг-экв/л)
|
Ионы |
Коэффициенты |
Ионы |
Коэффициенты |
|
Ca2+ |
0,0499 |
|
0,0164 |
|
Mg2+ |
0,0822 |
|
0,0208 |
|
Na++K+ |
0,0434 |
Cl- |
0,0282 |
|
K+ |
0,0256 |
|
0,0161 |
|
|
0,05543 |
|
0,02174 |
Для получения мг-экв%/л, принимают раздельно сумму анионов и сумму катионов за 100%. Затем рассчитывается количество процентов, приходящихся на каждый анион и каждый катион в соответствии с их содержанием в мг-экв/л по формуле:
для анионов
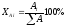 ;
(5)
;
(5)для катионов
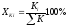 ,
(6)
,
(6)
где ΣА и ΣК – суммы мг-экв/л анионов и катионов соответственно.
Правильность проведенного анализа контролируется величиной погрешности анализа в %:
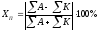 (7)
(7)
Погрешность, в зависимости от категории анализа допускается от 2 до 5 процентов.
Таблица 8 – Состав подземных вод
|
№ варианта |
Сухой остаток мг/л |
Содержание ионов, мг/л |
рH |
Свободная, CO2, мг/л |
Жесткость мг∙экв/л | ||||||||||||
|
Cl- |
|
|
|
|
Na++K+ |
Mg2+ |
Ca2+ |
|
|
|
общая |
устранимая | |||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 | |||
|
1 |
632,0 |
3,7 |
309,4 |
61,0 |
0,01 |
5,5 |
63,2 |
- |
97,4 |
- |
6,5 |
4,4 |
4,84 |
1,00 | |||
|
2 |
4056 |
414,1 |
2279,7 |
73,2 |
- |
5,5 |
49,7 |
170,1 |
503,8 |
- |
6,4 |
17,6 |
39,14 |
1,20 | |||
|
3 |
170,0 |
4,9 |
16,5 |
128,1 |
- |
5,5 |
17,2 |
10,4 |
21,0 |
0,2 |
6,8 |
19,8 |
2,10 |
2,10 | |||
|
4 |
336,0 |
12,3 |
46,5 |
12,2 |
- |
- |
5,1 |
5,2 |
255,5 |
- |
5,9 |
3,8 |
13,10 |
0,20 | |||
|
5 |
337,0 |
774,0 |
1400,7 |
140,3 |
- |
- |
724,6 |
162,5 |
168,7 |
- |
6,8 |
20,8 |
21,77 |
2,30 | |||
|
6 |
421,4 |
24,1 |
49,4 |
231,8 |
- |
- |
95,2 |
9,9 |
10,2 |
- |
7,3 |
30,6 |
3,80 |
3,80 | |||
|
7 |
1130 |
501,0 |
54,0 |
165,0 |
- |
- |
333,0 |
33,0 |
38,0 |
- |
7,3 |
18,4 |
4,60 |
2,70 | |||
|
8 |
2353 |
810,0 |
800,0 |
866,0 |
- |
- |
560,0 |
52,0 |
52,0 |
- |
8,1 |
10,0 |
6,86 |
6,86 | |||
|
9 |
246,0 |
82,1 |
28,0 |
219,6 |
- |
4,2 |
13,8 |
6,9 |
62,9 |
- |
6,4 |
30,8 |
3,71 |
3,60 | |||
|
10 |
164,0 |
6,0 |
36,2 |
115,9 |
- |
5,6 |
33,1 |
8,6 |
15,2 |
- |
6,8 |
40,0 |
1,90 |
1,90 | |||
|
11 |
320,0 |
15,9 |
74,1 |
195,2 |
- |
6,9 |
47,6 |
13,2 |
42,9 |
- |
7,2 |
13,2 |
3,23 |
3,20 | |||
|
12 |
453,0 |
23,1 |
3,3 |
323,3 |
- |
- |
16,0 |
31,2 |
49,7 |
- |
7,3 |
16,5 |
5,02 |
5,02 | |||
|
13 |
395,0 |
96,0 |
38,0 |
146,0 |
- |
- |
71,0 |
18,0 |
26,0 |
- |
7,0 |
20,4 |
2,77 |
2,39 | |||
|
14 |
500,3 |
14,2 |
70,4 |
286,8 |
- |
- |
66,0 |
26,8 |
36,1 |
- |
8,4 |
30,2 |
4,70 |
4,70 | |||
|
15 |
186,0 |
6,4 |
8,0 |
97,6 |
- |
- |
10,1 |
9,7 |
14,0 |
- |
7,4 |
17,8 |
1,49 |
1,49 | |||
|
16 |
536,9 |
14,5 |
27,9 |
366,6 |
- |
- |
7,4 |
36,5 |
76,0 |
- |
7,8 |
21,7 |
6,79 |
6,79 | |||
|
17 |
440,6 |
16,0 |
0,6 |
213,5 |
- |
- |
19,3 |
20,1 |
70,1 |
- |
7,6 |
25,4 |
5,15 |
3,50 | |||
|
18 |
242,0 |
8,2 |
12,8 |
152,5 |
- |
- |
6,4 |
9,2 |
41,0 |
- |
7,1 |
15,2 |
2,79 |
2,50 | |||
|
19 |
279,0 |
3,9 |
28,0 |
231,8 |
- |
4,2 |
23,7 |
5,8 |
61,1 |
- |
7,0 |
30,8 |
3,53 |
3,53 | |||
|
20 |
390,0 |
95,0 |
38,0 |
146,0 |
- |
- |
71,0 |
19,0 |
26,0 |
- |
6,0 |
20,4 |
2,70 |
2,30 | |||
Таблица 9 – Пример пересчета и записи химического состава грунтовых вод
|
Сухой остаток, мг/л |
Катионы |
Анионы |
рН |
Свободная CO2, мг/л |
Жесткость мг∙экв/л | ||||||||||||||||||||||
|
|
мг/л |
мг-экв/л |
мг-экв%/л |
|
мг/л |
мг-экв/л |
мг-экв%/л |
|
|
общая |
устранимая | ||||||||||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 | |||||||||||||||
|
190 |
Na++K+ |
20,5 |
0,89 |
29,87 |
Cl- |
9,9 |
0,28 |
9,40 |
6,32 |
13,2 |
2,01 |
0,70 | |||||||||||||||
|
Mg2+ |
8,3 |
0,68 |
22,81 |
|
93,0 |
1,94 |
65,1 | ||||||||||||||||||||
|
Ca2+ |
28,3 |
1,41 |
47,32 |
|
42,7 |
0,70 |
23,49 | ||||||||||||||||||||
|
|
- |
- |
- |
|
3,8 |
0,06 |
2,01 | ||||||||||||||||||||
|
|
- |
- |
- | ||||||||||||||||||||||||
|
Итого |
51,7 |
2,98 |
100 |
|
149,4 |
2,98 |
100 | ||||||||||||||||||||
Формула М.Г.Курлова представляет собой псевдодробь, в числителе которой в убывающем порядке записывается эквивалентное или эквивалентпроцентное содержание анионов, в знаменателе – катионов. Записываются только ионы, содержание которых равно или больше 10 мг-экв%/л. Перед дробной линией (слева) ставится буква «М», а рядом внизу в виде индекса записывается величина общей минерализации (сухой остаток) в г/л. Левее буквы «М» записываются в мг/л газы и специфические компоненты (Sp). Справа от дробной черты записываются показатели Еh, рН, Т(0С). Здесь же, иногда записывают плотность (для минерализованных вод) и дебит скважины или источника D в м3/сутки:
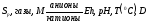 (8)
(8)
Формула М.Г.Курлова составленная на основании данных таблицы 8:
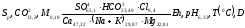
В формуле солевого состава независимо от содержания записываются в убывающем порядке все анионы и все катионы (мг-экв/л или мг-экв%/л), минерализация (г/л), газы и специфические компоненты (мг/л):
 ,
(9)
,
(9)
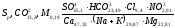
По формулам дается название воды для ионов, превышающих 25 мг-экв%/л. Состав воды называется в возрастающем порядке: сначала по анионам, затем по катионам. Главным ионам в названии соответствуют полные прилагательные (например, хлорная), второстепенные краткие (гидрокарбонатно-сульфатно).
При большом количестве анализов, для наглядности и выделения распространения по площади и глубине различных типов воды, используются диаграммы – квадрат и треугольники.
На
диаграмме-квадрате Толстихина учитываются
основные анионы и катионы (рисунок 9).
Весь квадрат вертикальными и горизонтальными
линиями через 10 процентов шкал, разделен
на 100 маленьких квадратов, по номеру
которых определяется тип воды. Анализ
изображается на диаграмме-квадрате в
виде точки. Эта точка находится на
пересечении двух прямых линий –
вертикальной, положение которой в
квадрате определяется содержанием
катионов, и горизонтальной, определяемой
по содержанию анионов.
|
10 |
|
|
|
|
|
|
|
|
1 |
|
20 |
|
|
|
|
|
|
|
|
11 |
|
30 |
|
|
|
|
|
|
|
|
21 |
|
40 |
|
|
|
|
|
|
|
|
31 |
|
50 |
|
|
|
|
|
|
|
|
41 |
|
60 |
|
|
|
|
|
|
|
|
51 |
|
70 |
|
|
|
|
|
|
|
|
61 |
|
80 |
|
|
|
|
|
|
|
|
71 |
|
90 |
|
|
|
|
|
|
|
|
81 |
|
100 |
|
|
|
|
|
|
|
|
91 |
Рисунок 9 – Диаграмма-квадрат Толстихина
Диаграмма-треугольник Ферре используется часто одновременно с диаграммой-квадратом. Строятся два равносторонних треугольника одинакового размера в том же масштабе, что и квадрат. Один треугольник – для катионов, другой – для анионов.
На каждой из сторон треугольников сделайте шкалы в мг-экв%/л от 0 до 100% по часовой стрелке. В углах треугольника будет начало шкалы одного иона (0%) и окончание шкалы предыдущего против часовой стрелки иона (100%).
Распределите анионы и катионы в соответствующих треугольниках так, как показано на рисунке 10. В каждом треугольнике показан в виде точек анализ состава воды. Эти точки внутри каждого треугольника находятся на пересечении трех прямых линий параллельных сторонам треугольника. Эти линии должны начинаться на сторонах треугольника в точках, которые соответствуют процентному содержанию иона, изображенного на данной стороне треугольника.
Соедините середины сторон в каждом треугольнике прямыми линиями. При этом получим четыре равносторонних треугольника внутри данного. По расположению точек (анализов) внутри треугольников можно судить о распространении видов воды по катионному и анионному составу раздельно. В средний треугольник попадут точки для смешанных по составу катионов или анионов вод. В треугольниках, прилегающих к углам основного (большого) треугольника, будут места (точки) для гидрокарбонатных, сульфатных или хлоридных вод по анионам, и кальциевых, магниевых и натриевых вод по катионам (рисунок 10).
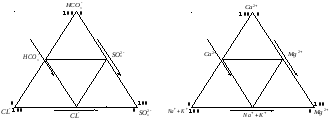
Рисунок 10 – Диаграмма-треугольник
Закончите работу оценкой состава воды по следующим по показателям:
Общая минерализация (сухой остаток), таблица 10.
Таблица 10 – Классификация природных вод по минерализации
|
Вода |
ГОСТ 17403, г/л |
По Вернадскому В.И., г/л |
|
Ультрапресная |
- |
<2 |
|
Пресная |
<1 |
0,2-1 |
|
Солоноватая |
1-25 |
Слабо 1-3 |
|
Солоноватая |
1-25 |
Сильно 3-10 |
|
Соленая |
25-50 |
10-35 |
|
Рассол |
>50 |
>35 |
Общая жесткость, таблица 11.
Жесткость воды – это свойство, которое ей придают присутствующие в ней ионы Са2+, Мg2+, Fе2+ и некоторые другие катионы. Количественно общая жесткость оценивается по сумме содержания названных ионов в мг-экв/л.
При кипячении часть ионов Са2+, Мg2+ соединяется с равным им (в эквивалентной форме) количеством иона НСО3, в результате чего образуется накипь. Эта часть ионов Са2+, Мg2+ называется устранимой жесткостью.
Таблица 11 - Классификация природных вод по общей жесткости
|
Вода |
Общая жесткость, мг-экв/л |
|
Очень мягкая |
<1,5 |
|
Мягкая |
1,5-3,0 |
|
Умеренно жесткая |
3,0-6,0 |
|
Жесткая |
6,0-9,0 |
|
Очень жесткая |
>9,0 |
По концентрации ионов водорода, таблица 12.
Таблица 12 – Классификация природных вод по рН
|
Вода |
рН |
|
Сильно кислая |
<1,9 |
|
Кислая |
1,9-4,0 |
|
Слабокислая |
4,0-7,0 |
|
Нейтральная |
7,0 |
|
Слабощелочная |
7,0-8,3 |
|
Щелочная |
8,3-10,3 |
|
Сильно щелочная |
>10,3 |
Класс (по треугольнику Ферре).
Группа (по треугольнику Ферре).
Агрессивность подземных вод.
Это свойство зависит химического и газового состава воды, скорости течения воды, температуры воды, материала подземных сооружений.
Оцените качественно (да, нет) агрессивность воды по отношению к бетону и портландцементу, например, для случая хорошо водопроницаемых пород (таблица 13).
- общая агрессивность рН=6,32 – да;
- углекислая агрессивность (свободная СО2=13,2 мг/л) – да;
- сульфатная агрессивность (SO42-=93,0 мг/л) – нет;
- магнезиальная агрессивность (Mg2+=8,3 мг/л) – нет.
Таблица 13 - Признаки агрессивности подземных вод
|
Виды и показатели агрессивности |
Грунты водопроницаемые (крупнообломочные, среднеобломочные) |
Результат проявления агрессивности |
|
Бетон, железобетон и бутобетон, портландцемент | ||
|
Условие агрессивности воды | ||
|
Общекислотная (pH) Выщелачивающая – (временная жесткость в мг-экв/л) |
pH меньше 7,0 Временная жесткость меньше 1,03 мг-экв/л |
Частичное растворение бетона |
|
Сульфатная – (SO4 в мг/л) |
Содержание SO42- больше 250 мг/л |
Образование новых солей в трещинах и порах бетона. Механическое разрушение бетона |
|
Магнезиальная – (Mg2+ в мг/л) |
Содержание иона магния больше 2000 мг/л |
Образование Mg(OH)2, понижение прочности бетона |
|
Углекислая – (содержание свободной CO2 в мг/л) |
Содержание свободной CO2 (мг/л) больше [a∙Ca2++b] (мг/л) |
Растворение части бетона |
Таблица 14 – Значение коэффициентов «а» и «b»
|
Временная жесткость, мг-экв/л |
Суммарное содержание ионов SO42+Cl- , мг/л | ||||||||||||||
|
0-200 |
201-400 |
401-600 |
601-800 |
801-1000 |
>1000 | ||||||||||
|
а |
b |
а |
b |
а |
b |
а |
b |
а |
b |
а |
b | ||||
|
1,4 |
0,01 |
16 |
0,01 |
17 |
0 |
17 |
0 |
17 |
0 |
17 |
0 |
17 | |||
|
1,8 |
0,04 |
17 |
0,04 |
18 |
0,03 |
18 |
0,02 |
18 |
0,02 |
18 |
0,02 |
18 | |||
|
2,1 |
0,07 |
19 |
0,08 |
19 |
0,05 |
18 |
0,04 |
18 |
0,04 |
18 |
0,04 |
18 | |||
|
2,5 |
0,10 |
21 |
0,08 |
20 |
0,07 |
19 |
0,06 |
18 |
0,06 |
18 |
0,06 |
18 | |||
|
2,9 |
0,13 |
23 |
0,11 |
21 |
0,09 |
19 |
0,08 |
18 |
0,07 |
18 |
0,07 |
18 | |||
|
3,2 |
0,16 |
25 |
0,14 |
22 |
0,11 |
20 |
0,01 |
19 |
0,09 |
18 |
0,08 |
18 | |||
|
3,6 |
0,20 |
27 |
0,17 |
23 |
0,14 |
21 |
0,12 |
19 |
0,11 |
18 |
0,10 |
18 | |||
|
4,2 |
0,24 |
29 |
0,20 |
24 |
0,16 |
22 |
0,15 |
20 |
0,13 |
19 |
0,12 |
19 | |||
|
4,3 |
0,28 |
32 |
0,24 |
26 |
0,19 |
23 |
0,17 |
21 |
0,16 |
20 |
0,14 |
20 | |||
|
4,6 |
0,32 |
34 |
0,28 |
27 |
0,22 |
24 |
0,20 |
22 |
0,19 |
21 |
0,17 |
21 | |||
|
5,0 |
0,36 |
36 |
0,32 |
29 |
0,25 |
26 |
0,23 |
23 |
0,22 |
22 |
0,19 |
22 | |||
|
5,4 |
0,40 |
38 |
0,36 |
30 |
0,29 |
27 |
0,26 |
24 |
0,24 |
23 |
0,22 |
23 | |||
|
5,7 |
0,44 |
41 |
0,40 |
32 |
0,32 |
28 |
0,29 |
25 |
0,27 |
24 |
0,25 |
24 | |||
|
6,1 |
0,48 |
43 |
0,44 |
34 |
0,36 |
30 |
0,33 |
26 |
0,30 |
25 |
0,28 |
25 | |||
|
6,4 |
0,54 |
46 |
0,47 |
37 |
0,40 |
32 |
0,36 |
28 |
0,33 |
27 |
0,31 |
27 | |||
|
6,8 |
0,61 |
48 |
0,51 |
39 |
0,44 |
33 |
0,40 |
30 |
0,37 |
29 |
0,34 |
28 | |||
|
7,1 |
0,67 |
51 |
0,55 |
41 |
0,48 |
35 |
0,44 |
31 |
0,41 |
30 |
0,38 |
29 | |||