
Классификация ферментов
Круг вопросов, изучаемых ферментологией, широк. Количество ферментов, применяемых в здравоохранении, сельском хозяйстве, микробиологии и других отраслях науки и практики, велико. Это создавало трудность при характеристике ферментативных реакций, так как один и тот же фермент можно назвать или по субстрату, или по типу катализируемых реакций, или старым термином, прочно вошедшим в литературу: например пепсин, трипсин, каталаза.

Рис. 5. Предполагаемая структура мультиферментного комплекса, синтезирующего жирные кислоты (семь ферментных субъединиц отвечают за семь химических реакций).
Поэтому в 1961 г. Международный биохимический съезд в Москве утвердил классификацию ферментов, в основу которой положен тип реакции, катализируемой данным ферментом. В названии фермента обязательно присутствует название субстрата, т. е. того соединения, на которое воздействует данный фермент, и окончание -аза. Например, аргиназа катализирует гидролиз аргинина.
По этому принципу все ферменты были разделены на шесть классов.
1. Оксидоредуктазы—ферменты, катализирующие окислительно-восстановительные реакции, например каталаза:
![]()
2. Трансферазы — ферменты, катализирующие перенос атомов или радикалов, например метилтрансферазы, переносящие СНз-группу:
![]()
3. Гидролазы — ферменты, разрывающие внутримолекулярные связи путем присоединения молекул воды, например фосфатаза:
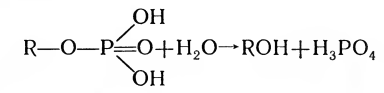
4. Лиазы — ферменты, отщепляющие от субстрата ту или иную группу без присоединения воды, негидролитическим путем, например отщепление карбоксильной группы декарбоксилазой:
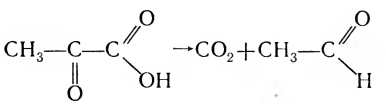
5. Изомеразы — ферменты, катализирующие превращение одного изомера в другой:
Глюкозо-6-фосфат—›глюкозо-1-фосфат
6. Ферменты, катализирующие реакции синтеза, например синтез пептидов из аминокислот. Этот класс ферментов носит название синтетаз.
Каждый фермент предложили закодировать шифром из четырех цифр, где первая из них обозначает номер класса, а остальные три характеризуют более подробно свойства фермента, его подкласс и индивидуальный номер в каталоге.
В качестве примера классификации ферментов приведем четырехзначный код, присвоенный пепсину,— 3.4.4Л. Цифра 3 обозначает класс фермента — гидролазы. Следующая цифра 4 кодирует подкласс пептидгидролаз, т. е. тех ферментов, которые гидролизуют именно пептидные связи. Еще одна цифра 4 обозначает под-подкласс, называемый пептидилпептидгидролазами. В этот подподкласс входят уже индивидуальные ферменты, и первым в нем значится пепсин, которому и присвоен порядковый номер 1.
Так получается его код — 3.4.4.1. Точки приложения действия ферментов класса гидролаз показаны на рисунке 6.
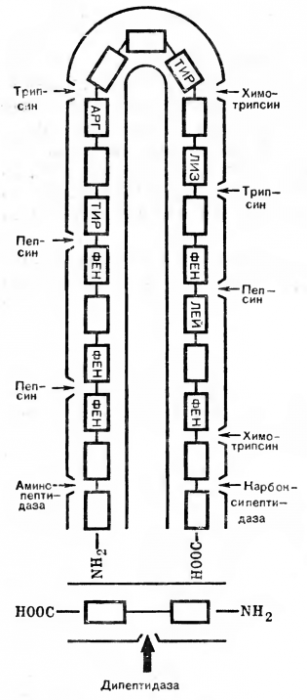
Рис. 6. Расщепление пептидных связей различными протеолитнческими ферментами.
Действие ферментов
Обычно ферменты выделяют из различных объектов животного, растительного или микробного происхождения и изучают их действие вне клетки и организма. Эти исследования очень важны для понимания механизма действия ферментов, изучения их состава, особенностей катализируемых ими реакций. Но полученные таким образом сведения нельзя механически непосредственно переносить на деятельность ферментов в живой клетке. Вне клетки трудно воспроизвести те условия, в которых работает фермент, например в митохондрии или лизосоме. К тому же не всегда известно, сколько из имеющихся молекул фермента участвует в реакции — все или только какая-то их часть.
Почти всегда оказывается, что клетка содержит тот или иной фермент, по содержанию превышающий в несколько десятков раз необходимое количество для осуществления нормального обмена веществ. Обмен веществ различен по интенсивности в разные периоды жизни клетки, однако ферментов в ней значительно больше, чем того требовал бы самый максимальный уровень обмена веществ. Например, в состав клеток сердечной мышцы входит столько цитохрома с, которое могло бы осуществить окисление, в 20 раз большее, чем максимальное потребление кислорода сердечной мышцей. Позднее были обнаружены вещества, которые могут «выключать» часть молекул ферментов. Это так называемые тормозящие факторы. Для понимания механизма действия ферментов важно и то, что в клетке они находятся не просто в растворе, а встроены в структуру клетки. Сейчас уже известно, какие ферменты вмонтированы в наружную мембрану митохондрии, какие встроены во внутреннюю, какие связаны с ядром, лизосомами и другими субклеточными структурами.
Близкое «территориальное» расположение фермента, катализирующего первую реакцию, к ферментам, катализирующим вторую, третью и последующие реакции, сильно влияет на суммарный результат их действия. Например, в митохондрии вмонтирована цепь ферментов, передающих электроны на кислород,— цитохромная система. Она катализирует окисление субстратов с образованием энергии, которая аккумулируется в АТФ.
При извлечении ферментов из клетки слаженность их совместной работы нарушается. Поэтому изучать работу ферментов стараются без разрушения тех структур, в которые встроены их молекулы. Например, если срез ткани подержать в растворе субстрата, а затем обработать реактивом, который с продуктами реакции даст окрашенный комплекс, то в микроскопе будут четко видны окрашенные участки клетки: в этих участках был локализован (расположен) фермент, который расщеплял субстрат. Так было установлено, в каких именно клетках желудка содержится пепсиноген, из которого получается фермент пепсин.
Сейчас широко распространен другой метод, который позволяет установить локализацию ферментов,— разделительное центрифугирование. Для этого исследуемую ткань (например, кусочки печени лабораторных животных) измельчают, а затем готовят из нее кашицу в растворе сахарозы. Смесь переносят в пробирки и вращают их с большими скоростями в центрифугах. Различные клеточные элементы в зависимости от их массы и размеров распределяются в плотном растворе сахарозы при вращении примерно следующим образом:

Для получения тяжелых ядер требуется относительно небольшое ускорение (меньшее число оборотов). После отделения ядер, увеличив число оборотов, последовательно осаждают митохондрии, микросомы, получают цитоплазму. Теперь активность ферментов можно изучать в каждой из выделенных фракций. Оказывается, что большинство из известных ферментов локализованы преимущественно в той или иной фракции. Например, фермент альдолаза локализован в цитоплазме, а фермент, окисляющий капроновую кислоту,— преимущественно в митохондриях.
При повреждении мембраны, в которую встроены ферменты, комплексные взаимосвязанные процессы не протекают, т. е. каждый фермент может действовать только сам по себе.
Клетки растений и микроорганизмов, как и клетки животных, содержат очень похожие клеточные фракции. Например, пластиды растений по ферментному набору напоминают митохондрии. В микроорганизмах обнаружены зерна, напоминающие рибосомы и тоже содержащие большие количества рибонуклеиновой кислоты. Ферменты, входящие в состав животных, растительных и микробных клеток, обладают сходным действием. Например, гиалуронидаза облегчает микробам проникновение в организм, способствуя разрушению клеточной стенки. Этот же фермент обнаружен в различных тканях животных организмов.
