
Газовые электроды
Состоят из инертного
металла, который находится в одновременном
контакте с газом и раствором, содержащем
ионы этого газа Например, в водородном
электроде
платиновая пластинка, покрытая слоем
мелкодисперсной платины - "платиновой
черни" для обеспечения достаточной
площади поверхности контакта, погружена
в раствор, содержащий ионы водорода. К
пластинке подводится газообразный
водород, постоянно обтекающий ее
поверхность. Если активность ионов
водорода в растворе равна 1 и давление
газообразного водорода 1 атм, то электрод
называется стандартным
водородным электродом.
Схема водородного электрода Н+![]() Н2,Pt,
протекающая реакция:
Н2,Pt,
протекающая реакция:
2Н+ + 2е =Н2
и электродный потенциал
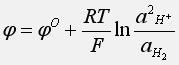
Учитывая, что стандартный потенциал водородного электрода равен нулю, и приняв активность газа за его давление получим:
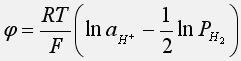
В частности, при давлении водорода, равном 1 атм:

|
Металлы, расположенные в порядке возрастания их стандартных электродных потенциалов, образуют так называемый электрохимический ряд напряжений металлов Li, Rb, К, Ва, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, H, Sb, Bi, Cu, Hg, Ag, Pd, Pt, Au Если вспомнить, что происходило в нашем гальваническом элементе, то легко понять, почему расположение металлов в этом ряду предсказывает их свойства: 1) Каждый металл может вытеснять (восстанавливать) из растворов их солей те металлы, которые стоят в ряду напряжений после него. 2) Все металлы, имеющие отрицательный электродный потенциал (то есть стоящие в ряду напряжений до водорода), могут вытеснять (восстанавливать) его из растворов кислот.
|
Потенциометрический метод анализа основан на использовании зависимости электрического сигнала (потенциала) специального датчика, называемого измерительным электродом, от состава анализируемого раствора. В идеальном случае измерительный электрод избирательно (селективно) реагирует на определенный ион (или группу ионов), а его потенциал зависит от содержания этих ионов в растворе и подчиняется уравнению Нернста. E=E0 + S lg a где: а - активность анализируемых ионов в растворе S - крутизна электродной функции (2.3 RT/nF) Измерительные электроды обычно подразделяют на две группы: рН-электроды. т.е. электроды селективные к иону водорода и электроды селективные к прочим ионам, которые называют ионоселективными электродами. Абсолютную величину потенциала в настоящее время измерить невозможно, однако можно измерить потенциал относительно другого электрода, потенциал которого не зависит от состава раствора и условно принимается равным нулю. Такой электрод называется электродом сравнения. Таким образом, измерения всегда проводятся при помощи двух электродов: измерительного и электрода сравнения (электродная пара). Датчик, объединяющий в одном корпусе измерительный электрод и электрод сравнения, называется комбинированным электродом.
- Прямая потенциометрия. Метод основан на установлении зависимости потенциала измерительного электрода от концентрации раствора (построение калибровочного графика или настройка измерительного прибора) и последующим ее использовании для анализа растворов неизвестной концентрации. Метод достаточно прост и экспрессен. Наиболее широко применяется для измерения рН. Точность метода зависит, в первую очередь, от типа измерительного электрода. Так для рН-электродов достижима точность 0,01 рН и выше, а для ионоселективных электродов принято оценивать погрешность величиной 4% для однозарядных ионов и 8% для двухзарядных. - Потенциометрическое титрование. Метод существует во множестве вариантов. Он основан на проведении специфической химической реакции под контролем ионоселективного или редокс-электрода. Могут применяться следующие реакции: нейтрализации, осаждения, комплексообразования или окисления-восстановления. Калибровка электрода обычно не требуется, он служит только для установления точки эквивалентности. Расчет концентрации анализируемого вещества производится на основании объемов и концентраций, участвующих в реакции растворов. Стеклянные ионоселективные электроды из всех обладают наилучшими эксплуатационными характеристиками. Применение стеклянных электродов невозможно в растворах, содержащих плавиковую кислоту или ее соли. ] Свойства стеклянного электрода и состав стёкол

![]()
Схема типичного стеклянного электрода
Мембранная или диффузионная теория

![]()
Стеклянный (справа) и хлорсеребряный электроды pH-метра
В этой теории гальванический элемент со СЭ рассматривается как элемент, в котором растворы разделены пористой стеклянной полупроницаемой мембраной, то есть такой, в порах которой могут свободно передвигаться только ионы одного знака. Cтеклянная мембрана (так же, как и некоторые другие полупроницаемые мембраны) изменяет лишь диффузионный потенциал, который возникает между растворами в отсутствии мембран. Диффузионный потенциал между растворами изменяется благодаря избирательной проницаемости пор мембраны для ионов электролитов.
Из общей теории известно, что диффузионный потенциал определяется активностью в растворе тех ионов, которыми переносится ток через границу раздела между этими растворами. Известно, что стекло заряжено отрицательно по отношению к раствору. установлено, что тонкопористые мембраны, несущие отрицательный заряд, преимущественно проницаемы для катионов. На этом основании предполагалось, что в порах стеклянной мембраны могут свободно передвигаться только катионы.
В этих работах предполагается, что во взаимодействие с растворами вступают лишь поверхностные слои стекла, а в толще мембраны стекло остаётся неизменным. Электрический ток внутри мембраны переносится ионами самого стекла.
В поверхностные слои стекла могут проникать из водных растворов молекулы воды. Вода диссоциирует в поверхностных слоях стекла на ионы водорода и гидроксила. Благодаря этому возникает постоянство концентрации ионов водорода в слоях. На основе высказанного предположения получила объяснение водородная функция СЭ.
Так, если в обычном газовом водородном электроде постоянство активности ионов водорода на поверхности платины обеспечивается адсорбированным платиной водородом под определённым давлением, то в СЭ это постоянство обусловлено диссоциацией молекул воды в поверхностных слоях стекла.
F-селективный электрод является одним из самых высокоселективных электродов - единственным мешающим ионом является ион ОН-, поэтому измерения рекомендуется проводить при рН 5,5...6,5. Материал чувствительной мембраны - монокристалл LaF3 обладает высокой химической стойкостью и долговечностью, что обеспечивает значительный ресурс работы электрода. Зачистка рабочей поверхности электрода абразивными материалами не допускается. CI-, Br-, I-селективные электроды выполнены по стандартной технологии. Материалом мембраны является прессованный порошок Ag2S с добавлением соответствующего галогенида серебра. Нижний предел диапазона измерения определяется растворимостью материала мембраны. Например, произведение растворимости AgCI равно 1,8x10-10, следовательно, в приэлектродном слое концентрация ионов Сl- составляет величину ПР=1,Зх10-5 моль/л, это и есть естественный предел обнаружения. Мешающим действием обладают все ионы, которые могут взаимодействовать с материалом мембраны с образованием менее растворимых солей, в частности это ионы Hg2+ и S2-. Селективность электродов возрастает в ряду CI-Br-I. Так для хлорид-селективного электрода Br- и I- являются мешающими ионами, а для определения йода при помощи соответствующего электрода ионы Cl- и Br- не мешают. Для Ag-селективного электрода материалом мембраны служит прессованный порошок Ag2S. Мешающий ион Hg2+.
К-селективный электрод. При определении К+ должен применяться двухключевой электрод сравнения, заправленный раствором NH4NO3 или NH4Cl вместо KCl. NO3-селективный электрод. Измерение нитратов достаточно широко применяется в аналитической практике для анализа сельскохозяйственной продукции, природных вод и почв при экологическом мониторинге. Ca-, NH4-селективные электроды не имеют каких-либо особенностей при эксплуатации. Для комфортной работы с ионоселективными электродами, особенно при прямой потенциометрии, в качестве измерительного прибора нужен иономер. Конечно, может применяться и рН-метр с милливольтовой шкалой.


