
- •Основные законы химии
- •Строение атома.
- •Химическая связь. Строение молекул.
- •Элементы химической термодинамики.
- •1 Порядок
- •2 Порядок
- •Химическое равновесие и закон действующих масс.
- •Растворы
- •Осмотическое давление.
- •Индикаторы
- •Гидролиз
- •Взаимно-усиливающий гидролиз
- •Окислительно-восстановительные реакции.
Химическое равновесие и закон действующих масс.
Если в результате химической реакции расходуется полностью хотя бы одно из реагирующих веществ, то реакция необратимая.
Наступление равновесия свидетельствует о том, что процесс протекает с одинаковой скоростью в обоих направлениях (динамическое равновесие).
Закон Д.М. для состояния равновесия: Отношение произведения Д.М. продуктов реакции к произведению Д.М. исходных веществ с учетом стехиохимических коэффициентов есть величина постоянная при данной Т и называется константой равновесия.
В случае гетерогенных реакций, в уравнение закона Д.М. входят только вещества, находящиеся в газо - или парообразном состоянии.
Растворы
Если привести в соприкосновение 2 или более веществ, то возможны следующие варианты процессов: 1) Химические; 2) Физические; 3) Физико-химические.
Образование растворов – физико-химический процесс. Растворы бывают: газовые, жидкие, твердые (по агрегатному состоянию).
В растворах различают растворитель и растворяемое вещество. Если вещества находятся в разных агрегатных состояниях, то растворитель – вещество, находящееся в одной фазе с полученным раствором. Если вещества находятся в одинаковых агрегатных состояниях, то растворитель то вещество, которого больше.
Электролиты – растворяемые вещества.
Характеристика растворов – концентрация. а) Разбавленный; б) Концентрированный (содержание р-ля и растворяемого в-ва сопоставимо).
Способы выражения концентрации растворов.
Концентрация – содержание растворяемого вещества, выраженное в единицах массы или количества, приходящиеся на единице массы или объема раствора или растворителя.
Массовая доля.
 - количество единиц массы растворенного
вещества, содержащиеся в 100 единицах
массы раствора.
- количество единиц массы растворенного
вещества, содержащиеся в 100 единицах
массы раствора.Молярная концентрация.
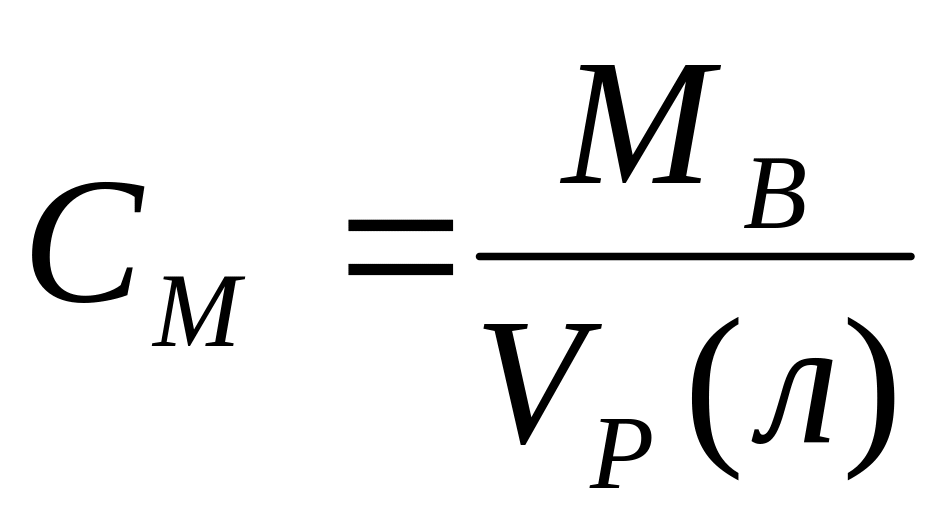 [Моль/литр] – количество моль растворенного
вещества, содержащиеся в 1л раствора.
0.1М –децимолярный раствор, 0.2М –
двухдецимолярный раствора, 0.01 –
сантимолярный раствор, 0.001 – миллимолярный
раствор.
[Моль/литр] – количество моль растворенного
вещества, содержащиеся в 1л раствора.
0.1М –децимолярный раствор, 0.2М –
двухдецимолярный раствора, 0.01 –
сантимолярный раствор, 0.001 – миллимолярный
раствор.Нормальная концентрация или нормальность.
 [моль экв/литр] Нормальность – количество
моль эквивалентов растворенного
вещества, содержащиеся в 1л раствора.
[моль экв/литр] Нормальность – количество
моль эквивалентов растворенного
вещества, содержащиеся в 1л раствора.Молярная концентрация, молярность.
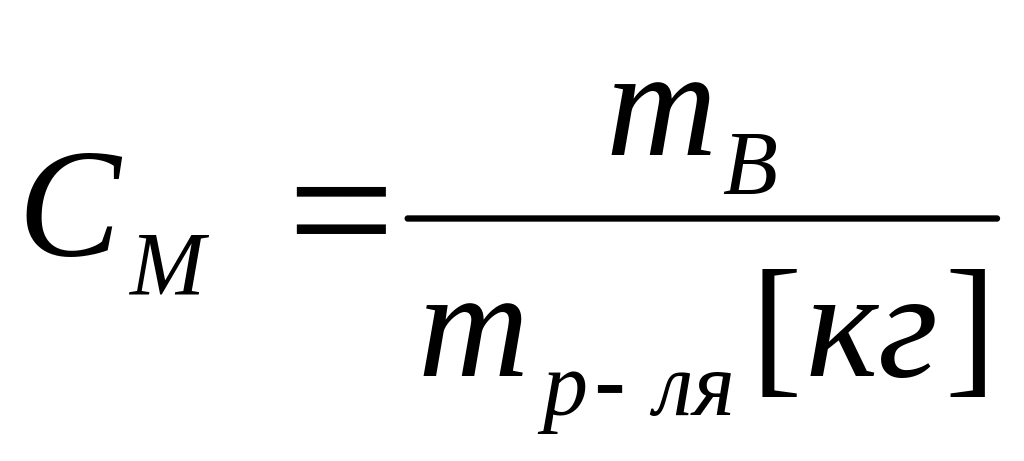 .
.
 Молярность – количество
моль раствора вещества, содержащееся
в 1 кг растворителя.
Молярность – количество
моль раствора вещества, содержащееся
в 1 кг растворителя.Массовая доля.
 .
.
 .
Молярная доля – отношение количества
моль растворенного вещества к сумме
моль всех веществ, составляющих раствор.
.
Молярная доля – отношение количества
моль растворенного вещества к сумме
моль всех веществ, составляющих раствор.
 [г/л]
[г/л]
Использование нормальных С позволяет рассчитывать V растворов, которые, будучи смешанными, провзаимодействуют без остатка.
Растворимость
Растворимость 1 в 2 обусловлено процессом диффузии, т.е. распределением молекул растворенного вещества в среде молекул растворителя. При этом энтропия системы растет, а энергия Гиббса уменьшается.
При достижении состояния равновесия
![]() .
.
Растворимость (S) – С
насыщенного раствора.
![]() .
.
Перенасыщенные растворы – растворы, в
которых содержание растворенного
вещества больше насыщенного растворителя.
Они неустойчивые (![]() )
)
Вещества хорошо растворимы, если С>1г/100г H2O.
Мало растворимы, если
![]()
Нерастворимы, если
![]() .
.
Физико-химическая теория образования раствора (Сванге-Арениус).
Физико-химическая теория свидетельствует о том, что образование раствора – химический процесс. Подтверждение – очень часто компоненты нельзя разделить на составные части.
Процесс растворения сопровождается тепловым эффектом, поэтому Менделеев создал физико-химическую теорию образования растворов, согласно которой все процессы образования раствора находятся в состоянии термодинамического равновесия и подчиняются закону Д.М.
При растворении образуются вещества переменного состава – сольваты и гидраты.
Типы взаимодействия: 1) Дальнего порядка (межмолекулярные взаимодействия, ион-дипольные, диполь-дипольные, проявляющиеся на дальних расстояниях). 2) Специфическое взаимодействие (проявляется на близких расстояниях. Это взаимодействие обусловлено возникновением водородных и донорно-акцепторных химических связей, что связано с перестройкой электронных оболочек атома).
Объемные и энергетические эффекты образования растворов.
При растворении, частицы растворенного
вещества распределяются между
растворителем и объемом системы.
![]() (Если H2O,
то гидротация).
(Если H2O,
то гидротация).
![]() .
.
![]() >0
в эндотермических, и <0 при экзотермических.
>0
в эндотермических, и <0 при экзотермических.
![]() .
.
![]() ,
,
![]() ,
,
![]() 0
для твердых веществ.
0
для твердых веществ.
При растворении газов
![]() ,
,
![]() ,
,
![]() .
.
Идеальные растворы - это растворы неэлектролитов и их очень разбавленные растворы.
Важные характеристики растворов: С,
Рн.п., Ткрист-ии, осмотическое
давление. Рн.п – пар, находящийся
в равновесии с его жидкой фазой, когда
![]()
![]() - 1 уравнение 1 закона Рауля.
- 1 уравнение 1 закона Рауля.
![]() - 2 уравнение 1 закона Рауля.
- 2 уравнение 1 закона Рауля.
Относительное понижение давления
насыщенного пара в растворителе для
растворов
![]() равно молярной доле растворенного
вещества.
равно молярной доле растворенного
вещества.
Изменение Ткип в растворах.
![]() .
.
![]() ,
когда
,
когда
![]() .
Для воды
.
Для воды
![]()
![]() .
.
![]()
Для воды
![]()
Изменение
![]() и
и
![]() зависит от числа частиц растворенного
вещества и не зависит от природы
растворителя.
зависит от числа частиц растворенного
вещества и не зависит от природы
растворителя.
