
- •Растворы полимеров
- •Полимеризация
- •Поликонденсация
- •Полиэтилен
- •Полипропилен
- •Поливинилхлорид
- •Полиэтилентерефталат
- •Полистирол
- •Ионообменные смолы
- •Эпоксидные смолы
- •Волокна химические
- •Пластические массы
- •Гальванический элемент
- •Электродные потенциалы
- •Тривиальные названия
- •Классификация
- •Физические свойства
- •Характерные химические реакции
- •Алкадиены (диеновые углеводороды)
- •Строение, общие свойства
- •Физические свойства
- •Получение
- •Химические свойства
- •Например, 100 г некоторого раствора с плотностью 1,074 г/мл (1074 г/мл) имеет объем 93,1 мл (0,0931 л).
- •36. Окислительно-восстановительные реакции. Важнейшие окислители и восстановители. Типы окислительно-восстановительных реакций.
- •Структура периодической системы
Ионообменные смолы
, синтетические высокомолекулярные (полимерные) органические иониты. В соответствии с общей классификацией ионитов ионообменные смолы делят на катионообменные (поликислоты), анионообменные (полиоснования) и амфотерные, или биполярные (полиамфолиты). Получают ионообменные смолыполимеризацией, поликонденсацией или путём полимераналогичных превращений, так называемой химической обработкой полимера, не обладавшего до этого свойствами ионита. Ионообменные смолыиспользуют для обессоливания воды, извлечения и разделения редких элементов, очистки продуктов органического и неорганического синтеза и др.
Эпоксидные смолы
, олигомерные продукты поликонденсации эпихлоргидрина с многоатомными фенолами, спиртами, полиаминами, многоосновными кислотами, а также продукты эпоксидирования (т. е. введения эпоксидных групп) соединений, содержащих не менее двух двойных связей. Эпоксидные смолы используют как основу высокопрочных связующих и клеев, заливочных и пропиточных электроизоляционных компаундов, герметиков, лаков и пенопластов.
Волокна химические
, волокна, получаемые из органических природных и синтетических полимеров. В зависимости от вида исходного сырья волокна химические подразделяются на синтетические (из синтетических полимеров) и искусственные (из природных полимеров).
Лаки
, растворы плёнкообразующих веществ в органических растворителях, которые после нанесения тонким слоем на металлическую, деревянную или др. поверхность и высыхания образуют твёрдые блестящие прозрачные плёнки, прочно удерживаемые на поверхности силами адгезии. Назначение этих плёнок - защита изделий от разрушающего действия атмосферных агентов и др. агрессивных сред, а также декоративная отделка поверхности. Некоторые лаки используют в качестве электроизоляционных материалов. В наибольшем количестве лаки применяют как основу для приготовления пигментированных лакокрасочных материалов - эмалевых красок, грунтовок, шпатлёвок.
Пластические массы
, пластмассы, пластики, материалы, содержащие в своём составе полимер, который в период формования изделий находится в вязкотекучем или высокоэластичном состоянии, а при эксплуатации - в стеклообразном или кристаллическом состоянии.
Краски
, лакокрасочные материалы, в состав которых входят плёнкообразующие вещества (связующие) и тонкодисперсные неорганические или органические пигменты. Помимо этих основных компонентов, краскимогут содержать растворители, наполнители, сиккативы, пластификаторы и др. добавки. Связующими вкрасках могут служить: растительные масла или олифы; лаки, т. е. растворы природных или синтетических олигомеров или полимеров в органических растворителях; водные дисперсии полимеров; водные растворы растительных или животных клеев, жидкого стекла и др. Применение красок в народном хозяйстве и в быту преследует две основные цели: придание изделиям красивого внешнего вида и защиту поверхности от разрушения под воздействием влаги, солнечной радиации, химических реагентов, высоких температур, плесени и др.
60 см 45. Свободная энергия Гиббса.
1. Альдегиды, спирты и карбоновые кислоты (стр. 468, 471, 450, 464)
Альдегиды - органические соединения, содержащие двухвалентную карбонильную группу (С=О). В альдегидах она связана с одним атомом Н и с углеводородным радикалом (в муравьином альдегиде карбонильная группа связана с 2мя атомами Н).
У альдегидов большая поляризация связи, поэтому они наиболее активны. Кроме того, для альдегидов характерны реакции например гидратация в водном растворе: у метаналя в связи с ещё большей поляризацией связи — полная, а у других альдегидов — частичная:
RC(O)H → RC(OH)2H, где R — Н, любой алкильный или арильный радикал.
Простейшие альдегиды имеют резкий характерный запах (например, бензальдегид — запах миндаля). Под действием гидроксиламина превращаются в оксимы: СН3СНО + NH2OH = CH3C(=NOH)H + H2O
Название |
Формула |
Температура плавления |
Температура кипения |
Формальдегид |
HCOH |
−92 °C |
−21 °C |
Ацетальдегид |
CH3COH |
−123 °C |
20,8°C |
Пропаналь |
CH3CH2COH |
−81 °C |
48,8°C |
Бутаналь |
CH3CH2CH2COH |
−97 °C |
75°C |
Акролеин |
CH2=CH-COH |
−88 °C |
52,5°C |
Кротоновый альдегид |
CH3-CH=CH-COH |
−76,5 °C |
104°C |
Бензальдегид |
C6H5-COH |
−56 °C |
179°C |
Химические свойства
Восстановление. Альдегиды способны к восстановлению, основной продукт восстановления — первичные спирты.
Окисление. Альдегиды легко (значительно легче, чем спирты) окисляются в соответствующие карбоновые кислоты.
Реакция «серебряного зеркала». Альдегид + Ag2O (в аммиачном растворе) = Кислота + 2Ag.
Реакция «медного зеркала». Окислителем здесь выступает Cu(OH)2, гидроксид меди (II)
R—COH + 2Cu(OH)2 → R—COOH + Cu2O + 2H2O
Присоединение синильной кислоты. Используется для удлинения углеродной цепи.
R—COH + HCN → R-CH(OH)-CN
Присоединение гидросульфата натрия. Используется для выделения альдегидов из растворов.
R—COH + NaHSO3 → R-CH(OH)-SO3Na
Проявляют свойства органических оснований.
Биологическое действие
Токсичны. Способны накапливаться в организме. Кроме общетоксичного, обладают раздражающим и нейротоксическим действием. Эффект зависит от молекулярной массы: чем она больше, тем слабее раздражающее, но сильнее наркотическое действие, причём ненасыщенные альдегиды токсичнее насыщенных. Некоторые обладают канцерогенными свойствами. [1]
С другой стороны — входят в состав пищевых продуктов и эссенций (например, ананасовой [2]). Любое вещество, даже самое необходимое, может вызывать токсические эффекты. Действие вещества определяется дозой. В силу сходства химического строения все альдегиды обладают указанными у Лойта свойствами, только чтобы они проявились нужно принять дозу вещества много бо́льшую, чем содержится в пачке миндального печенья. Среднесмертельная дозаароматизатора бензальдегида (для крыс при пероральном введении) составляет 1300 мг на килограмм массы тела (для сравнения: у хлорида натрия среднесмертельная доза — 3000 мг/кг). У «настоящего яда» формальдегида LD50=100 мг/кг.
Спирты - органические соединения, содержащие одну или более гидроксильных групп (гидроксил, −OH), непосредственно связанных с насыщенным атомом углерода (находящемся в состоянии sp³ гибридизации)[1]. Спирты можно рассматривать как производные воды (H−O−H), в которых один атом водорода замещен на органическую функциональную группу: R−OH.
Если гидроксильная группа связана с двойной C=C связью, такие соединения называют енолы[2]. Если гидроксильная группа связана напрямую с бензольным кольцом, такие соединения называют фенолы[3].
Спирты являются обширным и очень разнообразным классом органических соединений: они широко распространены в природе, имеют важнейшее промышленное значение и обладают исключительными химическими свойствами.
Общие химические методы получения спиртов
Спирты могут быть получены из самых разных классов соединений, таких как углеводороды, алкилгалогениды, амины, карбонильные соединения, эпоксиды. Существует множество методов получения спиртов, среди которых выделим наиболее общие:
реакции окисления — основаны на окислении углеводородов (реже — галогенпроизводных углеводородов), содержащих кратные или активированные C−H связи;
В качестве окислительных агентов для алканов и циклоалканов используются сильные неорганические окислители: озон, перманганат калия, оксид хрома (VI), хромовая кислота, диоксид селена, а также пероксид водорода и некоторые пероксикислоты. Из-за возможности более глубокого окисления, метод имеет значение, как правило, только для получения третичных спиртов[66]:[cтр. 57—59]:
![]()
Окисление алкенов значительно более распространено в лабораторной практике, особенно когда речь идёт о получении диолов. В зависимости от выбора реагента можно осуществить син-гидроксилирование (тетраоксид осмия, перманганат калия, хлорат натрия, иод с карбоксилатом серебра и пр.) или анти-гидроксилирование (пероксид водорода и пероксикислоты, оксиды молибдена (VI) и вольфрама (VI), оксид селена (IV) и пр.)[67]:
![]()
Алкены также могут гидроксилироваться в аллильное положение синглетным кислородом с миграцией двойной связи и образованием гидропероксидов, которые затем восстанавливаются до спиртов[68]:
![]()
Важным препаративным методом является окисление галогенпроизводных углеводородов надпероксидом калия[69].
реакции восстановления — восстановление карбонильных соединений: альдегидов, кетонов, карбоновых кислот и сложных эфиров;
Для восстановления альдегидов или кетонов, обычно, пользуются борогидридом натрия или калия, а также алюмогидридом лития в протонном растворителе[68]:
![]()
Восстановление сложных эфиров и карбоновых кислот производится алюмогидридом или борогидридом лития, а также некоторыми другими комплексными гидридами[68]:
![]()
реакции гидратации — кислотно-катализируемое присоединение воды к алкенам (гидратация);
![]()
Реакция имеет промышленное значение (например: синтез этанола), однако в лабораторной практике часто замещается реакцией оксимеркурирования-демеркурирования алкенов или гидроборированием алкенов с их последующим окислением[68]:
![]()
![]()
реакции присоединения:
присоединение синтез-газа, формальдегида, оксирана по кратным углеводородным связям;
Простейший пример такой реакции — промышленный синтез метанола[70]:
![]()
Среди других вариантов использования:
![]()
![]()
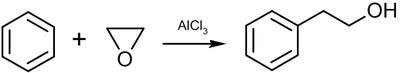
присоединение нуклеофилов к карбонильным соединениям;
Общая схема реакций подобного типа:

Существует множество реакций присоединения, включая реакции гидратации, этинилирования и прочих, рассмотренных выше. Здесь приведём примеры некоторых важных препаративных методов.
Присоединение аллиборанов с последующим гидролизом[71]:
![]()
Реакция Бэйлиса-Хиллмана-Морита[72]:

реакции замещения (гидролиза) — реакции нуклеофильного замещения, при которых имеющиеся функциональные группы замещаются на гидроксильную группу;
На практике для реакций замещения, как правило, используются галогенпроизводные:
![]()
синтезы с использованием металлорганических соединений.
Использование металлорганических соединений для синтеза спиртов — мощный препаративный метод, позволяющий получить спирты из различных производных.
синтез через реактивы Гриньяра[73]:
![]()
![]()
реакция Циглера[74]:
![]()
синтез с использованием органокупратов[75]:
![]()
Химические свойства спиртов
Физико-химические свойства спиртов определяются в основном строением углеводородной цепи и функциональной группы −OH, а также их взаимным влиянием:
1) Чем больше заместитель, тем сильнее он влияет на функциональную группу, снижая полярность связи O—Н. Реакции, основанные на разрыве этой связи, протекают более медленно.
2) Гидроксильная группа −ОН уменьшает электронную плотность вдоль прилегающих σ-связей углеродной цепи (отрицательный индуктивный эффект).
Все химические реакции спиртов можно разделить на три условных группы, связанных с определёнными реакционными центрами и химическими связями:
Разрыв связи O−H (реакционный центр — водород);
Разрыв или присоединение по связи С−OH (реакционный центр — кислород);
Разрыв связи −СOH (реакционный центр — углерод).
Реакции с участием гидроксильной группы (связи С−O и О−H)
Кислотно-основные реакции спиртов
Со щелочными и щелочноземельными металлами, алюминием, галлием, таллием и некоторыми другими металлами, а также сильными основаниями (например: амидами или гидридами) спирты способны реагировать с образованием алкоголятов[93]:
![]()
![]()
![]()
С сильными кислотами Льюиса спирты веду себя подобно основаниям, образуя донорно-акцепторные комплексы[60]:
![]()
Подробнее о природе кислотно-основных свойствах спиртов смотри раздел: Диссоциация и кислотно-основные свойства спиртов.
Классификация спиртов
Спирты классифицируются следующим образом (в скобках приведены примеры)[5]:
По числу гидроксильных групп:
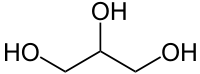
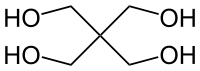
— одноатомные спирты (метанол); — двухатомные спирты (этиленгликоль); — трехатомные спирты (глицерин); — четырёхатомные спирты (пентаэритрит); — многоатомные спирты (пятиатомный спирт: ксилит). |
|
|
трёхатомный спирт глицерин |
четырёхатомный спирт пентаэритрит |
В зависимости от насыщенности углеводородного заместителя:
— предельные или насыщенные спирты (бутанол); — непредельные или ненасыщенные спирты (аллиловый спирт, пропаргиловый спирт); — ароматические спирты (бензиловый спирт). |
|
В зависимости от наличия или отсутствия цикла в углеводородном заместителе:
— алициклические спирты (циклогексанол); — алифатические или ациклические спирты (этанол). |
|
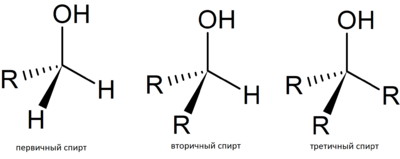
В зависимости от того, при каком атоме углерода находится гидроксильная группа:
— первичные спирты (пропанол); — вторичные спирты (изопропиловый спирт); — третичные спирты (2-метилпропан-2-ол). |
|
Карбоновые кислоты - класс органических соединений, молекулы которых содержат одну или несколько функциональных карбоксильных групп -COOH. Кислые свойства объясняются тем, что данная группа может сравнительно легко отщеплять протон. За редкими исключениями карбоновые кислоты являются слабыми. Например, у уксусной кислоты CH3COOH константа кислотности равна 1,75×10−5. Ди- и трикарбоновые кислоты более сильные, чем монокарбоновые.
Кислотными свойствами могут обладать некоторые другие классы органических соединений, например фенолы.
Классификация
В зависимости от радикала, связанного с карбоксилом, различают алифатические (предельные и непредельные), алициклические, ароматические и гетероциклические карбоновые кислоты. По числу карбоксильных групп кислоты могут быть одно-, двух- и многоосновными. При введении в молекулы кислоты других функциональных групп (например, -ОН, =CO, -NH2 и др.) образуются окси-, кето-, аминокислоты и другие классы соединений.
Физические свойства
Низшие карбоновые кислоты — жидкости с острым запахом, хорошо растворимые в воде. С повышением относительной молекулярной массы растворимость кислот в воде уменьшается, а температура кипения повышается. Высшие кислоты, начиная с пеларгоновой (н-нонановой) СН3-(СН2)7-СООН, — твердые вещества, без запаха, нерастворимые в воде. Низшие карбоновые кислоты в безводном виде и в виде концентрированных растворов раздражают кожу и вызывают ожоги, особенно муравьиная кислота и уксусная кислота.
Характерные химические реакции
Наиболее важные химические свойства, характерные для большинства карбоновых кислот:
1) Карбоновые кислоты при реакции с металлами или их осно́вными гидроксидами дают соли соответствующих металлов:
![]()
![]()
Также карбоновые кислоты могут вытеснять более слабую кислоту из её соли, например:
![]() (потом
(потом ![]() разлагается
на углекислый
газ и воду)
разлагается
на углекислый
газ и воду)
2) Карбоновые кислоты в присутствии кислого катализатора реагируют со спиртами, образуя сложные эфиры (реакция этерификации):
CH3COOH + СН3СН2ОН = CH3COOCH2СН3 + H2O
3) При нагревании аммонийных солей карбоновых кислот образуются их амиды:
![]()
4) Под действием ![]() карбоновые
кислоты превращаются в
соответствующие хлорангидриды.
карбоновые
кислоты превращаются в
соответствующие хлорангидриды.
![]()
2. задача
3. задача
4. Взаимодействие алюминия с раствором щелочи NaOH.
С металлами: Гидроксид натрия вступает в реакцию с алюминием, цинком, титаном. Он не реагирует с железом и медью (металлами, которые имеют низкий электрохимический потенциал). Алюминий легко растворяется в едкой щёлочи с образованием хорошо растворимого комплекса — тетрагидроксиалюмината натрия и водорода:
2Al0 + 2NaOH + 6H2O → 3H2↑ + 2Na[Al(OH)4]
2Al0 + 2Na+ + 8OH− + 6H+ → 3H2↑ + 2Na+[Al3+(OH)−4]−
5. Взаимодействие металлов с разбавленной и концентрированной серной кислотой.
Разбавленная серная кислота ведет себя, как обычная кислота.
Активные металлы, стоящие в ряду напряжений левее водорода
Li, К, Ca, Na, Mg, Al, Mn, Zn, Fe, Co, Ni, Sn, Pb, H2, Cu, Hg, Ag, Au
вытесняют водород из разбавленной серной кислоты.
Мы видим пузырьки газа в пробирке с цинком.
H2SO4 + Zn = Zn SO4 + H2 ↑
Медь стоит в ряду напряжений после водорода – поэтому разбавленная серная кислота не действует на медь.
Как поведут себя цинк и медь в концентрированной серной кислоте?
Цинк, как активный металл, может образовывать с концентрированной серной кислотой сернистый газ, элементарную серу, и даже сероводород.
2H2SO4 + Zn = SO2 ↑+ZnSO4 + 2H2O
Медь - менее активный металл. При взаимодействии с конц серной кислотой восстанавливает ее до сернистого газа.
2H2SO4 конц. + Cu = SO2 ↑+ CuSO4 + 2H2O
Значит, в двух пробирках мы наблюдаем выделение сернистого газа.
6. Вода как электролит. Ионное произведение воды. Среда нейтральная, кислая, щелочная. рН воды.
Электроли́т — вещество, расплав или раствор, которое проводит электрический ток вследствие диссоциации на ионы. Примерами электролитов могут служить растворы кислот, солей и оснований.
Исходя из степени диссоциации все электролиты делятся на две группы
Сильные электролиты — электролиты, степень диссоциации которых в растворах равна единице (то есть диссоциируют полностью) и не зависит от концентрации раствора. Сюда относятся подавляющее большинство солей, щелочей, а также некоторые кислоты (сильные кислоты, такие как:HCl, HBr, HI, HNO3).
Слабые электролиты — степень диссоциации меньше единицы (то есть диссоциируют не полностью) и уменьшается с ростом концентрации. К ним относят воду, ряд кислот (слабые кислоты), основания p-, d-, и f- элементов.
Ионное произведение воды – это произведение концентраций ионов водорода и гидроксид-ионов, произведение концентраций ионов водорода Н+ и ионов гидроксида OH− в воде или в водных растворах.
Вода, хотя и является слабым электролитом, в небольшой степени диссоциирует:
H2O + H2O ↔ H3O+ + OH−
или
H2O ↔ H+ + OH−
Равновесие этой реакции сильно смещено влево. Константу диссоциации воды можно вычислить по формуле:
|
(1) |
где:
[H+] — концентрация ионов гидроксония (протонов);
[OH−] — концентрация гидроксид-ионов;
[H2O] — концентрация воды (в молекулярной форме) в воде;
Концентрация воды в воде, учитывая её малую степень диссоциации, величина практически постоянная и составляет (1000 г/л)/(18 г/моль) = 55,56 моль/л.
При 25 °C константа диссоциации воды равна 1,8·10−16моль/л. Уравнение (1) можно переписать как:
|
(2) |
Обозначим произведение K·[H2O] = Kв = 1,8·10−16 моль/л·55,56 моль/л = 10−14моль²/л² = [H+]·[OH−] (при 25 °C).
Константа Kв, равная произведению концентраций протонов и гидроксид-ионов, называется ионным произведением воды. Она является постоянной не только для чистой воды, но также и для разбавленных водных растворов веществ. C повышением температуры диссоциация воды увеличивается, следовательно, растёт и Kв, при понижении температуры — наоборот.
Водоро́дный показа́тель, pH — мера активности (в очень разбавленных растворах она эквивалентна концентрации) ионов водорода в растворе, и количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным знаком) десятичный логарифм активности водородных ионов, выраженной в молях на литр:
![]()
Вопреки распространённому мнению, pH может изменяться не только в интервале от 0 до 14, а может и выходить за эти пределы. Например, при концентрации ионов водорода [H+] = 10−15 моль /л, pH = 15, при концентрации ионов гидроксида 10 моль /л pOH = −1.
Так как при 25 °C (стандартных условиях)[H+] · [OH−] = 10−14, то понятно, что при этой температуре pH + pOH = 14.
Так как в кислых растворах [H+] > 10−7, то pH кислых растворов pH < 7, аналогично pH щелочных растворов pH > 7, pH нейтральных растворов равен 7. При более высоких температурах константа электролитической диссоциации воды повышается, соответственно увеличивается ионное произведение воды, поэтому нейтральной оказывается pH < 7 (что соответствует одновременно возросшим концентрациям как H+, так и OH−); при понижении температуры, напротив, нейтральная pH возрастает.
7. Высокомолекулярные соединения. Классификация. Методы получения и применение ВМС.
Полимеры — неорганические и органические, аморфные и кристаллические вещества, получаемые путём многократного повторения различных групп атомов, называемых «мономерными звеньями», соединённых в длинные макромолекулы химическими или координационными связями. Полимер — это высокомолекулярное соединение: количество мономерных звеньев в полимере (степень полимеризации) должно быть достаточно велико. Во многих случаях количество звеньев может считаться достаточным, чтобы отнести молекулу к полимерам, если при добавлении очередного мономерного звена молекулярные свойства не изменяются.[1] Как правило, полимеры — вещества с молекулярной массой от нескольких тысяч до нескольких миллионов.
8. задача.
9. Гальванический элемент, электродные потенциалы.
Гальвани́ческий элеме́нт — химический источник электрического тока, названный в честь Луиджи Гальвани. Принцип действия гальванического элемента основан на взаимодействии двух металлов через электролит, приводящем к возникновению в замкнутой цепи электрического тока. ЭДС гальванического элемента зависит от материала электродов и состава электролита. Сейчас широко распространены следующие гальванические элементы:
Тип |
ЭДС (В) |
Достоинства |
угольно-цинковые (солевые) |
1,5 |
дешёвые |
щелочные (жаргонное название — алкалиновые) |
1,6 |
высокий ток, ёмкие |
никельоксигидроксидные (NiOOH) |
1,6 |
высокий ток,очень ёмкие |
литиевые |
3,0 |
очень высокий ток, очень ёмкие |

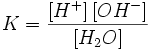 ,
,