
- •Введение в обмен веществ. Биологическое окисление.
- •Катаболических (экзергонических) реакций;
- •Анаболических (эндергонических) реакций.
- •Дегидрирование - отщепление от субстрата атомов водорода:
- •Присоединение к веществу кислорода (одного атома или двух):
- •Дыхательная цепь
- •Блок-схема дыхательной цепи
- •Переносчики электронов
- •Механизм окислительного фосфорилирования
- •Строение дыхательной цепи и механизм окислительного фосфорилирования
Дегидрирование - отщепление от субстрата атомов водорода:
Н-S-H -2H ------ S (где S - субстрат)
Присоединение к веществу кислорода (одного атома или двух):
S + O ------SO SO2 (где S - субстрат)
Окисление органических веществ в клетках, сопровождающееся потреблением кислорода и синтезом воды, называют тканевым дыханием,
Углеводы, жирные кислоты и большинство аминокислот окисляются в конечном счёте через цикл лимонной кислоты до СО2 и Н2О, но прежде, их углеродный скелет превращается в двухуглеродный фрагмент ацетил-КоА. Главным источником ацетил-КоА служит пировиноградная кислота, образующаяся в реакциях катаболизма глюкозы и некоторых аминокислот.
Окислительное декарбоксилирование пирувата
Окислительное декарбоксилирование пирувата происходит в матриксе митохондрий. Транспорт пирувата в митохондриальный матрикс через внутреннюю мембрану митохондрий осуществляется при участии специального белка-переносчика по механизму симпорта с Н+:
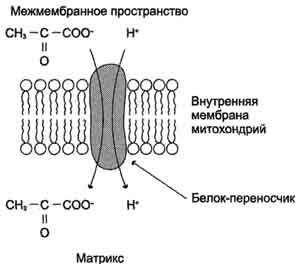
Превращение пирувата в ацетил-КоА описывают следующим суммарным уравнением. Реакция необратима, поскольку ΔG0' = -33,5 кДж/моль.
СН3-СО-СООН + NAD+ + HSKoA → CH3-CO ∼SKoA + NADH + H+ + CO2
Строение пируватдегидрогеназного комплекса
Процесс окислительного декарбоксилирования пирувата катализирует сложноорганизованный пируватдегидрогеназный комплекс, состоящий из 3 ферментов:
- пируватдекарбоксилаза (Е1),
- дигидролипоилтрансацетилаза (Е2),
- дигидролипоилдегидрогеназа (Е3),
а также 5 коферментов: тиаминдифосфат (ТДФ), липоевая кислота, FAD, NAD+ и КоА. Кроме того, в состав комплекса входят регуляторные субъединицы: протеинкиназа и фосфопротеинфосфатаза.
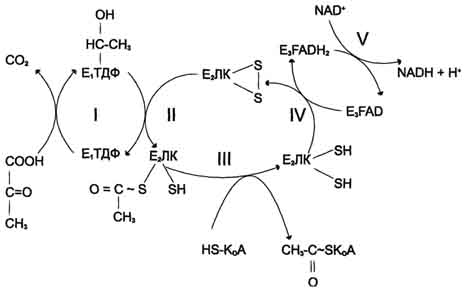
Последовательность реакций, катализируемых ПДК, включает 5 стадий:
I - Е1 катализирует декарбоксилирование пирувата и перенос С2-фрагмента на ТДФ;
II - Е2 катализирует окисление гидроксиэтильной группы и перенос С2-фрагмента на липоевую кислоту (ЛК);
III - ацетилированная дигидролипоилтрансацетилаза взаимодействует с КоА с образованием восстановленной формы липоевой кислоты и ацетил-КоА;
IV - окисленная форма трансацетилазы Е2 регенерируется при участии E3;
V - окисленная форма Е3 регенерируется при участии NAD+.
Пируватдегидрогеназный комплекс (ПДК) млекопитающих
Фермент |
|
Число мономеров |
Кофермент |
Витамин |
1. Пируватдекарбоксилаза (пируватдегидрогеназа) |
E1 |
120 (30 тетрамеров) |
ТДФ |
B1 |
2. Дигидролипоилтрансацетилаза |
Е2 |
180(60тримеров) |
Липоамид |
Липоевая кислота (ЛК) |
KoA |
Пантотеновая кислота |
|||
3. Дигидролипоилдегидрогеназа |
Е3 |
12 (6 димеров) |
FAD NAD+ |
В2 РР |
В центре комплекса располагается дигидролипоилтрансацетилаза (Е2), образуя его ядро. К дигидролипоилтрансацетилазе присоединены молекулы: пируватдекарбоксилазы (Е1) и дигидролипоилдегидрогеназы (Е3).
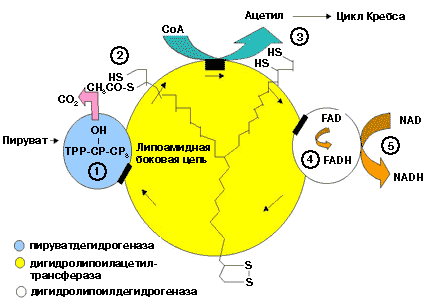
Пируватдекарбоксилаза содержит прочно связанный с белковой частью ТДФ, а дигидролипоилдегидрогеназа - FAD.
Липоиллизиновые группы центрального фермента (Е2) функционируют как поворотные "кронштейны", переносящие атомы водорода и ацетильные группы от одной ферментной молекулы комплекса к другой.
Окислительное декарбоксилирование пирувата
Превращение пирувата в ацетил-КоА
Стадия I. Реакция декарбоксилирования пирувата.
Значение декарбоксилирования пирувата в отношении извлечения энергии из молекулы исключительно велико. Три углеродных атома пирувата имеют разную степень окисления. Углерод метильной группы (-СНз) не окислен и, следовательно, в дальнейшем при его окислении можно получить полезную энергию. Углерод кето-группы (>С=О) окислен частично. При его дальнейшем окислении можно также извлечь некоторое количество дополнительной энергии. А углерод карбоксильной группы окислен почти полностью. Поэтому карбоксильная группа - это до некоторой степени балластная часть молекулы с позиции извлечения энергии. Её необходимо удалить. Удаление карбоксильной группы (т.е. реакцию декарбоксилирования) катализирует фермент пируватдегидрогеназа, в активном центре которого локализован тиаминдифосфат - кофермент декарбоксилирования.
Пируват + Е1-ТДФ → Гидроксиэтил-ТДФ + CO2.
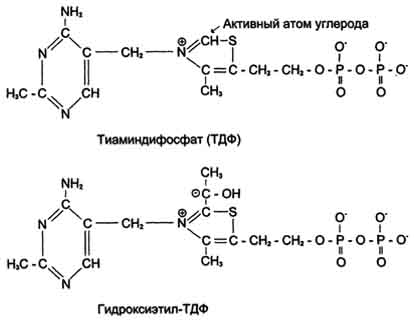
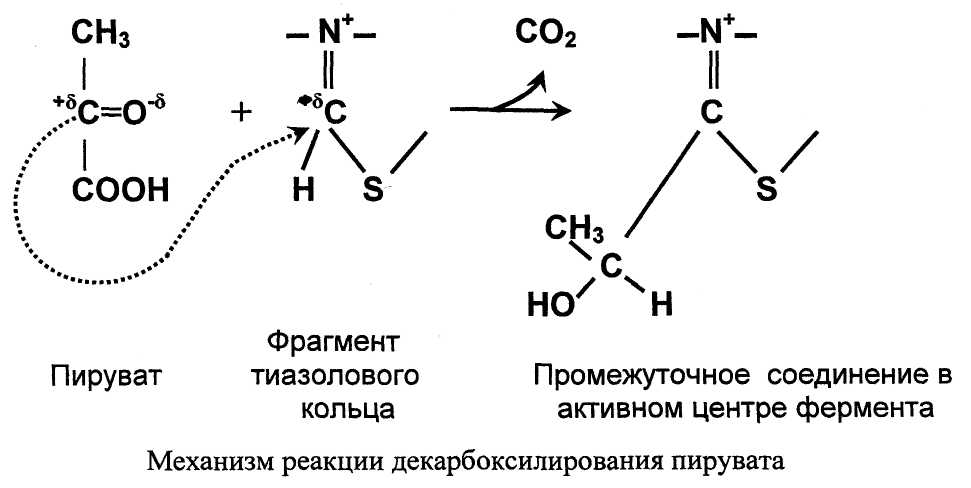
Тиаминдифосфат (ТДФ) и гидроксиэтил-ТДФ. Рабочей частью ТДФ служит тиазоповое кольцо, к которому присоединяется продукт декарбоксилирования пирувата - гидроксиэтил. В активном центре фермента происходит прямое взаимодействие двух атомов углерода с образованием между ними ковалентной связи. Это взаимодействие обусловлено частичными разноименными зарядами, которыми обладают углерод кето-группы пирувата с одной стороны и атом углерода тиазолового кольца тиаминпирофосфата с другой.
На этой стадии E1 (пируватдегидрогеназа) переносит атом водорода и двухуг- леролеродный ацетильный фрагмент (СН3-СО-) на молекулу липоевой кислоты, локализованную в активном центре фермента Е2 (дигидролипоамидацетилтранс- феразы). При этом в активном центре фермента образуется ацетилтиоэфир липое вой кислоты.
В этой реакции KoA-SH атакует тиоэфирную связь в активном центре фермента Е2, разрывает её и присоединяет к себе двухуглеролеродный ацетильный фрагмент (СНз-СО-). Происходит образование ацетил~КоА, который покидает активный центр фермента Е2 (дигидролипоамидацетилтрансферазы). При этом оба атома серы липоевой кислоты полностью восстановлены.
В этой реакции фермент Е3 (дигидролипоамиддегидрогеназа) катализирует
перенос двух атомов водорода с восстановленной липоевой кислоты, находящейся в активном центре фермента Е2 на кофермент ФАД, локализованный в своём актив ном центре. При этом в активном центре фермента Е3 образуется ФАДН2.
В активный центр дегидрогеназы (Е3) пируватдегидрогеназного комплекса входит НАД+ и присоединяет к себе 2 электрона и протон от кофермента ФАДН2 и в форме НАДН переносит их в процесс окислительного фосфорилирования.
Связь окислительного декарбоксилирования пирувата с процессом окислительного фосфорилирования
При превращении пирувата в ацетил-КоА происходит образование НАДН, транспортирующего электроны в дыхательную цепь. Из пары высокоэнергетических электронов в процессе окислительного фосфорилирования может синтезироваться до 3 молекул АТФ. Усиление распада АТФ в клетке ведет к повышению концентрации АДФ и ускорению окисления НАДН в дыхательной цепи. Повышение концентрации НАД+, в свою очередь, стимулирует окислительное декарбоксили-рование пирувата. Напротив, повышение концентрации АТФ и НАДН снижает скорость этого процесса.
Таким образом, изменения отношений АДФ/АТФ и НАДН/НАД+ - важнейшие внутриклеточные регуляторные сигналы, отражающие энергетические потребности клетки и регулирующие скорость окислительного декарбоксилирования пирувата. Каталитическая активность пируватдегидрогеназного комплекса снижается, когда в клетках имеется достаточно "топлива" в виде жирных кислот и аце-тил~КоА.
Структурное объединение 3 видов ферментов создаёт возможности для координации отдельных этапов сложной ферментативной реакции. Все промежуточные продукты реакции окислительного декарбоксилирования пирувата прочно связаны с комплексом, что увеличивает суммарную скорость процесса и сводит к минимуму побочные реакции.
Пируватдегидрогеназный комплекс, как и все белки, участвующие в реакциях ЦТК, кодируется ядерной ДНК. Транспорт субъединиц ПДК в митохондрии происходит сложным путём за счёт энергии АТФ или трансмембранного электрохимического потенциала при участии белков теплового шока (или шапперонов), предотвращающих их преждевременный фолдинг до поступления в митохондриальный матрикс или внутреннюю мембрану митохондрий.
.
Регуляция пируватдегидрогеназного комплекса
Регуляция пируватдегидрогеназного комплекса (ПДК) имеет важное значение для обеспечения цикла трикарбоновых кислот "топливными" молекулами ацетил-КоА. Точная регуляция этого комплекса имеет важное значение в связи с невозможностью обратного преобразования ацетил-КоА в пируват, т.к. ферменты, необходимые для этого в организме человека отсутствуют.
Активность ПДК регулируется различными способами:
- доступностью субстратов,
- ингибированием продуктами реакции,
- аллостерическим путём,
- путём ковалентной модификации.
|
|
|
Регуляция
активности пируватдегидрогеназного
комплекса (ПДК)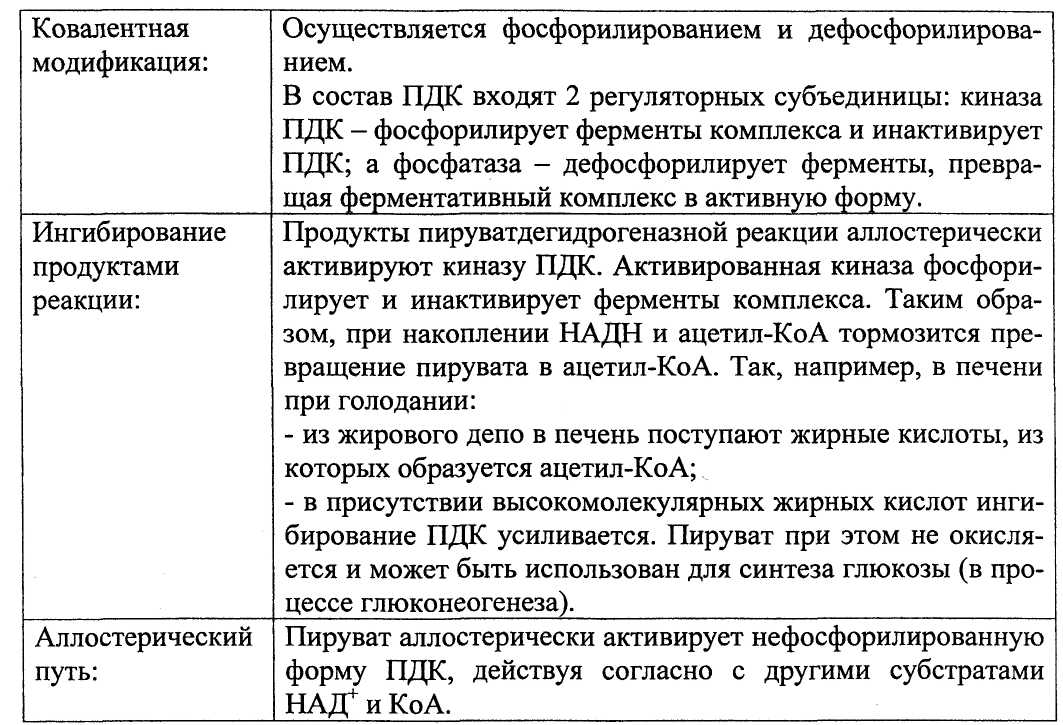
Активность пируватдегидрогеназного комплекса увеличивается при повышении концентрации АДФ, внутриклеточного кальция, под влиянием гормонов: инсулина и адреналина.
При повышении концентрации АДФ ПДК находится в нефосфорилированной активной форме. Этот эффект усиливается при повышении концентрации внутриклеточного кальция, который активирует фосфатазу ПДК. Такой механизм активации ПДК особенно важен в мышцах и жировой ткани. Активация ПДК происходит также под влиянием инсулина. Один из эффектов инсулина - повышение концентрации внутримитохондриального кальция, это приводит к активированию ПДК. В клетках миокарда ПДК активируется адреналином.
Фермент фосфатаза, активируясь ионами кальция или инсулином, отщепляет фосфат и активирует пируватдегидрогеназу:

Таким образом, работа пируватдегидрогеназы подавляется при избытке в митохондрии (в клетке) АТФ и НАДН, что позволяет снизить окисление пирувата и, следовательно, глюкозы, в случае когда энергии достаточно.
Если АТФ мало или имеется влияние инсулина, то образуется ацетил-SКоА. Последний в зависимости от условий будет направляться либо в цикл трикарбоновых кислот с образованием энергии АТФ, либо на синтез холестерина и жирных кислот.
Сущность образования восстановленных НАДН и ФАДН2
Молекулы НАДН и ФАДН2, образуемые в реакциях окисления углеводов, жирных кислот, спиртов и аминокислот, далее поступают в митохондрии, где ферментами дыхательной цепи осуществляется процесс окислительного фосфорилирования.
Окислительное фосфорилирование
Окислительное фосфорилирование – это многоэтапный процесс, происходящий во внутренней мембране митохондрий и заключающийся в окислении восстановленных эквивалентов (НАДН и ФАДН2) ферментами дыхательной цепи и сопровождающийся синтезом АТФ.
Впервые механизм окислительного фосфорилирования был предложен Питером Митчеллом (хемиосмотическая теория): перенос электронов, происходящий на внутренней митохондриальной мембране, вызывает выкачивание ионов Н+ из матрикса митохондрий в межмембранное пространство, что создает градиент концентрации ионов Н+. Н+ в норме способны возвращаться в матрикс митохондрий только одним способом – через специальный фермент, образующий АТФ – АТФ-синтазу.
Внутренняя митохондриальная мембрана содержит ряд мультиферментных комплексов, включающих множество ферментов. Эти ферменты называют дыхательными ферментами, а последовательность их расположения в мембране – дыхательной цепью.
Принцип работы дыхательной цепи
В целом работа дыхательной цепи заключается в следующем:
Образующиеся в реакциях катаболизма НАДН и ФАДН2 передают атомы водорода (т.е. протоны водорода и электроны) на ферменты дыхательной цепи.
Электроны движутся по ферментам дыхательной цепи и теряют энергию.
Эта энергия используется на выкачивание протонов Н+ из матрикса в межмембранное пространство.
В конце дыхательной цепи электроны попадают на кислород и восстанавливают его до воды.
Протоны Н+ стремятся обратно в матрикс и проходят через АТФ-синтазу.
При этом они теряют энергию, которая используется для синтеза АТФ.

Общий принцип окислительного фосфорилирования
Восстановленные формы НАД и ФАД окисляются ферментами дыхательной цепи, благодаря этому происходит присоединение фосфата к АДФ, т.е. фосфорилирование. Поэтому весь процесс целиком получил название окислительное фосфорилирование.
