
- •Часть 1.Некоторые вопросы теории.
- •1.2.Взаимное влияние атомов. Электронные эффекты в органической химии.
- •1.3.Пространственное строение органических соединений.
- •1.3.1.Конформация простых молекул.
- •Заторможенная, частично заслоненная скошенная,или
- •1.3.2. Конформация циклических соединений.
- •1.3.3 Оптическая изомерия
- •Хиральность молекулы и оптическая активность
- •1.4.Общая характеристика реакций органических соединений.
Хиральность молекулы и оптическая активность
Но возможна и другая ситуация. Молекула может и не иметь хирального центра, но быть оптически активной. В этом случае появление оптической активности обусловлено хиральностью всей молекулы. Рассмотрим это на примере пента-2,3-диена.
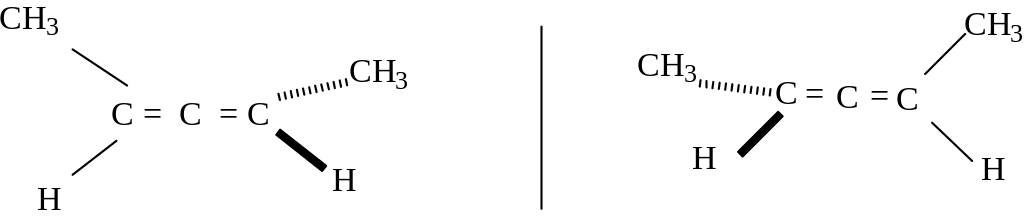
Два энантиомера пента-2,3-диена.
Строение молекулы таково, что две двойные связи лежат в двух взаимно перпендикулярных плоскостях, молекула хиральна и может существовать в виде пары энантиомеров. Оптической активностью обладают и некоторые производные бифенила. Если создать условия, при которых невозможно вращение вокруг - связи, то такие молекулы становятся оптически активными. Такая ситуация реализуется, когда в орто – положения бензольного ядра вводят объемистые заместители. Так, о-, о - динитродифеновые кислоты существуют в виде пары энантиомеров, которые можно выделить в индивидуальном состоянии. В этом соединении невозможно вращение вокруг центральной С-С связи из-за наличия объемистых групп в орто-положениях, при этом два фенильных кольца лежат в двух взаимно перпендикулярных плоскостях, поэтому молекула хиральна и обладает оптической активностью.
О птическая
изомерия, обусловленная затруднением
вращения.
птическая
изомерия, обусловленная затруднением
вращения.
Абсолютная и относительная конфигурация хиральных молекул.
Оптически активные молекулы отличаются конфигурацией. Этот термин означает определенное пространственное расположение атомов в молекуле. Естественно, возникает вопрос, как экспериментально определить конфигурацию данного стереоизомера. Это удалось только в 1951 году, когда был разработан специальный вариант рентгеноструктурного анализа, который позволил определить абсолютную конфигурацию хиральной молекулы. Этим первым соединением оказалась молекула природной (+) винной кислоты. Установление абсолютной конфигурации - это очень трудоемкий процесс. Однако такой необходимости нет после того, как была установлена абсолютная конфигурация нескольких ключевых молекул ((+) глицеринового альдегида,(+) глюкозы и др.). Оказалось, что можно устанавливать относительную конфигурацию хирального центра, сравнивая его конфигурацию с конфигурацией ключевого, или эталонного соединения.
Способы обозначения оптически активных молекул.
В течение многих лет конфигурация стереоизомеров обозначалась символами D и L, чтобы связать их конфигурацию с конфигурацией 2,3- дигидроксипропаналя ( глицеринового альдегида).

D(+) глицериновый альдегид L(-) глицериновый альдегид. Энантиомеры 2,3-дигидроксипропаналя (глицеринового альдегида)
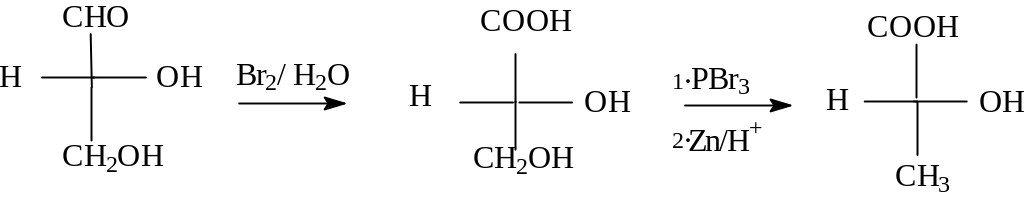
Если конфигурация хирального центра изучаемой молекулы совпадала с конфигурацией (+) глицеринового альдегида, то ей приписывалась D-конфигурация, если имела противоположную, т.е. совпадала с (-) -глицериновым альдегидом, - то L- конфигурацию. В настоящее время правильность произвольно выбранной конфигурации для (+) глицеринового альдегида подтверждена рентгеноструктурным анализом и приобрела силу абсолютной конфигурации. Глицериновый альдегид был выбран первоначально в качестве соединения сравнения, ”стандарта”, по той причине, что его можно было превратить во многие другие встречающиеся в природе соединения. Например (+)глицериновый альдегид можно превратить в (-) молочную кислоту рядом последовательных реакций, не затрагивающих хиральный центр.
 D(+)
-глицериновый альдегид D(-) -молочная
кислота
D(+)
-глицериновый альдегид D(-) -молочная
кислота
Схема синтеза (-) молочной кислоты из (+) глицеринового альдегида
Таким образом, обе эти молекулы имеют одинаковую конфигурацию (D) , хотя знаки их вращения разные. Заглавные буквы D и L стали символами первой стереохимической номенклатуры. В настоящее время она широко используется в химии углеводов и аминокислот. Например, аминокислоты, входящие в состав белков, относятся к L-ряду .По этой номенклатуре L-конфигурация приписывается тому стереоизомеру, у которого NH2- группа находится слева от вертикальной прямой на проекции Фишера , при условии, если окисленная группа располагается вверху.

L - изомер D-изомер
В природе наиболее распространены углеводы, относящиеся к D-ряду. Отнесение к D-ряду углеводов производится по расположению самой нижней гидроксильной группы, связанной с асимметрическим атомом углерода.
D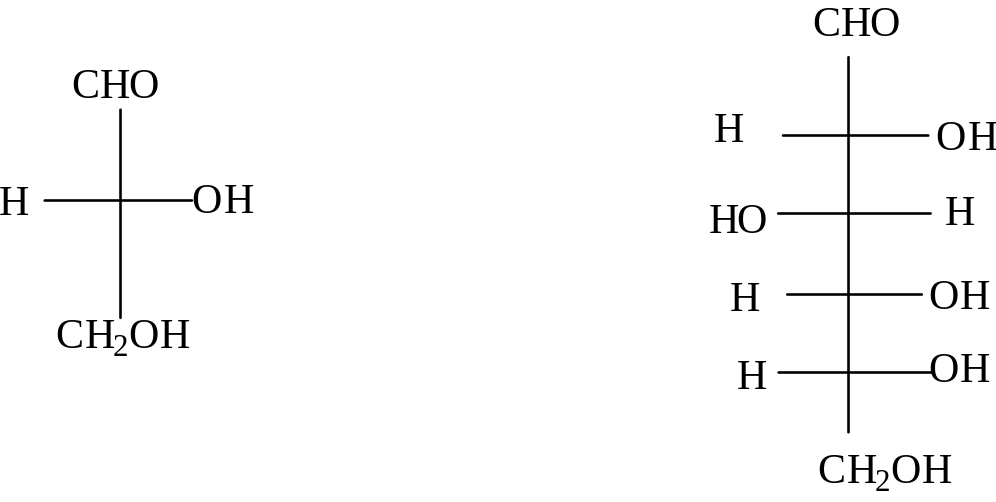 -глицериновый
D-глюкоза
-глицериновый
D-глюкоза
альдегид
D и L система используется часто и в настоящее время, но с помощью этой системы можно обозначить только конфигурацию одного хирального центра. В 1951 году была предложена универсальная стереохимическая номенклатура, позволяющая обозначить любое число хиральных центров. Согласно правилам этой системы, можно дать название стереоизомеру как по проекционной формуле, так и по молекулярной модели, и, наоборот, воспроизвести проекционную формулу. Для обозначения хиральных центров используют символы R и S . Чтобы обозначить хиральный центр соответствующим символом R или S, определяют старшинство заместителей при асимметрическом атоме углерода. Предположим, что старшинство заместителей падает в следующей последовательности: a > b > c > d. Тетраэдрическую модель располагают таким образом, чтобы младший заместитель находился в удаленном от глаза наблюдателя углу тетраэдра. Затем на молекулу смотрят со стороны, удаленной от младшего заместителя. Если при этом старшинство заместителей уменьшается по часовой стрелке (от старшего заместителя к младшему), то такому хиральному центру приписывают символ R, а если против часовой стрелки - то S.
 Старшинство
групп уменьшается Старшинство групп
уменьшается по часовой стрелке
против часовой стрелки
Старшинство
групп уменьшается Старшинство групп
уменьшается по часовой стрелке
против часовой стрелки
Порядок старшинства заместителей определяется следующим образом:
1Атомы, непосредственно связанные с хиральным центром, располагаются в порядке уменьшения их атомных номеров, например: Br > Cl > C > H.
2. Если два или более атомов, непосредственно связанных с хиральным центром, одинаковы, то порядок старшинства определяется атомными номерами следующего слоя:
CH2OH > CH2NH2 > CH3CH2 > CH3
3.Если атом, связанный с хиральным центром, имеет кратные связи, то атом на другом конце кратной связи считается дважды (для двойной связи) или трижды (для тройной связи):
COOH > COH > CH2OH
Более удобно использовать не тетраэдрические модели, а проекционные формулы Фишера. Для этого надо спроектировать модель на плоскость таким образом, чтобы младший заместитель оказался внизу на проекции, а путем четного числа перестановок при хиральном центре добиться их такого расположения, чтобы оно совпадало со старшинством заместителей.
На основании приведенных выше правил и старшинства заместителей вокруг асимметрического атома углерода определим конфигурацию для природной аминокислоты – аланина. Природная аминокислота относится к L-ряду и может быть представлена следующей проекцией Фишера:
CH3-C*H(NH2) –COOH
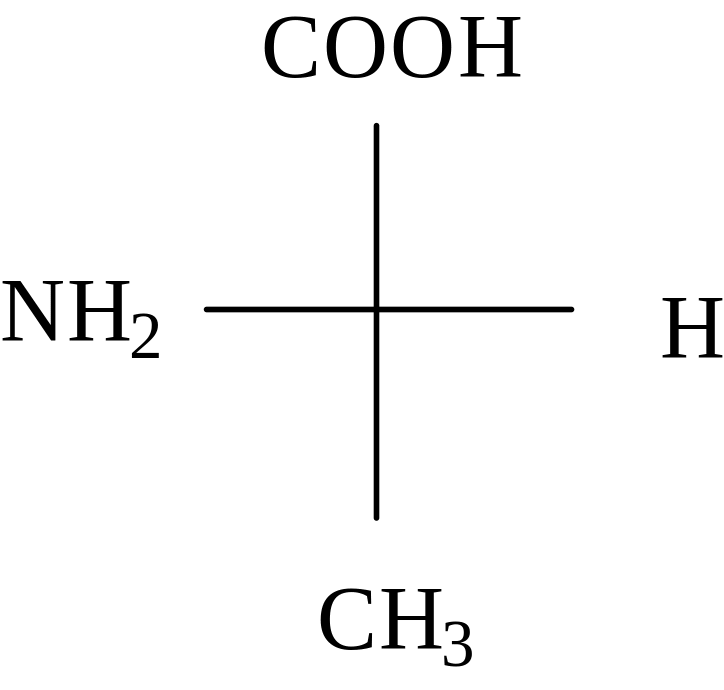 L
ряд
L
ряд
Хиральный атом связан непосредственно с атомами водорода, азота и двумя атомами углерода. Таким образом можно определить самый старший заместитель ( амино-группа) и самый младший (водород). Два других заместителя (CH3 и COOH ) имеют одинаковый атомный номер. Для определения их старшинства необходимо учитывать атомные номера атомов, с которыми непосредственно связаны эти заместители. COOH>CH3, и мы получаем такой ряд старшинства заместителей: NH2 > COOH > CH3 > H
Чтобы обозначить конфигурацию аланина в системе “R,S,” необходимо преобразовать проекцию Фишера. Для этого производим первую перестановку, меняя местами H и CH3 (младший заместитель должен быть внизу). Смотрим на проекцию, старшинство не нарушено, но мы сделали одну перестановку (запрещено правилами пользования проекциями Фишера), поэтому мы обязаны сделать вторую (меняем местами группы NH2 и CH3). Мы сделали четное число операций, первая и последняя проекция изображают один и тот же стереоизомер. Определяем падение старшинства заместителей. В данном случае он происходит против часовой стрелки. Природный аланин по системе “R,S” называется 2-(S) -аминопропановая кислота.
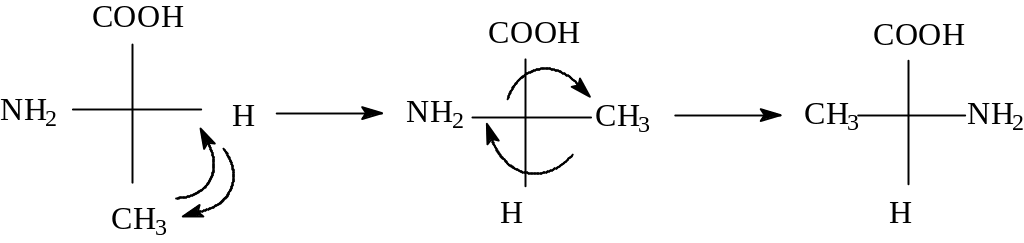 L
после 1пере- после 2-ой
S
L
после 1пере- после 2-ой
S
становки перестановки
С помощью этой номенклатуры можно дать название для любой молекулы. Так, приведенные выше 2,3-дигидроксибутандиовые кислоты могут быть названы следующим образом: 1- 2(R),3(R) -дигидроксибутандиовая-1,4-кислота; 2-2(S)3(S)-дигидроксибутандиовая-1,4-кислота и 3 изомер- мезовинная кислота- 2-(R),3(S)- дигидроксибутандиовая -1,4-кислота.
Разделение рацемата на энантиомеры.
Уже говорилось выше, что в природе встречаются оптически активные соединения. Однако в процессе химической реакции получается рацемат, содержащий равные количества двух энантиомеров. При этом возникает проблема разделения рацемата на энантиомеры. Известны специальные приемы, называемые методами разделения рацематов.
1 .Кристаллографический. В 1848 году Л.Пастер обнаружил, что из водных растворов натриево - аммониевой соли виноградной кислоты (рацемат (+)- и (-) -винных кислот) при определенных условиях выпадают кристаллы двух типов, отличающиеся друг от друга как предмет и его зеркальное отображение. Пастер разделил эти кристаллы механическим путем и получил в чистом виде соли (+) винной кислоты и (-) винной кислоты. Этот метод получил название метода Пастера. Однако этот метод удается применить не всегда. В настоящее время известно около 300 пар энантиомеров, способных к такой кристаллизации
2.Биохимический метод. Этот метод основан на высокой избирательности работы фермента. Ферменты, имеющиеся в живых организмах, способны катализировать превращения стереоизомера лишь с одной, вполне определенной конфигурацией хирального центра (обычно того, который встречается в природе). Рассмотрим использование этого метода для разделения рацемата аминокислоты. В начале на рацемат действуют ацилирующим агентом ( например, вводят ацетильную группу). При этом получают рацемат, состоящий из N -ацетильных производных (+) - и (-)- аминокислоты. Затем ацетильные производные подвергают ферментативному гидролизу в присутствии фермента ацилазы. Производные природной кислоты гидролизуются под действием фермента. В результате получают смесь природной аминокислоты и N-ацетильное производное другого энантиомера. Эту смесь легко разделить. Так, свободная аминокислота растворяется в разбавленных кислотах, в то время как N-ацетильное производное - не растворяется.
а
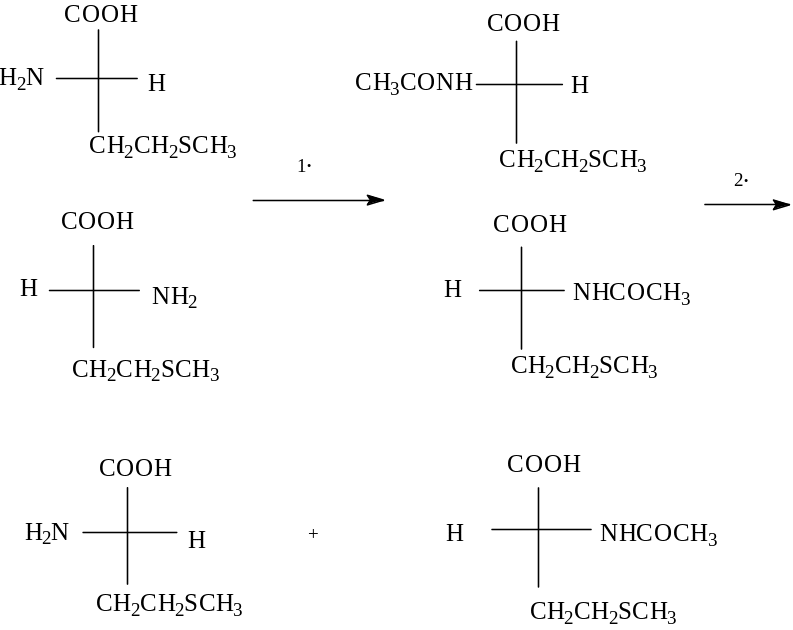 цетилирование
цетилированиегидролиз в присутствии фермента ацилизы.
L(-)-метионин N-ацетил (+)-метионин
3.Химический способ. Сущность метода заключается в получении из пары энантиомеров диастереомеров, разделение которых основано на различии их свойств. Но и этот метод требует использования природного оптически активного вещества.
1.3.4 Цис-транс изомерия
Относительно свободное вращение, возможное вокруг простой связи, не осуществляется в случае соединений с двойной связью, так как это требует разрыва старой и образования новой - связи, что может произойти только в жестких условиях - при высоких температурах или при облучении ультрафиолетовым светом. В связи с этим соединения, содержащие у атомов углерода, связанных двойной связью, хотя бы по одному разному заместителю, могут существовать в виде двух стереоизомеров. Так как соединения с двойной связью плоские (sp2- гибридизация атома углерода), то заместители могут быть расположены по одну сторону от двойной связи, либо по разные стороны.
ав С=С ав
Е сли
одинаковые заместители расположены по
одну сторону от
- связи, то такой изомер называется
цис-изомером, если по разные - то транс-
изомером. Цис,-транс-изомеры - это
конфигурационные изомеры, так как они
отличаются различным расположением
атомов в пространстве. Например:
сли
одинаковые заместители расположены по
одну сторону от
- связи, то такой изомер называется
цис-изомером, если по разные - то транс-
изомером. Цис,-транс-изомеры - это
конфигурационные изомеры, так как они
отличаются различным расположением
атомов в пространстве. Например:
цис-изомер транс-изомер
ц ис-бутен-2
транс-бутен-2
ис-бутен-2
транс-бутен-2
Но эта номенклатура может быть использована только для обозначения изомеров, имеющих одинаковые заместители. В общем случае, при наличии разных заместителей при атомах углерода, связанных двойной связью, используется Z, E - номенклатура, основанная на старшинстве заместителей, определяемом по атомному номеру заместителя. Если старшие заместители расположены по одну сторону от двойной связи - то такому изомеру приписывается символ Z ( от немецкого слова zusammen -вместе) если по разные - то символ E (от немецкого – entgegen - напротив), например:

Z - 1-бром--1-фтор-2-хлорэтен Е- 1-бром-1-фтор-2-хлорэтен
Аналогично, цис-бутен-2 получает название: Z-бутен-2, а транс-бутен-2 : Е-бутен-2.
Так как цис -, транс - изомеры отличаются различным взаимным расположением заместителей относительно друг друга, то такие изомеры различаются физическими и химическими свойствами. Один из изомеров, как правило транс-изомер, более устойчив. Этим объясняют распространенность транс-изомеров в природе. Температура кипения цис-изомера выше, чем транс-изомера. Цис-изомер менее симметричен, и поэтому его упаковка в кристаллической решетке менее плотная, что обусловливает, как правило, более низкую температура плавления цис-изомера (табл.). Для того, чтобы приписать цис- или транс-строение определенному изомеру, используют данные по измерению дипольного момента. Дипольный момент транс-изомера всегда меньше ( или равен нулю при одинаковых заместителях ) дипольного момента цис-изомера.
Таблица
Физико-химические свойства бутен-2-диовых-1,4-кислот.
Кислота |
Т.пл., 0 С |
Растворимость в воде |
рК а 1 |
цис-бутен-2-диовая-1,4 (малеиновая) |
130,5 |
1:2 |
2,4 |
транс-бутен-2-диовая-1,4 (фумаровая) |
287 |
1:150 |
3,1 |
Ц ис,-транс-изомерия
возможна и для циклических соединений,
в которых свободному вращению препятствует
цикл. В этом случае заместители могут
располагаться по одну - цис-изомер, или
по разные стороны от плоскости цикла -
транс-изомер. Пример цис, - транс-изомерии
для циклических соединений
ис,-транс-изомерия
возможна и для циклических соединений,
в которых свободному вращению препятствует
цикл. В этом случае заместители могут
располагаться по одну - цис-изомер, или
по разные стороны от плоскости цикла -
транс-изомер. Пример цис, - транс-изомерии
для циклических соединений
цис- 1,2 –дибромциклобутан транс-1,2-дибромциклобутан
