
Соединения лантаноидов
Соединения Э (III). Для лантаноидов в степени окисления +3 известны многочисленные бинарные соединения (Э2О3, ЭНаl3, Э2S3. ЭN, ЭH3) и разнообразные соли. Энтальпии и энергии Гиббса образования однотипных соединений лантаноидов близки; например, Gof их кристаллических трихлоридов имеют следующие значения (кДж/моль):
Н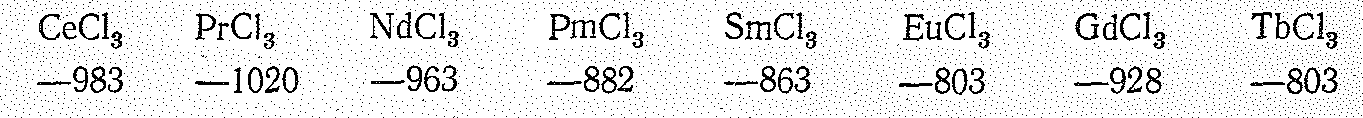 изкие
значения энтальпии атомизации
тригалогенидов европия (4f76s2)
и иттербия (4f146s2)
указывают на увеличение стабильности
электронной конфигурации 4f14
(полное заполнение 4f-уровня)
и 4f7
(наибольшее число непарных 4f-электронов).
Это находит квантовомеханическое
объяснение. Достаточно высокую энергию
связей обеспечивают 6s-
и 5d-электроны.
Привлечение же для образования связей
глубже расположенных 4f-электронов
вызывает снижение энтальпии атомизации.
Особенно это сказывается в случае
наиболее стабильных конфигураций f7
и f14.
изкие
значения энтальпии атомизации
тригалогенидов европия (4f76s2)
и иттербия (4f146s2)
указывают на увеличение стабильности
электронной конфигурации 4f14
(полное заполнение 4f-уровня)
и 4f7
(наибольшее число непарных 4f-электронов).
Это находит квантовомеханическое
объяснение. Достаточно высокую энергию
связей обеспечивают 6s-
и 5d-электроны.
Привлечение же для образования связей
глубже расположенных 4f-электронов
вызывает снижение энтальпии атомизации.
Особенно это сказывается в случае
наиболее стабильных конфигураций f7
и f14.
В отличие от d-элементов координационные числа f-элементов могут превышать 9 и достигать 10—14, что объясняют участием в образовании связей f-орбиталей. Высокие координационные числа более характерны для атомов f-элементов начала семейства, для завершающих семейство элементов наиболее типична октаэдрическая структура комплексов.
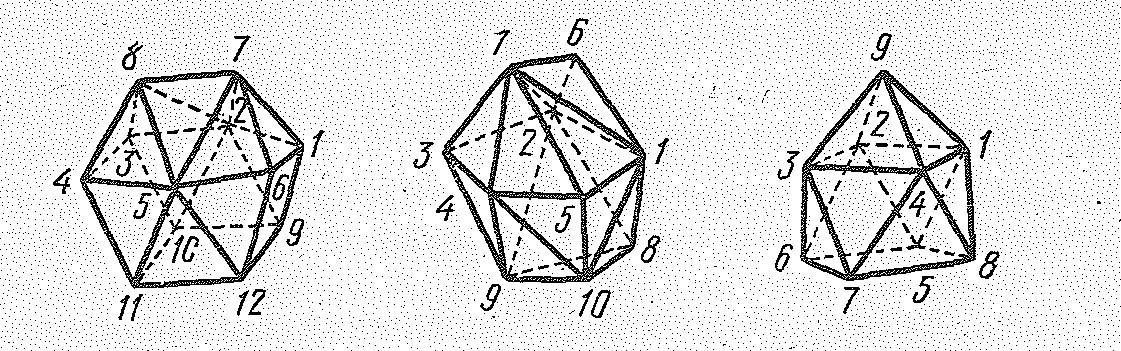
Рис. 2. Некоторые типы полиэдров, отвечающие характерным координационным числам лантаноидов (III)
Окраска ионов Э3+ закоиомерно изменяется в соответствии с большей или меньшей стабилизацией 4f-состояния. Так, ионы с электронной конфигурацией 4f0, 4f7 и 4f14, а также 4f1 и 4f13 бесцветны, остальные имеют более или менее интенсивную окраску. Окраска ионов Э3+ обусловлена f—f-переходом. Поскольку 4/-электроны эффективно экранированы от внешних воздействий 5s2 и 5р6-подслоями, окраска ионов не зависит от природы их координационного окружения.
Оксиды лантаноидов Э2О3 характеризуются высокими энтальпиями и энергиями Гиббса образования (Gof = —1600 кДж/моль) и тугоплавкостью (Тпл. порядка 2000 оС). Оксиды — основные соединения. В воде они практически не растворяются, но взаимодействуют с ней, образуя гидроксиды и выделяя тепло. Оксиды Э2О3 хорошо растворяются в НСl и НNO3, но, будучи прокалены, как и Аl2O3, теряют химическую активность. Со щелочами не взаимодействуют. Окраска оксидов определяется электронной конфигурацией иона Э3+.
Гидроксиды Э(ОН)3 получают в виде аморфных осадков по обменным реакциям. Согласно с уменьшением радиусов в ряду Се3+—Lu3+ несколько ослабляется основной характер гидроксидов, падает их термическая устойчивость и уменьшается растворимость. Так, произведение растворимости Lа(ОН)3 ПР = 1,010-19, Се(ОН)3 и Рr(ОН)3 ПР = 10-20 и далее уменьшается, достигая у Lu(ОН)3 ПР = 2,510-24.
Из солей лантаноидов (III) в воде растворимы хлориды ЭСl3, нитраты Э(NО3)3, сульфаты Э2(SO4)3, трудно растворимы фториды ЭF, карбонаты Э2(СО3)3, фосфаты ЭРО4.
Кристаллогидраты лантаноидов (III) имеют переменное количество молекул воды, например Э(NО3)36Н2O, ЭВr36Н2O, Э2(SО4)38Н2О, Nd(ВiО3)39Н2O. Окраска аквокомплексов зависит от электронной конфигурации нона Э3+.
Для лантаноидов (III) довольно типичны двойные соли, например 3Mg(NО3)22Э(NО3)324Н2O, M1+2Э(NО3)54Н2O, 3Nа2SО4Э2(SО4)312Н2O. Ион [Се(NО3)6]3- имеет форму двенадцативершинника (по атомам О), ион iСе(NО3)5]2- — форму десятивершинника, а ион [Nd(OН2)9]3- — девятивершинника. Весьма разнообразны комплексы лантаноидов с лигандами хелатного типа.
Для лантаноидов (III) известны различные комплексы с органическими лигандами, которые играют большую роль при разделении РЗЭ.
Гидриды лантаноидов образуются при взаимодействии простых веществ, которое протекает при нагревании (300—400 оС), достаточно активно. Все лантаноиды образуют гидриды состава ЭН2, а также, за исключением европия и иттербия, соединения, приближающиеся к составу ЭН3 . Особенности поведения Еu и Yb, по-видимому, связаны с устойчивостью 4f7- и 4f14-конфигураций.
Гидриды ЭH2 построены по типу флюорита и имеют солеобразный характер. Они в большей мере напоминают ионные гидриды щелочноземельных металлов, а с гидридами d-элементов имеют мало общего. Водородные соединения лантаноидов — химически весьма активные вещества, очень энергично взаимодействуют с водой, кислородом, галогенами и другими окислителями. Особо реакционноспособны соединения типа ЭН3.
Благодаря высокой температуре плавления оксиды, сульфиды, нитриды и карбиды лантаноидов используются для изготовления огнеупорной керамики. Разнообразно применение соединений лантаноидов в производстве специальных стекол.
Соединения Э (IV). Как уже указывалось, степень окисления +4 характерна для церия и может проявляться у тербия и празеодима. У церия (IV) выделены оксид СеO2 (светло-желтый), фторид СеF4 (белый), гидроксид Се(НО)2 (желтый), немногочисленные соли Се(СlO4)4, Се(SO4)2. Диоксид СеO2 образуется при непосредственном взаимодействии простых веществ или при термическом разложении некоторых солей церия (III) в присутствии кислорода. Он тугоплавок (Тпл. 2500 °С). Прокаленный СеО2 химически довольно инертен, не взаимодействует с кислотами и щелочами.
Гидроксид Се(ОН)4 получается по обменной реакции в водном растворе в виде студенистого осадка переменного состава СеО2nН2О. В отличие от Се(ОН)3 он проявляет амфотерные признаки. При растворении СеО2nН2О в кислотах образуются растворы оранжевого цвета, обусловливаемого окраской аквокомплексов [Се(ОН2)n]4+. Химия водных растворов Се(IV) аналогична химии Zr (IV) и Hf (IV). За немногим исключением соли церия (IV) неустойчивы, в воде сильно гидролизуются. Более устойчивы двойные соли церия (IV). Так, из азотнокислого раствора кристаллизуется соль (NН4)2[Се(NО3)6]2Н2O (оранжево-красного цвета). Ион [Се(NО3)6]2- имеет форму икосаэдра, (Се4+ окружен 12 атомами О), т. е. NO3--ион выступает. в качестве дидентатного лиганда.
При сплавлении СеО2nH2O со щелочью, а СеF4 с КF образуются соответственно оксо- и фтороцераты (IV):
2NaOH + СеO2 = Nа2СеО3 + Н2O
2КF + СеF4 = К2СеF6
В кислых растворах соединения церия (IV) выступают как довольно сильные окислители (ЕoСе4+/Се3+ = 1,61 В), например, окисляют концентрированную соляную кислоту:
2Се(ОН)4 + 8НСl = 2СеСl3 + Сl2 + 8Н2O
Соединения празеодима (IV) и тербия (IV) малостойки, являются сильными окислителями.
Соединения Э (II). Степень окисления +2 наиболее отчетливо проявляется у европия. Производные Еu (II), Sm (II), Yb (II) напоминают соединения элементов подгруппы кальция. Оксиды ЭО и гидроксиды Э(ОН)2 — основные соединения. Сульфаты ЭSO4, как и ВаSo4, в воде нерастворимы.
Европий часто встречается в составе минералов элементов подгруппы кальция. Минералы же, содержащие РЗЭ в состоянии окисления +3, европием обычно бедны. Этот факт также свидетельствует о достаточной устойчивости у европия степени окисления +2.
Производные лантаноидов (II) являются восстановителями.
f – элементы 6-го периода периодической системы
В семейство актиноидов входят торий Тh, протактиний Ра, уран U, нептуний Nр, плутоний Рu, америций Аm, кюрий Сm, берклий Вk, калифорний Сf, эйнштейний Еs, фермий Fm,, менделевий Md, нобелий Nо и лоуренсий Lu.
Уран U, торий Тh и протактиний Ра содержатся в земной коре. Остальные актиноиды в природе не встречаются (за исключением ничтожных количеств нептуния и плутония) и были получены в 1940—1961 гг. искусственным путем с помощью ядерных реакций. Все актиноиды радиоактивны. При этом чем тяжелее ядро, тем более заметной становится роль спонтанного деления ядер. Если период полураспада при спонтанном делении урана составляет примерно 1018 лет, то для плутония он равен 1010 годам, для кюрия — 106 годам, для калифорния — порядка 1 года, для фермия — нескольким часам. Для наиболее устойчивого изотопа нобелия 256Nо — 1500 с. В настоящее время возможности получения 93NpР и 94Рu исчисляются в килограммах; 95Аm и 96Сm — в десятках граммов, 97Bk и 98Сf — в миллиграммах, 99Еs — в микрограммах; остальные актиноиды — лишь в «штуках» атомов. В соответствии с этим из актиноидов лучше других изучены первые семь элементов семейства. Сведения об о стальных элементах получены при изучении в основном поведения их ионов в растворах и по некоторым косвенным данным. Химическое изучение актиноидов существенно затрудняется радиоактивным распадом и радиоактивными излучениями, вызывающими химические изменения в изучаемых системах.
Согласно спектроскопическим, химическим и другим данным в атомах наиболее тяжелых элементов периодической системы 7s-, 6d- и 5f-состояния энергетически очень близки друг к другу. Поэтому однозначное определение их электронной конфигурации затруднено. Так, у протактиния, для которого основное состояние можно представить в виде электронной конфигурации [Rn] 5f26d17s2, это состояние настолько близко к состояниям 6d37s2, 5f16d27s2 или 5f37s2, что трудно установить однозначно, какое из них лучше передает электронную конфигурацию атома протактиния в невозбужденном (основном) состоянии. По мере увеличения порядкового номера элемента энергия связи 5f-электронов с ядром атома постепенно увеличивается, а энергия связи 6d-электронов понижается. Поэтому становится более выгодным переход 6d-электронов в 5f-состояние.
Вследствие особой близости 6d- и 5f-состояний элементы подсемейства тория (Тh—Сm) выступают как f- и как d-элементы и проявляют переменные степени окисления. По мере заполнения 5f-орбиталей электронные конфигурации атомов стабилизируются и переход 6d-электронов в 5f-состояние становится все более затрудненным. Поэтому элементы подсемейства берклия (Вk—Lr) ведут себя как типичные f-элементы и по свойствам близки к лантаноидам.
По аналогии с лантаноидами первые семь элементов семейства актиноидов можно объединить в подсемейство тория (Тh—Сm), а остальные семь элементов — в подсемейство берклия (Вk—Lr).
В соответствии с вышесказанным в ряду актиноидов наблюдается сначала (от Тh до Рu) повышение, а затем (от Рu до Сf) постепенное понижение высшей степени окисления:
К оординационные
числа актиноидов весьма разнообразны
— от 4 до 12.
оординационные
числа актиноидов весьма разнообразны
— от 4 до 12.
