
Измерение рН.
Активность водородных ионов для удобства обычно выражают единицах рН:
рН = —Ig ан+
Следовательно, для реакции 2Н+ + 2е = Н2 полуэлемента давлением водорода 1 ат: ЕH2 = —0,0592рН.
Чистая
вода содержит ионы H+
и
ОН−
в разных концентрациях, находящихся
в равновесии с недиссоциированной
водой, поэтому можно рассчитать активность
как водородного иона, так и гидроксид
- иона, исходя из константы диссоциации,
значение которой при 25 °С составляет
1,01.10 −14.
Отсюда совершенно очевидно, что для
чистой воды при 25 °С
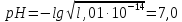 .
.
рH < 7 – кислая среда; pH > 7 – щелочная среда.
Диаграммы Пурбе.
М. Пурбе предложил представлять термодинамические данные, касающиеся электрохимического и коррозионного поведения металлов в водных средах, в форме компактных сводных диаграмм потенциал — рН. Такие диаграммы составлены для большинства распространенных металлов. Они наглядно показывают условия (области потенциалов и рН), при которых металл термодинамически устойчив (иммунность), либо может реагировать, образуя ионы, оксиды или комплексные соединения, и в этом их преимущество. Но диаграммы содержат только термодинамические данные, поэтому в них отсутствует информация о скоростях реакций.
Диаграммы указывают условия образования на поверхности
электрода
диффузионно-барьерных пленок, но не
содержат данных
об
их защитных свойствах в присутствии
специфических анионов, таких как
 или
или .
Они не содержат также сведений о
возможности образования пленок
нестехиометрического состава. Некоторые
из этих пленок существенно влияют на
скорость коррозии, однако отчетливо
показывают природу стехиометрических
соединений, в которые при достижении
равновесия
могут
превратиться любые менее устойчивые
соединения. Учитывая
вышеупомянутые
ограничения, диаграммы весьма полезны
.
Они не содержат также сведений о
возможности образования пленок
нестехиометрического состава. Некоторые
из этих пленок существенно влияют на
скорость коррозии, однако отчетливо
показывают природу стехиометрических
соединений, в которые при достижении
равновесия
могут
превратиться любые менее устойчивые
соединения. Учитывая
вышеупомянутые
ограничения, диаграммы весьма полезны
для описания равновесных состояний системы металл-вода
в кислых и щелочных средах как при наложении внешней
поляризации, так и без нее.
Диаграмма Пурбе для железа.

На рисунке каждая линия отвечает условиям термодинамического равновесия для некоторой реакции. Горизонтальные линия соответствуют реакциям, протекающим без участия ионов Н+ или ОН−. Вертикальная линия отвечает равновесию с участием ионов Н+ или ОН−, но без участия электронов. Наклонные линии соответствуют реакциям, в которых участвуют и ионы Н+ или ОН−, и электроны. Например, наклонная линия, разделяющая области существования Fe2+ и Fe2О3, отвечает реакции:
![]()
Вертикальный участок линии, разделяющий области существования Fe3+ И Fe2O3 соответствует реакции:
![]()
Следует подчеркнуть, что значения рН на диаграмме представляют собой рН растворов, непосредственно контактирующих с поверхностью металла. Эти значения в некоторых случаях, например, для Fe в аэрированной НаО, отличаются от рН в толще раствора.
Область
выделения кислорода располагается выше
линии b,
которая
отвечает реакции:

![]()
 могут
образовываться в очень щелочных растворах
в узком интервале отрицательных значений
потенциала, а растворимые ферраты
могут
образовываться в очень щелочных растворах
в узком интервале отрицательных значений
потенциала, а растворимые ферраты - в щелочных растворах при очень
положительных значениях потенциала,
однако область их стабильности
недостаточно точно определена.
- в щелочных растворах при очень
положительных значениях потенциала,
однако область их стабильности
недостаточно точно определена.
Когда
в реакции помимо Н+
и
ОН−
принимают участие другие ионы, их
активность в общем случае принята
равной 10
−6.
Таким образом, в согласии c
Fe=
Fe2+
+ 2 e,
ниже горизонтальной линии, проходящей через Е = - 0,62 В, железо практически не корродирует (содержание ионов Fe 2+ в растворе не превышает 10−6 моль/кг).
Области диаграммы, в которых устойчиво существуют Fe3O3 и Fe3O4, иногда называют областями пассивности, исходя из предположения, что на железе при этих значениях Е и рН образуются защитные оксидные пленки. Это справедливо только в той степени, в какой пассивность может быть обусловлена диффузионным барьером, создаваемым оксидным слоем. В реальных условиях в средах типа растворов H2SO4 или HNO3 линия, отвечающая Фладе-потенциалам, выше которых наблюдается пассивность железа, параллельна линиям а и b пересекает Е = 0,6 В при
рН = 0. Это указывает, что пассивирующая пленка видимо не представляет собой равновесный стехиометрический оксид железа.
