
- •Самостоятельная работа №2. Химическая термодинамика
- •Определите количество теплоты, которое выделяется (поглощается) при взаимодействии вещества so2 объемом 100м3.
- •Определите область температур, в которой возможно самопроизвольное протекание реакции в прямом направлении при стандартных состояниях всех веществ.
- •Задание 2.
- •Задание 3.
- •3.2. Используя значения Кр при разных температурах, определите термодинамические характеристики реакции (∆rH0т, ∆rS0т ∆rG0т). Какие допущения Вы сделали? Значения температуры выберите сами.
- •3.3. Рассчитайте значения Кр и Кс при температурах т1 и т2 и проанализируйте полученные значения.
- •3.4. Объясните влияние температуры и общего давления на равновесие Вашей реакции и величину константы равновесия.
3.3. Рассчитайте значения Кр и Кс при температурах т1 и т2 и проанализируйте полученные значения.
Решение:
Константы равновесия Кc и Кp связаны между собой соотношением:
Кc=Кp/(RT)Δν,
где Δν разность между суммой стехиометрических коэффициентов продуктов реакции и суммой стехиометрических коэффициентов исходных веществ.
Константу Кр для одной из температур можно рассчитать двумя способами, например, для Т=800К, из выражения:
rGT = -RTln(Кp) откуда Кp=exp(rG0T /(-RT))
Пренебрегая зависимостью энтальпии и энтропии от температуры, энергию Гиббса при Т=800К, можно выразить:
rG0800 = rH0298 – 800∙rS0298
Зависимость константы равновесия от температуры можно выразить уравнением изобары Вант Гоффа:
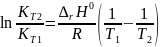
здесь
Т1=1000,
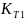 =
Кр1000;
Т2=800,
=
Кр1000;
Т2=800,
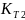 =
Кр800;
rH0=rH0298
=
Кр800;
rH0=rH0298

Кр800 =1,27∙105
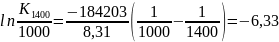
Кр1400 = 0,89
с ростом температуры Кp уменьшается.
Рассчитаем Кс: Кc=Кp/(RT)Δν
Для данной реакции Δν= 1-2= -1, следовательно
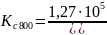

3.4. Объясните влияние температуры и общего давления на равновесие Вашей реакции и величину константы равновесия.
Ответ:
Влияние температуры и общего давления на равновесие системы объясняется на основании принципа Ле Шателье: если на систему, находящуюся в истинном равновесии, воздействовать извне, то равновесие смещается в сторону уменьшения эффекта внешнего воздействия, т.е.:
- при увеличении общего давления, равновесие смещается в сторону образования меньшего числа моль газообразных реагентов: так как в данной реакции количество моль газообразных продуктов уменьшается, то при увеличении давления равновесие смещается в сторону продуктов реакции;
- согласно расчетам в задании 3.2 rH0298= -184,2кДж ˂ 0, то есть реакция является экзотермической, а по принципу Ле Шателье при увеличении температуры равновесие смещается в сторону эндотермической реакции, а, следовательно, влево в сторону уменьшения выхода продуктов.
Константа равновесия Кp зависит от температуры: с ростом температуры Кp уменьшаетя, т.к. rH0˂0, равновесие смещается влево.
3.5. Определите равновесные концентрации (моль/л) всех веществ при температуре Т2, если исходные концентрации соответствовали стехиометрическим соотношениям, продукты реакции в исходной смеси отсутствовали.
Решение:
Т2= 1400К (по условию).
Равновесными называются концентрации всех веществ в момент установления равновесия в системе. При этом концентрации исходных веществ уменьшились, а продуктов реакции – увеличились. Задачи такого типа удобно решать, составляя таблицу материального баланса:
С2Н2 + Н2 ↔ С2Н4 – уравнение реакции
-
Компоненты системы
C2H2
H2
C2H4
Нач. состав системы, с0
1
1
0
Изменение состава, ∆с
x
x
x
Равновесный
состав, сравн.
1-x
1-x
0+x
Запишем выражение для константы равновесия данной реакции:
Кс=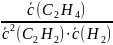 ,
в данное уравнение входят равновесные
концентрации компонентов (нижняя строчка
таблицы).
,
в данное уравнение входят равновесные
концентрации компонентов (нижняя строчка
таблицы).
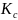 =
=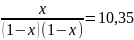
Решаем уравнение относительно х:

10,35x2 +21,7 x + 10,35 = 0
x
=

х = 1,363 – не подходит (значение х должно быть не больше 1 (по условию)
x = 0,734
Отсюда равновесные концентрации:
сравн(C2H2) = сравн(H2) = 0,266 моль/л
сравн (C2H4) = 0,734 моль/л
