
Электив в осеннем семестре по теме Виды катализа в биохимических реакциях
.docЭлектив по Общей химии в осеннем семестре по теме:
«Виды катализа в биохимических реакциях».
Катализ - явление изменения скорости реакции или возбуждения ее, происходящие под действием некоторых веществ, называемых катализаторами, которые, участвуя в процессе, сами к концу реакций остаются химически неизменными.
Катализаторы - вещества, изменяющие скорость химической реакции, которые могут участвовать в реакции, входить в состав промежуточных продуктов, но не входят в состав конечных продуктов реакции и после окончания реакции остаются неизменными.
Каталитические реакции - реакции, протекающие в присутствии катализаторов.
Реакции с участием катализаторов называются каталитическими. Количество реагирующего вещества, которое может испытать превращение в присутствии определённого количества катализатора, не ограничивается какими-либо стехиометрическими соотношениями и может быть очень большим. Этим каталитические реакции отличаются от индуцируемых, или сопряженных реакций, когда одна реакция вызывается или ускоряется (индуцируется) другой и происходит необратимое превращение вещества-индуктора. Возможные изменения катализатора при каталитических реакциях являются результатом побочных процессов, ни в коей мере не обусловливающих каталитическое действие.
Катализ принято называть положительным, когда катализатор уменьшает скорость реакции, и отрицательным, - когда катализатор уменьшает скорость реакции. Замедляющее действие отрицательных катализаторов нередко обусловливается тем, что они понижают активность положительного катализатора, отравляя его. Реакции, которые каталитически ускоряются продуктами, получаемыми в этой же реакции, называют автокаталитическими (самоускоряющимися). Скорость этих реакций возрастает во времени.
Катализатор не смещает химическое равновесие, а лишь облегчает или затрудняет достижение его, т.к. в обратимой реакции он в равной мере увеличивает скорость и прямого и обратного процесса, поэтому катализатор влияет только на скорость, с которой достигается равновесие.
Примеры:
Положительный - процесс окисления аммиака на платине при получении азотной кислоты;
Отрицательный - снижение скорости коррозии при введении в жидкость, в которой эксплуатируется металл, нитрита натрия, хромата и дихромата калия.
Катализаторы, замедляющие химическую реакцию, называются ингибиторами.
Действие катализатора может быть различным. В цепных реакциях положительные катализаторы могут облегчать возникновение цепей, отрицательные же могут действовать путем обрыва цепей. В некоторых других реакциях катализатор может образовывать с одним из реагирующих веществ промежуточное соединение, через которое те же конечные продукты получаются легче – с меньшей энергией активации.
В зависимости от того, находится катализатор в той же фазе, что и реагирующие вещества, или образует самостоятельную фазу и взаимодействие протекает на поверхности его, говорят о гомогенном или гетерогенном катализе.
Обычно различают две группы каталитических процессов: кислотно-основной (гетеролитический) и окислительно-восстановительный (гомолитический). В процессах первой группы происходит промежуточное кислотно-основное взаимодействие реагирующих веществ с катализатором, например переход протона от катализатора к реагирующим веществам или наоборот. На последующих стадиях протон перемещается в обратном направлении, и катализатор восстанавливает свой состав. При катализе апротонными кислотами взаимодействие осуществляется через свободную пару электронов реагирующего вещества. Примерами кислотно-основного катализа могут служить гидролиз сложных эфиров, ускоряемый кислотами; гидратация олефинов в присутствии фосфорно-кислотных катализаторов; изомеризация и крекинг углеводородов на алюмосиликатных катализаторах; алкилирование; полимеризация и многие другие реакции. При реакциях окислительно-восстановительного катализа промежуточное взаимодействие связано с электронными переходами между катализатором и реагирующими веществами. К этой группе относятся окисление двуокиси серы в трёхокись в производстве серной кислоты; окисление аммиака до окиси азота при получении азотной кислоты; многочисленные процессы парциального окисления органических соединений, например этилена в окись этилена, нафталина во фталевый ангидрид; гидрогенизация; дегидрогенизация; циклизация и ароматизация углеводородов; разложение перекиси водорода и многие др. Каталитической активностью в отношении окислительно-восстановительных реакций обладают преимущественно металлы 4-, 5- и 6-го периодов системы Д. И. Менделеева, имеющие недостроенную d-оболочку электронов, их соединения и в меньшей мере соединения элементов с достраивающейся f-оболочкой (лантаноиды и актиноиды).
Катализ кислотами и основаниями.
1) Катализ кислотами имеет самые глубокие исторические корни:
XV век: алхимики
спирт эфир
1668 г.: Бехер
спирт «маслородный газ»
1759 г.: Шееле
спирт + уксус фруктовая эссенция
1811 г.: Кирхгоф
крахмал сахар
2) Впервые на примере реакции Кирхгофа дано объяснение ускорения реакции кислотой исходя из химических принципов (1812 г.).
3) Наиболее простая классификация
а) гомогенные: минеральные кислоты, щелочи, органические кислоты и основания, галогениды металлов и неметаллов, гетерополикислоты и суперкислоты в растворах;
б) гетерогенные: алюмосиликаты, цеолиты, минеральные кислоты и основания на носителях, оксиды металлов, ионообменные смолы, твердые гетерополикислоты и суперкислоты;
в) бренстедовские: вещество, способное выступать донором протона (кислота) или акцептором протона (основание);
г) льюисовские: вещество, способное быть акцептором пары электронов (кислота) или донором пары электронов (основание).
4. Наиболее простые принципы действия активного центра
а) Сила протонной кислоты
![]()
б) Кислотность разбавленных протонных кислот
![]()
в) Кислотность концентрированных растворов
![]()
где B — основание-индикатор
Шкала кислотности

-12
7
26
г) При гомогенном катализе активным центром в большинстве случаев является протон.
д) Типы кислотно-основного катализа
-
Специфический катализ
![]()
-
Общий катализ
![]()
AH — недиссоциированная кислота
В — недиссоциированное основание
Катализ кислотами и основаниями Льюиса.
Кислоты: Al(III); AlCl3; AlBr3; AlF3; ZnCl2; BF3 и т.п.
Основания: F–; J–; R2O; R2S; R3N и т.п.
Шкалы силы кислот и оснований Льюиса
качественная — КЖМКО
количественная — не существует единой шкалы силы апротонных кислот и оснований, аналогичной рКа, что ограничивает возможность предвидения каталитического действия.

Ферменты.
Ферменты – катализаторы белковой природы в биохимических реакциях.
Отличительные особенности от обычных катализаторов:
-
Проявляют каталитическую активность в довольно мягких условиях температур, давлений и кислотности среды
-
Проявляют высокую специфичность, избирательно ускоряя только вполне определенные биохимические реакции.
В ферментативных реакциях выделяют:
1. Субстрат фермента S – индивидуальное химическое вещество или тип веществ, на которое фермент оказывает специфическое каталитическое действие.
Собственно фермент (или энзим), Е – каталитически активное вещество, ускоряющее то или иное превращение субстрата. У всех ферментов есть активный центр – та часть белковой молекулы, на которой происходит сам процесс катализа. Также есть аллостерический центр – участок белковой молекулы, на которую способны оказывать действие различные ингибиторы или активаторы, переход молекулы из неактивной формы в активную осуществляется по этому центру.
Классификация:
-
Гидролаза – гидролиз.
-
Оксидоредуктаза – осуществляют ОВР
-
Лиазы – осуществляют реакции образования == или присоединения по ==.
-
Лигазы (синтетазы) – осуществляют синтез (создание новых сигма-связей)
-
Изомеразы – переход изомеров друг в друга.
-
Трансферазы – перенос группы атомов от одной молекулы к другой.
Механизм ферментативного катализа:
S+E=SE=E+P
P- продукт реакции
Формула стационарной зависимости скорости ферментативной реакции от концентрации субстрата (уравнение Михаэлиса – Ментен):

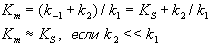
При формулировке кинетического выражения для скорости ферментативной реакции Михаэлис и Ментен сделали три допущения:
1) Стационарное состояние реакции в момент равновесия, когда скорости образования и расходования ES равны;
2) Весь фермент в условиях насыщающих концентраций субстрата превращается в энзимсубстратный комплекс ES;
3) Если весь фермент в виде ES, то скорость реакции максимальна и Vmax=k2[ES].
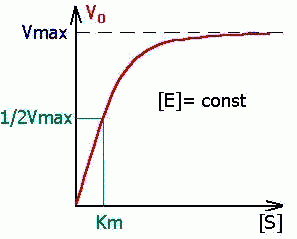
Кm – Константа Михаэлиса измеряется в молях на литр и бывает от 10-2 до 10-7, чем меньше Кm, тем активнее фермент.
ВЛИЯНИЕ ТЕМПЕРАТУРЫ И рН НА АКТИВНОСТЬ ФЕРМЕНТА
В общем, для ферментов имеется связь константы скорости и температуры, выражаемая: 2,3 lgK=B-Ea/RT, где Еа- энергия активации, В-частота столкновений. Однако, указанная зависимость прямолинейна лишь на ограниченном отрезке, так как с ростом температуры наблюдается денатурация фермента. Зависимость активности фермента от рН также проходит через максимум. Кислотность среды влияет на заряды в молекуле фермента и, тем самым, на его способность к связыванию субстрата.
