
- •Раздел 1. Введение в курс.
- •Комплексное использование сырья
- •Совершенствование методов выделения целевых продуктов и очистки всех потоков, которые попадают в окружающую среду.
- •Комбинирование производств
- •Повышение степени энергосбережения на предприятиях химической промышленности
- •Создание агрегатов большой единичной мощности
- •Интенсификация хтп
- •Раздел 2. Разработка химической концепции метода.
- •Время пребывания исходных веществ в реакционной зоне.
- •Объемная скорость
- •Алгоритм разработки химической концепции хтп
- •Термодинамический анализ
- •Изобарно-изотермический потенциал (энергия Гиббса)
- •Связь константы с равновесным выходом
- •Связь константы равновесия с энергией Гиббса
- •Анализ зависимостей изменения константы равновесия от температуры при различных знаках ∆н и ∆s реакции.
- •Качественная оценка условий проведения процесса.
- •Влияние температуры
- •Влияние соотношения реагентов на их степень превращения и выход продукта
- •Соотношение реагентов – стехиометрическое
- •Один из реагентов - в избытке
- •Влияние величины общего давления
- •Влияние введения в систему инертного компонента (d), при сохранении величины общего давления
- •Вывод продукта из зоны реакции
- •Понятие элементарной реакции
- •Простые по механизму и стехиометрически простые реакции
- •Зависимость константы скорости элементарной реакции от температуры
- •Зависимость дифференциальной селективности от концентраций реагирующих веществ
- •Зависимость дифференциальной селективности от температуры
- •Особенности кинетики окисления оксида азота (II) в оксид азота (IV)
- •Скорость обратимых реакций
- •Обратимая эндотермическая реакция
- •Раздел 3. Химическое производство как химико-технологическая система (хтс).
- •Раздел 4. Основные принципы разработки хтс и способы их реализации.
- •Принцип наилучшего использования сырья.
- •Избыток реагентов ускоряет как химическую, так и диффузионную стадии процессов.
- •Подавление побочных реакций.
- •Принцип наибольшей интенсивности процесса.
- •Принцип наилучшего использования энергии.
- •Принцип экологической безопасности химических производств.
- •Раздел 5. Реализация основных принципов разработки и организации хтс на примерах конкретных производств.
- •Производство технологических газов конверсией метана.
- •Паровая конверсия
- •Термодинамика процесса
- •Кинетика процесса
- •Выбор оптимальных условий для проведения паровой конверсии метана
- •Катализатор и температура
- •Соотношение исходных веществ
- •Паровоздушная конверсия метана
- •Паровая конверсия монооксида углерода
- •Термодинамика процесса
- •Кинетика процесса
- •Выбор оптимальных условий для проведения паровой конверсии монооксида углерода
- •Катализаторы и температура
- •Соотношение исходных веществ
- •Очистка от диоксида углерода
- •Моноэтаноламиновая очистка
- •Карбонатная очистка
- •Очистка от монооксида углерода
- •Промывка жидким азотом
- •Тонкая очистка метанированием
- •Катализаторы синтеза аммиака.
- •Производство метанола.
- •5.6. Производство этанола.
-
Влияние величины общего давления
Влияние давления на состояние равновесия проявляется только при наличии в системе газов и определяется соотношением числа молей исходных веществ и продуктов реакции.
Повысим
при стехиометрическом соотношении
исходных реагентов общее давлении в
системе в 10 раз (Р = 10). Подставляя в
формулу (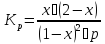 )
значения Кр
= 1 и Р = 10 получаем выражение:
)
значения Кр
= 1 и Р = 10 получаем выражение:
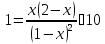
Корнем данного
уравнения будет х = 0,70 моль и соответственно:
ХА
=
 =
0,70 и
=
0,70 и
 0,70.
0,70.
Таким образом, увеличение давления в 10 раз приводит к увеличению выхода продукта примерно в 2,3 раза, что согласуется с принципом Ле-Шателье.
Понизим
общее давление в 10 раз (Р = 0,1), при том же
значении Кр
= 1, величина равновесного выхода составит
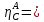 0,045, что также согласуется с принципом
Ле-Шателье.
0,045, что также согласуется с принципом
Ле-Шателье.
Чувствительность положения равновесия к изменению давления будет тем больше, чем больше изменение объема (числа молей) в ходе реакции.
-
Влияние введения в систему инертного компонента (d), при сохранении величины общего давления
|
|
А |
В |
С |
D |
|
Исходная смесь, моль |
1 |
1 |
0 |
10 |
|
Равновесная смесь, моль |
1–x |
1–x |
x |
10 |
Изменится общее количество молей веществ в равновесной системе:
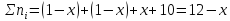
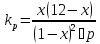
Решая соответствующее квадратное уравнение при Кр = 1, Р = 1, получаем ХА = 0,075, т.е. влияние введения инертного компонента на положение равновесия качественно совпадает с эффектом понижения давления.
Введение инертного компонента при постоянном общем давлении в системе понижает парциальные давления, как реагентов, так и продуктов реакции, что равнозначно понижению давления в системе.
Достоинством использования водяного пара в качестве инертного компонента является то, что он:
- дешев
- легко отделяется от продукта
- подавляет побочные реакции
- служит одновременно теплоносителем
-
Вывод продукта из зоны реакции
При селективном выводе продукта из зоны реакции за счет конденсации или абсорбции (реагенты остаются в зоне реакции) уменьшается парциальное давление продукта РС (для рассматриваемой реакции: А + В = С)
Следовательно, для сохранения KP = const должен уменьшиться и знаменатель, то есть исходные вещества должны прореагировать. Другими словами – нарушается равновесие между скоростью прямой и обратной реакции (последняя напрямую зависит от парциального давления продукта), и возникает движущая сила реакции.
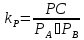
-
Использование законов химической кинетики при разработке ХТП.
Понятие элементарных реакций, простых по механизму и стехиометрии реакции. Закон действия масс. Кинетические уравнения. Влияние температуры и концентрации реагирующих веществ на скорость процесса. Кинетика сложных гомогенных процессов. Влияние температуры и концентраций исходных веществ на дифференциальную селективность. Кинетика гомогенного окисления оксида азота(II) в оксид азота(IV). Особенности кинетики обратимых эндо- и экзотермических реакций.
