
- •1. Общая характеристика свойств металлических материалов. Методы исследования строения металлов и сплавов.
- •2. Атомно-кристалическая структура металла. Элементарные ячейки.
- •3. Несовершенства кристаллической решетки реальных металлов.
- •4. Процесс кристаллизации металлов.
- •5.Строение металлического слитка. Особенности строения литого и деформированного металла.
- •6.Полиморфные превращения в металлах.
- •7. Строение типовых двухкомпонентных сплавов.
- •8. Общие сведения о диаграммах состояния. Правило фаз.
- •9.Диаграммы состояния двухкомпонентных сплавов с полной растворимостью компонентов в твердом и жидком состоянии.
- •10. Диаграммы состояния двухкомпонентных сплавов с ограниченной растворимостью компонентов в твердом состоянии и наличии эвтектического превращения.
- •11. Диаграммы состояния двухкомпонентных сплавов с ограниченной растворимостью компонентов в твердом состоянии и наличии перитектического превращения.
- •12. Диаграммы состояния двухкомпонентных сплавов, образующих химическое соединение.
- •13. Связь диаграмм состояния с механическими и технологическими свойствами сплавов.
- •14. Диаграмма состояния железо-цементит (Fe-Fe3c). Основные фазы и структурные составляющие.
- •1. Перетектическая реакция
- •4. Цементит.
- •15. Стабильная диаграмма состояния железо-графит.
- •16. Фазовые превращения при вторичной кристаллизации доэвтектоидных, эвтектоидных и заэвтектоидных сталей.
- •17. Фазовые превращения при вторичной кристаллизации доэвтектоидных, эвтектоидных и заэвтектоидных сталей.
- •18. Серые чугуны. Структура, свойства, область применения.
- •19. Ковкие чугуны. Структура, свойства, область применения.
- •20. Высокопрочные чугуны. Структура, свойства, область применения.
- •22. Классификация, маркировка и применение углеродистых сталей.
- •Маркировка сталей
- •23. Структурные классы легированных сталей. Влияние легирующих элементов на полиморфизм железа.
- •24.Маркировка легированных сталей.
- •25. Перлитное превращение в стали.
- •30.Превращение при нагреве закаленной на мартенсит стали.
- •31.Нагрев при термообработке. Окисление и обезуглероживание поверхности стали.
- •32. Отжиг первого рода.
- •33. Отжиг второго рода и нормализация стали.
- •35.Отпуск стали (технология термообработки).
- •36. Прокаливаемость стали.
- •Схемы, показывающие различную скорость охлаждения по сечению и в связи с этим несквозную прокаливаемость.
- •37. Методы поверхностного упрочнения сталей. Закалка твч.
- •38. Процессы, происходящие при химико-термической обработке металла.
- •39.Цементация. Термообработка стали после цементации.
- •40.Азотирование стали.
- •41.Состав, назначение и термообработка улучшаемых сталей.
- •42.Корозионно стойкие и жаростойкие стали.
- •43.Инструментальные стали. Теплостойкость. Быстрорежущие стали.
- •45. Деформируемые алюминиевые сплавы, упрочняемые термообработкой.
- •46.Деформируемые алюминиевые сплавы, не упрочняемые термообработкой.
- •47.Литейные алюминиевые сплавы.
- •48.Титан и его сплавы.
- •49,50.Медь и сплавы на ее основе. Латуни. Бронзы.
- •51.Строение полимеров. Физическое состояние полимеров.
- •52. Состав, свойства и применение пластмасс.
- •53.Свойства и применение неорганических стекол и ситаллов.
- •XNa2o yCaO zSiO2 ....
- •54.Состав, свойства и применение технической керамики.
- •55.Композиционные материалы на металлической основе.
- •56. Композиционные материалы на неметаллической основе.
8. Общие сведения о диаграммах состояния. Правило фаз.
Диаграммы состояния показывают изменение состояния в зависимости от температуры и концентрации. Давление во всех случаях постоянно, а скорость охлаждения достаточно мала для протекания всех процессов. Фактор времени таким образом исключается. Диаграммы (равновесного) состояния строятся экспериментально по термическим кривым.
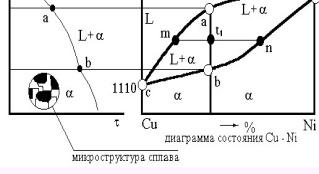
Построение диаграммы состояния Cu-Ni по термическим кривым. На рис. L - жидкий расплав; - твердая фаза из кристаллов Cu-Ni переменной концентрации; cad - линия ликвидуса; cbd - линия солидуса. Линия mn, соединяющая состав, находящийся в равновесии называется канодой.
В интервале температур ab выпадают кристаллы твердого раствора переменной концентрации. Состав выпадающих кристаллов показывает линия солидуса, состав оставшегося жидкого раствора линия ликвидуса. Сначала выпадают кристаллы, богатые никелем, как более тугоплавкие; в конце затвердевают кристаллы, богатые более легкоплавкой медью. В процессе затвердевания непрерывно происходит диффузия, которая стремится выравнить состав. Однако в реальных условиях она не успевает завершиться. После окончательного затвердевания всего сплава имеется неоднородность - ликвация (дендритная, междендритная, зональная).
Правило отрезков или правило рычага применяется для определения количественного соотношения фаз, находящихся в равновесии при данной температуре. Согласно этому правилу для определения весового или объемного количества твердой фазы необходимо взять отношение длины отрезка, примыкающего к составу жидкой фазы, к длине всей каноды. Для определения количества жидкой фазы берется отношение длины отрезка, примыкающего к составу твердой фазы, к длине каноды.
a = [ ( t1m ) / ( mn) ] * 100 Ж = [ ( t1n ) / ( mn ) ] * 100 %
Правило отрезков применимо не только к кристаллизующимся сплавам, но вообще ко всем двухфазным сплавам независимо от их агрегатного состояния.
9.Диаграммы состояния двухкомпонентных сплавов с полной растворимостью компонентов в твердом и жидком состоянии.
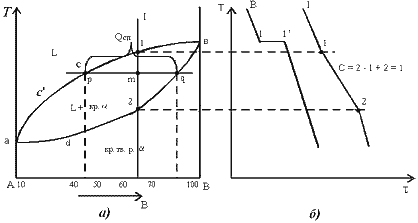
Проведем анализ полученной диаграммы.
1. Количество компонентов: К = 2 (компоненты А и В).
2. Число фаз: f = 2 (жидкая фаза L, кристаллы твердого раствора )
3. Основные линии диаграммы:
acb – линия ликвидус, выше этой линии сплавы находятся в жидком состоянии;
adb – линия солидус, ниже этой линии сплавы находятся в твердом состоянии.
4. Характерные сплавы системы:
Чистые компоненты А и В кристаллизуются при постоянной температуре, кривая охлаждения компонента В представлена на рис. 5.1,б.
Остальные сплавы кристаллизуются аналогично сплаву I, кривая охлаждения которого представлена на рис. 5.1, б.
Процесс кристаллизации сплава I: до точки 1 охлаждается сплав в жидком состоянии. При температуре, соответствующей точке 1, начинают образовываться центры кристаллизации твердого раствора . На кривой охлаждения отмечается перегиб (критическая точка), связанный с уменьшением скорости охлаждения вследствие выделения скрытой теплоты кристаллизации. На участке 1–2 идет процесс кристаллизации, протекающий при понижающейся температуре, так как согласно правилу фаз в двухкомпонентной системе при наличии двух фаз (жидкой и кристаллов твердого раствора ) число степеней свободы будет равно единице С=2-2+1=1. При достижении температуры соответствующей точке 2, сплав затвердевает, при дальнейшем понижении температуры охлаждается сплав в твердом состоянии, состоящий из однородных кристаллов твердого раствора .
5. Количественный структурно-фазовый анализ сплава.
Пользуясь диаграммой состояния можно для любого сплава при любой температуре определить не только число фаз, но и их состав и количественное соотношение. Для этого используется правило отрезков. Для проведения количественного структурно-фазового анализа через заданную точку проводят горизонталь (коноду) до пересечения с ближайшими линиями диаграммы (ликвидус, солидус или оси компонентов).
а). Определение состава фаз в точке m:
Для его определения через точку m проводят горизонталь до пересечения с ближайшими линиями диаграммы: ликвидус и солидус.
Состав жидкой фазы определяется проекцией точки пересечения горизонтали с линией ликвидус p на ось концентрации.
Состав твердой фазы определяется проекцией точки пересечения горизонтали с линией солидус q (или осью компонента) на ось концентрации.
Состав жидкой фазы изменяется по линии ликвидуса, а состав твердой фазы – по линии солидуса.
С понижением температуры состав фаз изменяется в сторону уменьшения содержания компонента В.
б). Определение количественного соотношения жидкой и твердой фазы при заданной температуре (в точке m):
Количественная масса фаз обратно пропорциональна отрезкам проведенной коноды.Рассмотрим проведенную через точку m коноду и ее отрезки.
Количество всего сплава (Qсп) определяется отрезком pq.
Отрезок, прилегающий к линии ликвидус pm, определяет количество твердой фазы.
Отрезок, прилегающий к линии солидус (или к оси компонента) mq, определяет количество жидкой фазы.
