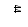- •Федеральное агентство по образованию
- •Гидродинамика и массообмен в газожидкостных потоках
- •Введение
- •1.1. Описание схемы экспериментальной установки и принципа работы ксиа
- •1.1.1. Описание конструкции модели ксиа и принципа
- •1.1.2. Описание экспериментальной установки
- •1.3. Методики проведения экспериментов
- •1.3.1. Методика определения условий устойчивой работы ксиа
- •1.3.2. Методика определения производительности ксиа
- •1.3.3. Методика экспериментального определения
- •2.1.1. Описание схемы экспериментальной установки
- •2.2. Методика проведения экспериментов
- •2.3. Обработка результатов эксперимента
- •3.2. Описание экспериментальной установки
- •Методика проведения работы
- •Порядок выключения установки
- •3.3. Методика отбора проб из газожидкостной смеси и расчет концентрации растворенного газа в жидкости
- •3.4. Определение концентрации растворенного диоксида углерода в воде
- •Методика определения объемного коэффициента массоотдачи в жидкой фазе в нисходящем потоке
- •4.2. Описание экспериментальной установки и методики проведения экспериментов
- •Содержание
- •Гидродинамика и массообмен в газожидкостных потоках
4.2. Описание экспериментальной установки и методики проведения экспериментов
Определение удельной поверхности контакта фаз выполняется на установке, представленной на рис. 4, которая состоит из трехтрубной модели КСИА, центробежного насоса 1, бака 7, регулирующего вентиля 2, жидкостного ротаметра 3, объемного счетчика газа 13.
Эксперимент проводится следующим образом: готовый раствор (Na2SO3) в объеме сорока литров заливают в бак, в который добавляют катализатор сернокислый кобальт (CоSO4). Для более полного перемешивания катализатора с раствором сульфита натрия, последний, в течение пяти минут, циркулируют через установку. При этом измеряют РН и температуру раствора. Если РН > 8,5, то в раствор добавляют немного серной кислоты. После установления необходимых начальных значений РН и температуры приступают к эксперименту, который заключается в отборе проб раствора из аппарата через определенные промежутки времени.
В процессе опыта контролируются следующие
параметры: температура, РН и расход
раствора Qж, а
также расход инжектируемого газа Qг.
Опытным путем установливается промежуток
времени
![]() ,
необходимый для отбора проб. Температуру
раствора определяют термометром марки
ТЛ с ценой деления 0,1С,
РН – автоматическим РН-метром марки
РН-673. Весь эксперимент выполняется в
следующем диапазоне концентраций и
температур:
,
необходимый для отбора проб. Температуру
раствора определяют термометром марки
ТЛ с ценой деления 0,1С,
РН – автоматическим РН-метром марки
РН-673. Весь эксперимент выполняется в
следующем диапазоне концентраций и
температур:
![]() (кмоль/м3)
(кмоль/м3)
![]() (кмоль/м3)
(кмоль/м3)
![]() С
С
![]() .
.
В этих пределах влияния концентрации
сульфита натрия на константу скорости
реакции
![]() не происходит.
не происходит.
Расчет УПКФ выполняется исходя из зависимости
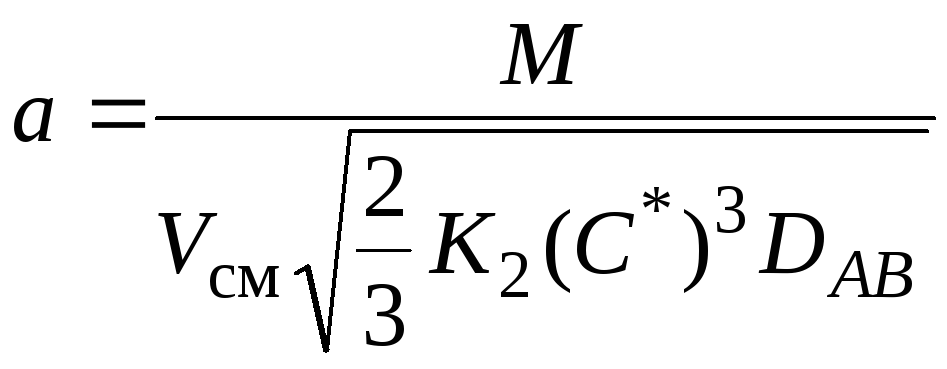 , (4.1)
, (4.1)
где
![]() – скорость абсорбции кислорода раствором,
кмоль/с;
– скорость абсорбции кислорода раствором,
кмоль/с;
![]() – константа скорости реакции, м3/кмольс;
– константа скорости реакции, м3/кмольс;
![]() –
равновесная концентрация кислорода в
растворе, кмоль/м3;
–
равновесная концентрация кислорода в
растворе, кмоль/м3;
![]() – коэффициент молекулярной диффузии
кислорода в водном растворе сульфита
натрия, м2/с.
– коэффициент молекулярной диффузии
кислорода в водном растворе сульфита
натрия, м2/с.
Константу скорости реакции
![]() рассчитывают по уравнению
рассчитывают по уравнению
![]()
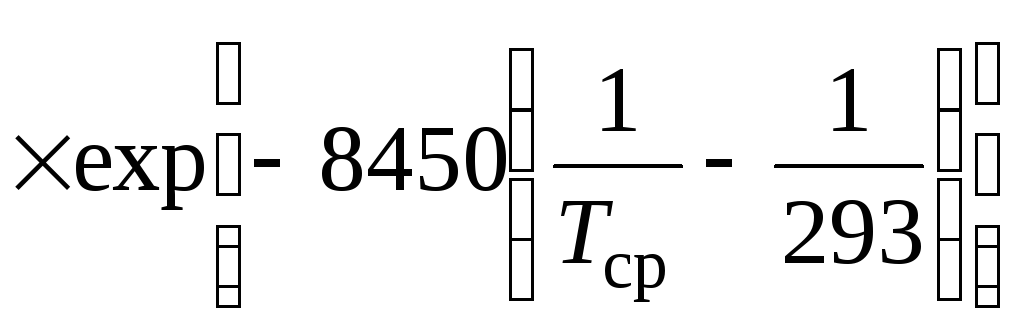 ,
(4.2)
,
(4.2)
где
![]() – средняя концентрация сульфита в
растворе за время
– средняя концентрация сульфита в
растворе за время
![]() ,
кмоль/м3;
,
кмоль/м3;
![]() – средняя температура раствора за
время, в градусах Цельсия и Кельвина
соответственно.
– средняя температура раствора за
время, в градусах Цельсия и Кельвина
соответственно.
Равновесная концентрация кислорода в водном растворе определяется из уравнения
![]() , (4.3)
, (4.3)
где
![]() – парциальное давление кислорода в
атмосферном воздухе, Па;
– парциальное давление кислорода в
атмосферном воздухе, Па;
![]() – универсальная газовая постоянная,
Пам3/Ккмоль.
– универсальная газовая постоянная,
Пам3/Ккмоль.
Константу Генри
![]() рассчитывали по уравнению
рассчитывали по уравнению
![]() .(4.4)
.(4.4)
Начальная и конечная концентрации
![]() и
и
![]() рассчитываются из данных иодометрического
титрования
рассчитываются из данных иодометрического
титрования
![]() , (4.5)
где
, (4.5)
где
![]() – объем йодного раствора, пошедшего на
титрование пробы, мл;
– объем йодного раствора, пошедшего на
титрование пробы, мл;
![]() – нормальность йодного раствора;
– нормальность йодного раствора;
![]() – объем тиосульфата натрия, пошедшего
на титрование пробы, мл;
– объем тиосульфата натрия, пошедшего
на титрование пробы, мл;
![]() – грамм-эквивалент сульфита натрия.
– грамм-эквивалент сульфита натрия.
Последовательность проведения эксперимента следующая.
1. Подготовленный в заданном объеме
водный раствор сульфита натрия заливается
в бак 7 и включается насос 1.
Вентилем 2 устанавливается заданный
расход жидкости, который измеряется
ротаметром 3. Раствор циркулирует
через установку до достижения требуемой
температуры (обычно 20°С). По достижении
требуемой температуры в бак 7 вручную
вносят предварительно отмеренную дозу
катализатора и продолжают рециркуляцию
жидкости через аппарат до полного
перемешивания раствора с катализатором
(примерно 10 минут). После этого приступают
к отбору проб. Проба отобранная в начале
первого промежутка времени
![]() будет иметь начальную концентрацию
сульфита натрия в растворе
будет иметь начальную концентрацию
сульфита натрия в растворе
![]() .
Проба отобранная в конце промежутка
времени
.
Проба отобранная в конце промежутка
времени
![]() – конечную концентрацию
– конечную концентрацию
![]() .
.
2. После проведения первого отбора проб
изменяется расход жидкости Q1
(обычно в сторону увеличения расхода)
и фиксируется начало отсчета времени
![]() .
Для второго промежутка времени
.
Для второго промежутка времени
![]() концентрация
концентрация
![]()
![]() .
.
3. Для установления зависимости удельной поверхности контакта фаз от интенсивности движения газожидкостной смеси необходимо выполнить не менее 7÷10 изменений расхода жидкости через сопло. При этом необходимо контролировать концентрацию сульфита натрия в растворе, чтобы она не выходила за рекомендованные выше пределы. (В процессе проведения эксперимента концентрация сульфита натрия будет уменьшаться).
Опытные данные заносятся в рабочий журнал, форма которого представлена в табл. 4.1.
Таблица 4.1
Дата эксперимента
"____"_______ 2009 г.
|
№ п/п |
Q1, м3/с |
t, °С |
PH |
Нсм1 |
Нсм2 |
Сн, кмоль/м3 |
Ск, кмоль/м3 |
τ1, с |
τ2, с |
Qг1, м3/с |
|
|
|
|
|
|
|
|
|
|
|
|
Расчетные данные сводятся в табл. 4.2, форма которой представлена ниже.
Получение зависимости а от гидродинамических условий проведения процесса массообмена ведут по различным соотношениям, включающих в себя, определяющие интенсивность массообмена, параметры. Например,
![]()
![]()
![]()
![]() .
.
Выбор зависимости определяется студентом, но он должен быть подробно мотивирован.
Таблица 4.2
|
№ п/п |
Q1, м3/с |
Qг1, м3/с |
v0, м/с |
Wж, м/с |
Wг, м/с |
К2, м3/кмоль·с |
С*, кмоль/м3 |
DAB, м2/с |
М, кмоль/с |
Nc, Вт |
φг |
Vж, м3 |
Vсм, м3 |
а, м2/м3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|