
- •Свойства растворов и гетерогенных систем
- •1.Общая характеристика. Концентрация растворов
- •Способы выражения концентрации растворов. Важной характеристикой растворов является концентрация.
- •2. Растворимость
- •3. Коллигативные свойства растворов
- •1) Повышение температуры кипения раствора пропорционально количеству молей растворенного вещества при условии, что количество молей растворителя постоянно:
- •Электрическая проводимость водных растворов. Электролиты
- •Теория сильных электролитов.
- •Роль рН в биологических жидкостях организма
- •Буферные растворы
- •Гидролиз солей
- •Закон действия масс в гетерогенных системах. Растворимость плохорастворимых электролитов.
Роль рН в биологических жидкостях организма
Синтез, распад и взаимопревращения (метаболизм) химических соединений в организме осуществляется с помощью белков-ферментов. Их насчитывается примерно 2 тысячи.
Ферменты наиболее активны в пределах узкой зоны рН и соответствуют области физиологических значений.
|
ферменты |
рН |
|
Крови ((холинэстераза, фосфатаза) |
7,37 |
|
Слюны (амилаза) |
6,9-7,8 |
|
Сока поджелудочной железы (липаза, трепсин) |
85 |
|
Желудочного сока (пепсин) |
1,5-2,5 |
Подсчитано, что в процессе метаболизма ежесуточно в организме образуется большое количество кислых продуктов. Это может привести к сдвигу рН крови, различных тканевых жидкостей мозга, печени, почек и др., что резко отразится на активности ферментов. Например, сдвиг рН крови на 0,4 единицы приводит к летальному исходу, рН слюны меньше 5 единиц способствует развитию кариеса.
Постоянство рН различных биологических жидкостей обеспечивается благодаря наличию в организме многочисленных регулирующих систем: легкие , кишечник, почки, кожа и др.
Буферные растворы
Буферными растворами называются растворы, сохраняющие неизменными значения рН, при разбавлении или добавлении в них небольшого количества сильной кислоты и щелочи.
Буферные растворы.
Для поддержания определенной величины pH в исследуемом растворе пользуются буферными системами. Это растворы, которые способны сохранять величину pH сравнительно постоянной при введении в раствор дополнительных объемов кислоты или щелочи.
Если в раствор сильной кислоты вводить соответствующий объем раствора щелочи, то в результате реакции концентрация H+ будет быстро снижаться, а величина pH расти. В ряде случаев это неприемлемо.
При многократном разведении раствора сильной кислоты или щелочи концентрация pH-определяющих ионов будет быстро изменяться. Для замедления этого изменения также используют буферные растворы.
Буферными обычно являются растворы, которые в качестве компонентов содержат слабую кислоту и ее соль или слабое основание и его соль, а также смеси солей многоосновных кислот различной степени замещения.
|
Состав буферной смеси (1:1) |
Название смеси |
pH |
|
HCOOH + HCOONa |
Формиатная смесь |
3,8 |
|
CH3COOH + CH3COONa |
Ацетатная смесь |
4,7 |
|
NaH2PO4 + Na2HPO4 |
Фосфатная смесь |
6,6 |
|
NH4OH + NH4Cl |
Аммиачная смесь |
9,25 |
Способность буферных систем поддерживать постоянство pH основана на том, что одна составная часть буферной системы может взаимодействовать с ионами H+, а другая – с ионами OH-. Вследствие чего буферная смесь может связывать как ионы водорода, так и гидроксил-ионы приливаемых кислот и оснований, и до определенного предела сохранять постоянство величины pH.
Буферная емкость характеризует количество моль-эквивалентов сильной кислоты или сильного основания, которые нужно добавить к 1л буферного раствора, чтобы изменить его pH на единицу. Буферная емкость тем выше, чем выше концентрация компонентов буферного раствора и чем ближе соотношение концентраций компонентов буферного раствора к единице.
Поведение ацетатного и фосфатного буферных растворов при введении сильной кислоты.
При прибавлении к ацетатной буферной смеси раствора сильной кислоты протекает реакция между ацетат ионом и ионами водорода кислоты, что можно выразить уравнением:
CH3COONa + HCl«CH3COOH + NaCl
CH3COO- + H+®CH3COOH
Сильная кислота замещается слабой уксусной кислотой, посылающей в раствор ничтожно малое количество ионов водорода.
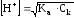
В случае фосфатной буферной смеси ионы водорода сильной кислоты связываются с гидрофосфат ионом с образованием дигидрофосфат иона который слабо диссоциирует и незначительно влияет на величину pH.
Na2HPO4 + HCl« NaH2PO4 + NaCl
HPO42- + H+« H2PO4-
Поведение ацетатного и фосфатного буферных растворов при введении сильного основания.
При добавлении к ацетатной буферной смеси сильного основания пойдет реакция нейтрализации уксусной кислоты:
CH3COOH + NaOH® CH3COONa + H2O
H+ + OH-® H2O
В фосфатной буферной смеси роль слабой кислоты, нейтрализующей избыток гидрооксид ионов, играет дигидрофосфат-ион:
NaH2PO4 + NaOH®Na2HPO4 + H2O
H2PO4- + OH-®HPO42- + H2O
В качестве буферных смесей применяют смеси:
СН3СООН и СН3СООNa (ее соли) ацетатная буферная смесь.
NH4OH и NH4Cl аммонийная буферная смесь.
Фосфатная буферная смесь: одно- или двузамещенные соли фосфорной кислоты:
NaH2PO4 ,Na2HPO4
Кислота соль.
Почему введение буферной смеси поддерживает рН в растворе?
1. СН3СООН СН3СОО- + Н+ Ка = 1,75∙10-5
2. СН3СООNa СН3СОО- + Na+диссоциирует нацело.
При добавлении HCl :HClH+ + Cl-
в соответствии с принципом Ле-Шателье (1) реакция идет в обратную сторону.
При
добавлении соляной кислоты, которая
нацело диссоциирует на катионы водорода
и хлорид-ионы, концентрация Н+
возрастает. Поэтому в соответствии с
принципом Ле-Шателье равновесие смещается
в сторону недиссоциированных молекул
уксусной кислоты. Поэтому рН раствора
будет неизменным. Изменение концентрации
[H+]
будет значительно слабее изменения
концентрации кислоты
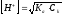 .
.
Введем в смесь NaOH. NaOHNa+ + OH-.
В случае введения щелочи концентрация кислоты несколько уменьшается из-за Н++ОН-, которые выводятся из сферы реакции. А изменение рН не происходит.
Для характеристики эффективности буферных растворов введено понятие буферной емкости, обозначается . – это количество моль-эквивалентов сильной кислоты или сильной щелочи, которое нужно ввести в 1 литр буферного раствора, чтобы изменить водородный показатель на единицу.
СН3СООН + NaOH СН3СООNa + Н2О
= 1.
Рассмотрим ацетатный буфер.
=
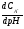 изменение концентрации аниона
изменение концентрации аниона
=
-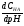 изменение концентрации кислоты, знак
минус означает, она убывает.
изменение концентрации кислоты, знак
минус означает, она убывает.
СН3СООNa + НCl СН3СООН + NaCl
П
= -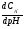 изменение концентрации аниона, знак
минус означает, она убывает.
изменение концентрации аниона, знак
минус означает, она убывает.
=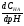 изменение концентрации кислоты.
изменение концентрации кислоты.
Всегда ценно найти раствор, в котором буферная емкость мкасимальна. Необходимо знать зависимость буферной емкости от концентрации компонентов буферной системы, константу диссоциации слабой кислоты или слабого основания, входящих в состав буферной смеси.
Для расчета буферной емкости (без вывода)
=
2,3
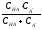 или
= 2,3
или
= 2,3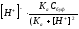
с учетом, что рН = -lg[H+]
Сбуф= СНА + СА-.
Далее
приравниваем -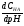 =0,
т.е. находим максимум
по кислоте и находим рН, при котором
максимальна,т.е.
=0,
т.е. находим максимум
по кислоте и находим рН, при котором
максимальна,т.е.
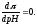
Представления о кислотах и основаниях
С появлением теории электролитической диссоциации возникла возможность классификации кислот и основании. Согласно представлениям Аррениуса кислотой следует считать электролиты, которые при диссоциации образуют ионы водорода, а основанием — вещества, образующие в водном растворе ионы ОН-.Вещества, которые в водных растворах способны в зависимости от условий высвобождать как Н+, так и ионы ОН-, называются амфотерными. Определения Аррениуса явились важной основой для дальнейшего развития теории кислот и оснований. Однако эти определения имеют ряд существенных недостатков, основным из которых следует считать ограниченность их применения только к водным растворам электролитов.
Определение Бренстеда — Лоури. Данная система представлений характеризует кислоты как вещества, высвобождающие протоны (доноры протонов), а основания — как вещества, способные соединяться с протонами (акцепторы протонов). Из этого следует, что реакция нейтрализации сводится к переносу протонов от кислоты к основанию. Такая взаимосвязь между кислотами и основаниями может быть выражена уравнениями, сумма которых представляет собой реакцию нейтрализации
А1↔В1+ Н+
к о п
В2 + Н+ ↔ А2
о п к
А1 + B2 ↔ А2 + В1
к о к о
Таким образом, реакция нейтрализации может рассматриваться как процесс, в котором осуществляется конкуренция за обладание протоном.
СНзСООН ↔ Н++СНзСОО-
Из представлений Бренстеда — Лоури следует, что вода, как и другие вещества, способные не только отдавать, но и принимать к себе протоны, обладает амфотерными свойствами.
Согласно представлениям Бренстеда — Лоури сила кислоты определяется к о н с т а н т о й кислотности Ка. Исходя из равновесия: HA↔Н+ + А-
Ка=С(Н+)*С(А-)/С(НА)
Для осуществления этого равновесия в растворе необходимо присутствие акцептора протона, благодаря которому осуществляется переход протона от кислоты к основанию:
НА + В- ↔ НВ + А
к о к о
Реакции данного типа называются протолитическими, количественная сторона которых характеризуется константой равновесия (константой протолиза):
Кп = С(НВ)С(А-)/С(В-)С(НА)
Значения К для НА и НВ можно определить следующим путем:
К1= С(Н+)*С(А-)/С(НА), К2 = С(Н+)*С(B-)/С(НB)
Тогда Кп = К1/К2
Сила основания определяется константой основности Кb, которая соответствует равновесию
ВОН↔В++ОН-
Кb=С(OН-)*С(B+)/С(BOН)
Определение Льюиса. Льюис предложил более общее определение: кислота — это вещество, которое акцептирует электронную пару; основание — это вещество, которое предоставляет электронную пару.
Взаимодействие между кислотой и основанием, согласно этому определению, заключается в возникновении ковалентной связи по донорно-акцепторному механизму:
H3N: + A1C13 → H3N+ + AlCl3-
Аммиак, имеющий неподеленную пару электронов, является основанием, а координационно-ненасыщенная молекула А1С13 — кислотой. На основании определений Льюиса все обычные лиганды (NH3, CN-, F-, Cl- и др.) можно рассматривать как основания, а все ионы металлов — как кислоты. Степень сродства иона металла к лиганду называют льюисовской кислотностью, а тенденция лиганда образовывать связи с ионом металла называется льюисовскойосновностью. Силы кислот и оснований Льюиса могут меняться в зависимости от природы партнера.
