
Белозеров В.И. Учебное пособие по курсу Техническая термодинамика (оригинал)
.pdf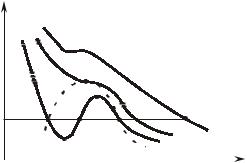
P
|
|
2 |
|
4 |
|
k |
|
6 |
|
|
|
|
|
f |
|
|
|
c |
a |
|
|
|
|
d |
|
b |
1 |
|
|
5 |
|
|
|
|
|
|
e |
3 |
v |
|
|
|
Ðèñ. 7.2.1
Линия 1-2 – изотерма при высоких температурах; линия 3-4 – изотерма при сравнительно низких температурах (имеет два перегиба). Участок 3-b соответствует изотермическому сжатию тела, находящегося в газообразном состоянии, причем в точке b оно уже начинает переходить в жидкость. Точка d соответствует такому состоянию, когда газ полностью превратился в жидкость. Участок d-4 представляет собой изотермическое сжатие жидкости. Участок b-f соответствует неустойчивому состоянию переохлажденного пара, d-e – неустойчивому состоянию перегретой жидкости. Участок e-f
физического смысла не имеет, ибо в действительности при изотермическом сжатии тело переходит из газообразного в жидкое состояние при постоянном давлении, т.е. по горизонтальной линии b-d.
На изотерме 5-6 точки b и d сливаются в одну – k, называемую критической точкой, а соответствующие ей параметры P , v , T –
называются критическими.
Критическая температура характеризуется тем, что при температурах выше нее невозможно путем изотермического сжатия добиться перехода газа в жидкое состояние.
Опыты английского физика Т. Эндрюса (1869 г.) подтвердили ка- чественно характер изотерм, соответствующих уравнению Ван-дер- Ваальса, однако с количественной точки зрения это уравнение является приближенным, что объясняется явлением ассоциации молекул газа, которое уравнением Ван-дер-Ваальса не учитывается.
При достаточном сжатии газа молекулы его сближаются настолько, что силы взаимодействия заставляют наименее подвижные молекулы объединяться в комплексы, называемые ассоциациями. Сна- чала появляются двойные, затем тройные и еще более сложные
104
образной ван-дер-ваальсовской изотермы должно быть выбрано таким образом, чтобы площадь 1-2-3-1 была равна площади 3-4-5-3.
Постоянные a и b в уравнениях Ван-дер-Ваальса вычисляются с помощью уравнений
|
P |
· |
êð |
|
§ |
w |
2 P ·êð |
|
|
||
§ w |
|
0, |
¨ |
|
|
¸ |
0, |
|
|||
¨ |
|
¸ |
|
|
|
|
(7.1.2) |
||||
|
|
|
|
2 |
|||||||
© wv |
¹T |
|
© wv |
|
¹T |
|
|
||||
справедливых для критической точки. Вычислив эти производные и приравняв их к нулю, получаем
|
27 |
|
R2T 2 |
v |
|
||
a |
|
êð |
, b |
êð |
. |
(7.1.3) |
|
|
|
|
|||||
64 |
|
Pêð |
3 |
|
|
||
Наоборот, критические давления, температура и удельный объем могут быть выражены через a и b:
Pêð |
1 a |
; |
Têð |
8a |
; |
vêð |
3b. |
(7.1.4) |
||
27 |
|
b2 |
27bR |
|||||||
Обозначим отношение давления, температуры и удельного объема газа, подчиняющегося уравнению Ван-дер-Ваальса, к значениям этих величин в критической точке через
S |
P |
, W |
T |
, Z |
v |
. |
(7.1.5) |
|
|
|
|||||
|
P |
T |
v |
|
|||
êð |
|
êð |
|
êð |
|
|
|
Безразмерные значения S, W, Z называются приведенными давлением, температурой и удельным объемом. Подставляя P, T и v, выраженные через приведенные значения, в уравнение (7.1.1) и учитывая при этом (7.1.4), получаем
§ |
3 |
· |
3Z 1 8W |
|
¨S |
|
¸ |
(7.1.6) |
|
2 |
||||
© |
Z |
¹ |
|
|
– уравнение в безразмерном виде или, как иногда говорят, в приведенном виде. Уравнение (7.1.6) не содержит ни одной константы, которая была бы связана с индивидуальными свойствами вещества, следовательно, безразмерное уравнение Ван-дер-Ваальса справедливо для любых ван-дер-ваальсовских газов. Это обстоятельство
101
103 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
нениюВан-дер-Ваальса.(рис2.7..1) |
||||||||||
-координатахизотермы,построенныепоурав- |
PV |
Рассмотримв |
||||||||||
|
|
|
|
|
|
|
|
ренним.давлением |
||||
вающиеегонанекоторуюдобавочнуювеличину,называемуювнут- |
||||||||||||
щиевнаправлениидействиявнешнегодавленияикакбыувеличи- |
||||||||||||
учитываетсилывзаимногопритяжения,действую- |
2 |
v |
||||||||||
|
Поправка |
|||||||||||
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
a |
||
|
|
|
|
|
|
|
|
|
|
самих.молекул |
||
.косновенияВеличинаbсоставляетпримерноучетверенныйобъем |
||||||||||||
молекулыгазаприсжатииегонемогутбытьдоведеныдосопри- |
||||||||||||
связисналичиемсилотталкивания,возникающихприихсближении, |
||||||||||||
объемуb.Величинаbбольшесуммарногообъемамолекул,.к.тв |
||||||||||||
кнулю,какуидеальныхгазов,акнекоторомупредельномалому |
||||||||||||
Прибеспредельномсжатиигазаегообъембудетстремитьсяне |
||||||||||||
должныбытьпринятывовниманиеприизученииреальных.газов |
||||||||||||
затемвнегобыливнесеныпоправкинаобъемидавление,которые |
||||||||||||
вуегобыловзятоуравнениесостоянияидеальныхгазовPv=RT,а |
||||||||||||
СтруктурауравненияВан-дер-Ваальсапоказывает,чтозаосно- |
||||||||||||
|
|
значительноотличаютсядругот.друга |
||||||||||
гдепостоянныеaиbзависятотприродыгазаиуразличныхгазов |
||||||||||||
|
|
|
¹ |
2 |
v |
|
© |
|
|
|
|
|
.2.(71) |
RT, |
vb |
¸ |
|
P |
¨ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
a· |
|
§ |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
ниеимеетвид |
|
полученов1873.гВан-дер-Ваальсоминоситего.имяЭтоуравне- |
||||||||||||
омолекулярно-кинетическихсвойствахистроенииэтихгазов,было |
||||||||||||
положеныупрощенные,ноправильныепосуществупредставления |
||||||||||||
Уравнениесостоянияреальныхгазов,восновукоторогобыли |
||||||||||||
|
ныхгазовприводиткзначительным.погрешностям |
|||||||||||
жениямеждуними,иприменениеуравнениясостояниядляидеаль- |
||||||||||||
номалыми,начинаютзаметнопроявлятьсясилывзаимногопритя- |
||||||||||||
лениях,когдарасстояниямеждумолекуламистановятсядостаточ- |
||||||||||||
оченьмалыхдавленияхивысоких.температурахПрибольшихдав- |
||||||||||||
Реальныегазыподчиняютсязаконамидеальныхгазовтолькопри |
||||||||||||
|
|
|
|
|
|
|
|
|
конечный.объем |
|||
куламигазасуществуютсилысцепления,имолекулыгазаимеют |
||||||||||||
Реальныегазыотличаютсяотидеальныхтем,чтомеждумоле- |
||||||||||||
|
.2.7Уравнениесостоянияреальногогаза |
|||||||||||
|
|
|
|
|
|
|
102 |
|
|
|
|
|
|
|
|
|
|
|
|
0,219 |
|
|
|
|
Метиловыйспирт |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,200 |
|
|
|
|
Уксуснаякислота |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,276 |
|
|
|
|
Бензин |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,224 |
|
|
|
|
Âîäà |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,78 |
|
|
|
|
Ксенон |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,288 |
|
|
|
|
Углекислота |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,293 |
|
|
|
|
Кислород |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,292 |
|
|
|
|
Аргон |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,293 |
|
|
|
|
Àçîò |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,33 |
|
|
|
|
Водород |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,32 |
|
|
|
|
Гелий |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
êð |
|
|
|
|
Вещество |
|
|
|
z |
|
|
|
|
||
|
|
|
|
|
|
|
||
|
Таблица2.1.7 |
|
|
|
|
|
|
|
|
|
личаетсяотван-дер-ваальсовского.значения |
||||||
|
|
|
|
|
|
|
êð |
|
реальныхвеществсущественноот- |
Каквидноиз.табл2,.1.7z |
|||||||
|
|
|
|
8 |
êð |
|
||
|
.0,375 |
|
|
z |
||||
|
|
|
||||||
|
|
|
|
3 |
|
|
||
|
|
чиняющихсяуравнениюВан-дер-Ваальса, |
||||||
Сучетомсоотношений.1.(74)получаем,чтодлявеществ,под- |
||||||||
|
êð |
|
|
|
|
|
||
.1.(77) |
. |
RT |
êð |
|
||||
|
|
|
|
z |
||||
|
êð |
êð |
|
|
||||
|
|
|
v |
P |
|
|
||
|
|
Введемпонятиеокритическомкоэффициенте |
||||||
|
термодинамическихсвойств.веществ |
|||||||
Ваальсаприводяткбольшимотклонениямотреальныхзначений |
||||||||
болеекобласти.жидкостиПопыткипримененияуравненияВан-дер- |
||||||||
ластям,гдевеществообладаетсвойствамиреальногогазаитем |
||||||||
Какпоказываютрасчеты,уравнение.1.(71)неприменимокоб- |
||||||||
используетсяприобоснованииметодатермодинамическогоподобия. |
||||||||

жидкость, и числом молекул, возвращающихся в нее. Давление насыщенного пара зависит от температуры, и каждому давлению пара соответствует определенная температура. Если при постоянной температуре объем насыщенного пара будет уменьшаться, то часть пара превратится в жидкость; за счет этого давление пара остается постоянным. При увеличении объема часть жидкости превращается в пар и давление пара остается постоянным. Температура насыщенного пара и жидкости, с которой пар соприкасается, называется температурой насыщения. Температуру насыщения называют также температурой кипения. Насыщенный пар может быть влажным и сухим.
Сухим насыщенным паром называется такой пар, который совершенно не содержит капелек жидкости.
Влажным насыщенным паром называется механическая смесь сухого насыщенного пара и кипящей жидкости. Влажный пар характеризуется степенью сухости x. Степенью сухости называют массовую долю сухого насыщенного пара, находящегося в массе 1 кг влажного пара. Для сухого насыщенного пара x = 1, для кипящей воды x = 0.
Если к сухому насыщенному пару подводить дополнительно тепло при том же давлении, какое имеет сухой насыщенный пар, то он становится перегретым паром. Перегретым называется пар, имеющий температуру более высокую, чем насыщенный пар, при том
же давлении. Если t – температура перегретого пара, то t – t назы-
s
вается степенью перегрева или просто перегревом.
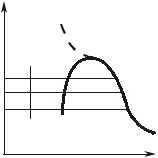
8.1. Парообразование в Pv-диаграмме
|
|
|
|
|
|
|
|
|
Процесс парообразования при |
P |
|
a |
b |
c |
d |
|
постоянном давлении. |
||
|
|
||||||||
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
На Pv-диаграмме (рис. 8.1.1) |
|
|
|
|
|
|
|
|
|
этот процесс изображается гори- |
|
|
|
|
|
|
|
|
|
зонтальной линией a-b-c-d, у ко- |
|
|
|
|
|
|
|
|
|
торой участок a-b соответству- |
|
|
|
|
|
|
|
|
|
ет перегреву жидкости от 0°С до |
|
|
|
|
|
|
|
|
|
температуры кипения, участок |
|
|
v |
vχ |
v σ |
|
|
v |
||
|
|
|
|
b-c – превращению кипящей |
|||||
|
|
|
|
0 |
|
|
|
|
|
Ðèñ. 8.1.1 |
воды в сухой насыщенный пар и |
|
ассоциации. Взаимное положение молекул в ассоциациях соответствует минимальному значению их общей потенциальной энергии, потому ассоциация представляет собой устойчивое образование, распад которого возможен при условии подвода энергии извне.
Уравнение состояния реального газа, учитывающее силовую ассоциацию молекул, предложено М.П. Вукаловичем и И.И. Новиковым в 1939 г. В простейшем виде оно учитывает только образование двойных молекул. Представляя процесс ассоциации как хими- ческую реакцию, можно записать
§ |
a |
· |
|
§ |
|
C |
· |
|
|
|||
¨P |
|
|
¸ |
v b |
RT ¨1 |
|
|
|
|
¸ |
, |
(7.2.2) |
|
2 |
|
|
32m |
|
|||||||
© |
v |
|
¹ |
|
¨ |
|
|
|
¸ |
|
|
|
|
|
2 |
|
|
||||||||
|
|
|
|
|
© vT |
|
|
¹ |
|
|
||
где a, b, C, m – константы, определяемые природой реального газа. В наиболее общем виде, учитывающем взаимодействие между молекулами реального газа во всей его сложности, уравнение состо-
яния может быть записано в форме вириального ряда
Pv A |
|
A1 |
|
A2 |
|
A3 |
..., |
(7.2.3) |
|
|
v3 |
||||||
0 |
|
v v2 |
|
|
|
|||
где A , A , A – функции температуры, называемые вириальными
0 1 2
коэффициентами.
Одна из попыток теоретически обоснованного вывода уравнения состояния, справедливого для достаточно широкой области состояний реального газа, была предпринята в 1937–1946 гг. американским физиком Майером и советским математиком Боголюбовым. С помощью методов статистической физики они показали, что в общем виде уравнение состояния реального газа выглядит так:
§ |
a |
· |
|
§ |
φ |
k Ek |
· |
|
|
||||
¨P |
|
|
¸ |
v b |
RT ¨1 |
¦ |
|
|
|
|
¸ |
, |
(7.2.4) |
v |
2 |
k 1 v |
k |
||||||||||
© |
|
¹ |
|
© |
k 1 |
|
¹ |
|
|
||||
где E – вириальные коэффициенты, которые являются только f (T).
k
1
Выражение в скобках есть ряд по степеням . Очевидно, чем v
больше v, тем меньше нужно членов ряда. При v, стремящемся к бесконечности, уравнение (7.2.4) принимает вид Pv = RT, т.е. при малых плотностях превращается в уравнение Клапейрона.
108 |
105 |
107
.е.тустанавливаетсяравенствомеждучисломмолекул,покидающих сявприсутствииводыинаходитсяснейвравновесномсостоянии, .регретымНасыщеннымназываетсятакойпар,которыйобразуетВзависимостиотсвойствпарможетбытьнасыщеннымилипе-
всяжидкостьнепревратитсяв.пар
s чаетсяt.Температуракипенияостаетсяпостояннойдотехпор,пока
.нияЭтатемператураназываетсятемпературойкипенияиобознаопределеннойтемпературедляданнойжидкостииданногодавлетерноедлякипениябурление.жидкостиКипениепроисходитпри тяженияивылетаютвокружающеепространство,вызываяхаракжидкости,онипреодолеваютсопротивлениесилповерхностногонаясьприэтомсдругимипузырьками.параДостигаяповерхности меньшуюплотность,чемжидкость,устремляютсявверх,соединяверхности,такивнутри.жидкостиЭтипузырькипара,имеющие массе.жидкостиПрикипенииобразуютсяпузырькипаракакнапо- Кипение–этопроцесспарообразования,протекающийвовсей сивностьиспарения.повышается ющее.пространствоПриувеличениитемпературыжидкостиинтен- лекулы,обладающиенаибольшейскоростью,ивылетаютвокружа- .пературеПрииспарениисповерхностижидкостиотрываютсямо- косповерхности.жидкостиЭтотпроцесспротекаетприлюбойтем- Испарениемназываетсяпарообразование,происходящеетоль- .жидкости Парможнополучитьдвумяспособами:испарениемикипением какреальный.газ нениесостоянияидеальныхгазов,поэтомупарнадорассматривать нельзяприменятьзаконыидеальныхгазов,аследовательно,иурависпользуетсяпридавленияхитемпературах,прикоторыхкнему сительвтеплообменных.аппаратахВобоихслучаяхводянойпар водянойпаркакрабочеетеловпаровыхдвигателяхикактеплононазывать.парамиВтеплотехникенаибольшееприменениеполучил ввидевзвешенныхмелкодисперсныхчастицилибезнее)принято Многиегазообразныетела(спримесьюодноименнойжидкости
.ПАРЫИСПАРЕНИЕ,КИПЕНИЕ
Глава8
106
|
|
|
|
|
|
|
|
коот.температуры |
||||||||||||
|
|
|
|
|
|
|
|
|
CD |
, |
B |
; |
RT |
= |
A |
ãäå |
||||
,…–вириальныекоэффициенты,зависящиетоль- |
, |
|
|
|
|
|
|
|||||||||||||
.2.(75) |
..., |
3 |
DP |
2 |
ABPCP |
Pv |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
основеэкспериментальныхданных: |
|||||||||||||||
),гдечисленныекоэффициентыподбираютсяна |
PT |
( |
f |
= |
v |
например, |
||||||||||||||
|
, |
|
|
|||||||||||||||||
Какправило,этоуравнениепредставляетсобойстепенныеряды, |
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
.данные |
|||
видеинтерполяционнойформулы,описывающейэкспериментальные |
||||||||||||||||||||
задачасложна,поэтомуудобноуравнениесостоянияпредставитьв |
||||||||||||||||||||
мудолжныопределятьсяэкспериментальнымиметодами,нотакая |
||||||||||||||||||||
|
|
|
|
|
|
|
k |
|
|
|
|
|
|
|
|
|
|
|
|
|
немогутбытьвычисленытеоретически,поэто- |
Ε |
Коэффициенты |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
hχχ |
hχ r. |
|
|
(8.2.11) |
|||||
Поскольку dS |
dq |
, à T |
T |
const , dq |
dr , òî dS |
dr |
, |
||||||
|
|
||||||||||||
|
T |
|
S |
|
|
|
|
|
|
|
TS |
||
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
Sχχ |
Sχ |
r |
|
|
(8.2.12) |
|||||
|
|
|
|
|
|
|
|
|
|||||
|
|
|
TS |
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
||||
èëè |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Sχχ Sχ |
|
r |
| CP ln |
TS |
|
r |
. |
(8.2.13) |
||||
|
|
TS |
|
|
|||||||||
|
|
|
|
|
|
T0 |
TS |
|
|
||||
Определим энтальпию, удельный объем и энтропию влажного насыщенного пара, степень сухости которого равна х.
Энтальпия влажного пара определяется по выражению
hX hχ rx . |
(8.2.14) |
Удельный объем влажного насыщенного пара определим по формуле
vX xvχχ (1 x)vχ, |
(8.2.15) |
ãäå vσ – удельный объем х кг сухого насыщенного пара; vχ – удельный объем кипящей жидкости, тогда
|
|
|
|
|
vX |
vχ |
|
|
|
|
||||
|
|
x |
|
|
|
|
|
; |
|
|
|
|
(8.2.16) |
|
|
|
|
|
vχχ vχ |
|
|
|
|||||||
• плотность влажного пара |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Υ |
|
1 |
|
|
|
|
|
1 |
|
|
|
; |
(8.2.17) |
|
X |
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
||||
|
vX |
|
|
|
|
xvχχ (1 x)vχ |
|
|||||||
|
|
|
|
|
|
|
||||||||
• энтропия влажного пара |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
SX Sχ |
rx |
| CP ln |
TS |
|
rx |
(8.2.18) |
||||||||
|
T0 |
TS |
||||||||||||
|
|
|
TS |
|
|
|
|
|||||||
èëè
SX xSχχ (1 x)Sχ.
112
участок c-d – перегреву пара до за- |
P |
|
|
|
|||
|
|
|
|
|
|
|
|
данной температуры. Таким обра- |
|
|
l |
|
|||
|
|
|
|
||||
зом, на графике вычислены v , vχ, vσ, |
|
|
|
k |
|||
|
|
0 |
|
|
|
|
|
соответствующие удельным объе- |
|
|
|
|
|||
мам жидкости при 0°С, кипящей жид- |
|
a |
b |
c |
|||
|
2 |
||||||
|
2 |
|
2 |
||||
|
|
|
|||||
|
|
|
|
|
a |
b |
c |
кости и сухого насыщенного пара. |
|
|
1 |
1 |
1 |
||
|
|
|
|
|
|||
При подогреве жидкости удель- |
|
a |
b |
c |
|||
|
|
|
|
||||
ный объем ее несколько увеличива- |
|
|
|
|
|||
ется вследствие температурного |
|
|
|
|
|||
расширения, процесс же парообразо- |
|
|
|
v |
|||
|
|
|
|
||||
вания характеризуется резким увели- |
|
|
Ðèñ. 8.1.2 |
||||
чением удельного объема. |
|
|
|
|
|
|
|
Построив в Pv-диаграмме (рис. 8.1.2) аналогичные графики для |
|||||||
нескольких различных давлений и соединив одноименные точки плав- |
|||||||
ными линиями, можно заметить, что в связи с очень малой сжима- |
|||||||
емостью жидкости линия a-a -a -…, выражающая зависимость |
|||||||
|
|
1 |
2 |
|
|
|
|
v = f (P), практически вертикальна; в связи с тем, что при увеличе- |
|||||||
0 |
|
|
|
|
|
|
|
нии давления возрастает температура кипения, от которой зависит |
|||||||
vχ, линия b-b -b -…, выражающая зависимость vχ = f (P), идет круто |
|||||||
1 |
2 |
|
|
|
|
|
|
вверх с наклоном в правую сторону; наконец, линия c-c -c -…, выра- |
|||||||
|
|
|
|
|
|
1 |
2 |
жающая зависимость vσ = f (P), имеет гиперболический характер. |
|||||||
Линия b-b -b -…, отделяющая область жидкости от области |
|||||||
1 |
2 |
|
|
|
|
|
|
влажного пара и характеризуемая равенством x = 0, называется ниж- |
|||||||
ней пограничной кривой; линия c-c -c -…, отделяющая область влаж- |
|||||||
|
|
|
1 |
2 |
|
|
|
ного пара от области пара перегретого и характеризуемая равен- |
|||||||
ством x = 1, называется верхней пограничной кривой. |
|
||||||
С ростом давления разность vσ – vχ уменьшается и пограничные |
|||||||
кривые сближаются, плавно сходясь в критической точке k, где они |
|||||||
обе принимают горизонтальное направление. |
|
|
|||||
Как видно из графика (рис. 8.1.2), точка k соответствует некото- |
|||||||
рому предельному состоянию вещества, при котором исчезает ви- |
|||||||
димое различие между жидкостью и паром. |
|
|
|||||
Критические параметры, характеризующие это состояние для |
|||||||
каждого вещества, имеют определенные значения. Так, например, |
|||||||
äëÿ âîäû P = 221,15 áàð, t |
= 374,12°Ñ, v |
= 0,003147 ì3/êã. |
|||||
êð |
|
êð |
|
|
êð |
|
|
Линия k-l – условная граница между жидкостью и перегретым |
|||||||
паром, соответствующая пиковым значениям теплоемкости C . |
|||||||
|
|
|
|
|
|
|
P |
|
|
|
|
|
|
|
109 |
111 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
пиисухогонасыщенного.параИз.2.(88)следует |
|||||||||||||||||||||||||
.е.тполнаятеплотапарообразованияприблизительноравнаэнталь- |
||||||||||||||||||||||||||
|
|
χχ |
h |
| |
χ |
h |
|
χχ |
h |
χ |
h |
|
Ο |
|
|
|
|
|
|
|
||||||
.2.(810) |
|
, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
èëè |
.2.(89) |
|
|
|
|
|
qχr |
|
Ο |
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
наятеплотапарообразования |
||||||||||
Сумматеплотыжидкостиитеплотыпарообразованияестьпол- |
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ùåé.âîäû |
||
–энтальпиякипя- |
χ |
–энтальпиясухогонасыщенногопара;h |
σ |
ãäåh |
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
χ |
|
χχ |
h |
|
|
r |
|
|
|
|
|
|
|
|
|
|
|||||
.2.(88) |
|
|
|
|
, |
h |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
èëè |
|
|
uχχPvχχuχPvχ |
|
r |
|
|
|
|
|
|||||||||||||||||
|
|
uχχuχPvχχvχ, |
|
r |
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
rΥ |
|
|
|
|
|
|
|
|
|
|
èëè |
|||||||||
.2.(87) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
.å.ò |
|
|
|
, |
|
|
Pvχχvχ |
|
|
l |
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
аработарасширенияпара |
|||||||
|
|
|
|
|
|
Υ |
χ |
u |
χχ |
u |
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
,.å.ò |
Υ |
образованияиобозначается |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
называетсявнутреннейтеплотойпаро- |
χ |
u |
– |
σ |
давлении;величинаu |
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
–внутренняяэнергиякипящейжидкостипритомже |
χ |
давлении;u |
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
–внутренняяэнергиясухогонасыщенногопараприданном |
σ |
ãäåu |
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
.2.(86) |
|
|
|
, |
|
|
uχχuχ |
|
r |
|
|
|
|
|
|
|
||||||||||
|
|
|
|
l |
|
|
|
|
|
|
|
|
||||||||||||||
реннейэнергииинасовершениеработы,поэтому |
||||||||||||||||||||||||||
Подводимоетеплоздесьтакжерасходуетсянаизменениевнут- |
||||||||||||||||||||||||||
етсятеплотойпарообразованияиобозначаетсяr. |
||||||||||||||||||||||||||
гретойдотемпературыкипения,всухойнасыщенныйпар,называ- |
||||||||||||||||||||||||||
Количествотепла,затрачиваемоенапревращение1кгводы,на- |
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Парообразование |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
110 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
ЭнтропияхолоднойводыSусловнопринимаетсяравной.нулю |
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
кипения. |
||
|
s |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
=273,15K–температурахолоднойводы;T–температура |
ãäåT |
|||||||||||||||||||||||
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T |
|
|
P |
|
0 |
|
|
|
|
|
|
|
|
|
|
||||
.2.(85) |
|
|
|
, |
|
|
ln |
C |
SχS |
|
|
|
|
|
|
|
|
|
||||||
|
|
|
S |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
нению |
||
Изменениеэнтропииможноприблизительноподсчитатьпоурав- |
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
энтальпиикипящей.жидкости |
|||||||||
.е.тдлянебольшихдавленийтеплотажидкостиприблизительноравна |
||||||||||||||||||||||||
.2.(84) |
|
|
|
|
|
|
|
|
|
, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
qχ|hχ |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
равнойнулю,следовательно, |
|||||||||
Энтальпиюводыпри0°CиP=0,0061барусловнопринимают |
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
χ |
|
–энтальпияхолодной.воды |
–энтальпиякипящейводы;h |
ãäåh |
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
.2.(83) |
|
|
|
|
|
, |
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
.å.ò |
|
|
|
|
|
|
hχh |
|
|
qχ |
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
, |
0 |
|
|
|
|
|
0 |
uχPvχu |
qχ |
|
|
|
|
|
||||||||
|
|
Pv |
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
èëè |
.2.(82) |
|
|
0 |
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
Pvχv |
|
uχu |
|
|
qχ |
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
ныйобъемхолоднойводы,тогда |
|||||||||||
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
χ |
0 |
χ |
|
|
|
–удель- |
–удельныйобъемкипящейводы;v |
–v),ãäåv |
òàl=P(v |
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Подогревжидкостипроисходитприпостоянномдавленииирабо- |
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
холодной.воды |
||||
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
χ |
|
|
–внутренняяэнергия |
–внутренняяэнергиякипящейводы;u |
ãäåu |
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
.2.(81) |
l, |
|
|
0 |
u |
χ |
u |
|
l |
|
|
u |
χ |
q |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
моенаподогревжидкости,можноподсчитатьпоформуле |
|||||||||||||||||||||||
Наоснованиипервогозаконатермодинамикитепло,затрачивае- |
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
теплотойжидкости. |
||||||
0°Сдотемпературыкипенияприпостоянномдавлении,называется |
||||||||||||||||||||||||
Количествотепла,затраченноенанагревание1кгжидкостиот |
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Подогревжидкости |
|||||||
|
затрачиваемогонаобразованиепара |
|
|
|
|
|||||||||||||||||||
|
.2.8Определениеколичестватепла, |
|
|
|
|
|||||||||||||||||||

§ wh ·
при P=const получаем ¨ ¸ T.
© wS ¹P
Но частная производная в левой части полученного уравнения представляет собой угловой коэффициент касательной к изобаре, а поскольку температура в изобарном процессе влажного пара посто-
янна и равна температуре кипения T , постоянным будет и этот ко-
S
эффициент, т.е. изобара изображается прямой линией.
С увеличением давления температура T повышается, поэтому
S
изобары становятся все более крутыми и вся совокупность их образует пучок расходящихся кверху прямых.
В области перегретого пара изобары строятся по точкам, наносимым в соответствии с табличными значениями параметров h и S, для разных температур. По мере удаления от верхней пограничной кривой температура пара возрастает, поэтому крутизна изобар увеличивается, т.е. за этой кривой они теряют прямолинейный характер и плавно изгибаются кверху.
Изотермы в области перегретого пара строятся по тем же точ- кам, которые были нанесены для построения изобар. При этом оказывается, что на верхней пограничной кривой они имеют излом, расходятся с изобарами и идут вначале с некоторым подъемом, а затем принимают почти горизонтальное направление.
Обычно на hS-диаграмму наносится и система изохор v= const, которые по своему характеру близки к изобарам, но идут несколько круче и в области влажного пара непрямолинейны. В области влажного пара наносится система линий постоянной сухости (x=const).
Впервые hS-диаграмма водяного пара была построена Молье в 1906 г. для давлений до 20 атм. В настоящее время применяется hSдиаграмма Вукаловича, построенная для давлений до 1000 бар и температур до 1000 °С.
Перегрев пара
Перегретый пар получается в результате дополнительного подвода тепла к сухому насыщенному пару.
Количество тепла, затраченное на превращение 1 кг сухого пара в перегретый, называется теплотой перегрева q :
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ï |
|
|
|
q3 |
|
|
|
|
p (t3 tS ) , |
|
|||||
|
|
|
|
C |
(8.2.19) |
|||||||||
|
|
|
|
|
|
|
|
|
|
|||||
ãäå C |
P |
– средняя изобарная теплоемкость перегретого пара; t – тем- |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
ï |
|
пература перегретого пара, °С; t |
– температура сухого насыщен- |
|||||||||||||
|
|
|
|
|
|
|
s |
|
|
|
|
|
|
|
íîãî ïàðà, °Ñ. |
|
|
|
|
|
|
|
|
|
|
|
|||
Энтальпия перегретого пара определяется из уравнения |
||||||||||||||
|
|
|
|
|
P (t3 tS ). |
|
||||||||
|
|
|
h hcc C |
(8.2.20) |
||||||||||
Перегрев пара происходит с увеличением энтропии |
||||||||||||||
|
|
|
S Scc |
T3 |
dq |
T3 |
CP |
dT |
, |
|||||
|
|
|
³ |
|
T |
³ |
|
T |
||||||
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
T |
|
T |
|
|
|
|
||||
|
|
|
|
S |
|
|
|
|
S |
|
|
|
|
|
отсюда |
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
T3 |
|
dT |
|
|
|
|
|
|
S |
Scc ³CP |
|
. |
(8.2.21) |
|||||||
|
|
|
|
T |
||||||||||
|
|
|
|
|
|
|
|
|
TS |
|
|
|
|
|
8.3. TS- и hS-диаграммы водяного пара
TS-диаграмма
В области жидкого состояния при невысоких давлениях можно
считать C = const, тогда
P
S C |
|
ln |
T |
S |
|
0 |
ïðè T T |
. |
P |
|
0 |
||||||
|
|
T0 |
|
|
0 |
|
||
|
|
|
|
|
|
|
|
Изобара воды представляет собой экспоненциальную кривую,
начинающуюся на оси ординат в точке А при температуре T и кон-
0
чающуюся в точке В при температуре кипения T и энтропии Sc
S
(рис. 8.3.1). В области влажного пара T = T = const, поэтому изоба-
S
ра имеет вид горизонтальной прямой ВС, конечная точка С соответ-
116 |
113 |

115 |
|
|
|
|
|
|
|
|
|
dhvdP |
|
TdS |
|
|
|||||
|
|
|
|
|
|
Действительно,изуравнения |
|||
|
|
|
|
|
|
|
ляютсяи.изотермами |
||
динатирасходящихсякверху.изобарОдновременноэтилиниияв- |
|||||||||
щимивобластивлажногопарапучокначинающихсявначалекоор- |
|||||||||
одинаковымдавлениям,соединяютсяпрямымилиниями,образую- |
|||||||||
пограничныекривые,затемточкинаэтихкривых,соответствующие |
|||||||||
строятсянижняяиверхняя |
s |
,S |
s |
,h |
,S |
Потабличнымзначениямh |
|||
|
|
c |
|
c |
|
|
|
||
чета,вкоторомиспользуетсяhS-.диаграмма |
|||||||||
этимвтеплотехникеширокоприменяетсяграфическийметодрас- |
|||||||||
гую,чтозачастуюсвязаносгромоздкими.вычислениямиВсвязис |
|||||||||
выяснить,непроисходитливнемпереходпараизоднойфазывдру- |
|||||||||
лами,поэтому,исследуякакой-либопроцесс,приходитсяпреждевсего |
|||||||||
метрамипаравразличныхегофазахвыражаютсяразнымиформу- |
|||||||||
гретогопаравовлажныйили.наоборот)Соотношениямеждупара- |
|||||||||
реходовприизмененииегосостояния(например,превращенияпере- |
|||||||||
табличныхданныхчастоосложняютсявозможностьюфазовыхпе- |
|||||||||
Аналитическиерасчетыпроцессовводяногопараспомощью |
|||||||||
|
|
|
|
|
|
|
hS-диаграмма |
||
ного.параЛинияKLназываетсяверхнейпограничной.кривой |
|||||||||
ВсеточкикривойKLсоответствуютсостояниюсухогонасыщен- |
|||||||||
|
|
|
|
|
|
|
ничнойкривой.(рис3.8..2) |
||
ставляетсобойнеплощадь,алинию,совпадающуюснижнейпогра- |
|||||||||
поэтомувсяобластьжидкогосостояниявтакойдиаграммепред- |
|||||||||
ветствующиесостояниюнекипящейводыприразныхдавлениях, |
|||||||||
того,наэтойжеизобарележативсебезисключенияточки,соот- |
|||||||||
рая,следовательно,являетсяинижнейпограничной.кривойБолее |
|||||||||
êð |
|
|
|
|
|
|
|
|
|
койдиаграммеразмещаютсяналинииAK,.е.тнаизобареP,кото- |
|||||||||
.параВсеточки,соответствующиесостояниюкипящейводы,вта- |
|||||||||
туретройнойточки,азатемпродолжаетсявобластиперегретого |
|||||||||
,соответствующегопарообразованиюпритемпера- |
AL |
ногоучастка |
|||||||
|
|
|
|
|
|
|
A |
|
|
.личиваетсяИзобараPначинаетсянепосредственносгоризонталь- |
|||||||||
тальногоучастка,соответствующегообластивлажногопара,уве- |
|||||||||
лениятеплотапарообразованиявозрастает,поэтомудлинагоризон- |
|||||||||
изобарувлажного,азатемперегретого.параПомереснижениядав- |
|||||||||
чиваясьприсоответствующейтемпературекипенияипереходяв |
|||||||||
êð |
|
|
|
|
|
|
|
|
|
ленийнавсемсвоемпротяжениисливаютсясизобаройP,закан- |
|||||||||
|
|
|
|
|
114 |
|
водыдлядругих,болеенизкихдав- |
|
.Ðèñ2.3.8 |
||||
Каквидноизграфика,изобары |
|
|
||||
|
ходитвизобаруперегретого.пара |
S |
|
|||
|
|
|
||||
ление,имеетперегибиплавнопере- |
|
A |
||||
L |
|
|||||
|
|
|
|
|
||
приобретаетгоризонтальноенаправ- |
|
|
||||
|
f |
P |
|
a |
|
|
, |
вкритическойточке,когдаC= |
P |
|
|||
|
|
|
|
|
||
становитсяменеекрутойи,наконец, |
|
|
||||
|
|
P |
|
|
|
|
когдаCначинаетвозрастать,она |
|
|
||||
Приболеевысокихтемпературах, |
|
K |
||||
|
|
|
|
|
||
ненциальныйхарактер.(рис3.8..2) |
êð |
T |
||||
P |
||||||
|
|
|
|
|
||
носчитатьпостоянной,имеетэкспо- |
|
|
||||
немучастке,гдетеплоемкостьмож- |
|
|
||||
Нижняяпограничнаякривая,изображаемаялиниейАК,наниж- |
||||||
|
|
êð |
|
|
A |
|
|
|
=221,15.áàð |
P=0,006113барикончаяизобаройP |
|||
можноизобразитьцелуюсистемуизобар,начинаяотизобары |
||||||
отдавления,аявляетсяфункциейтемпературы,наTS-диаграмме |
||||||
|
|
P |
0 |
|
|
|
=0идляводыCнезависит |
Считая,чтопривсехдавленияхS |
|||||
рапохарактеруприближаетсякэкспоненциальнойкривой.(рис3.8..1) |
||||||
|
|
|
|
|
P |
|
оттемпературыстановитсянезначительной,изоба- |
дазависимостьC |
|||||
барывозрастает,анадостаточнобольшомрасстоянииотнее,ког- |
||||||
|
|
|
P |
|
|
|
уменьшаетсяикрутизнаизо- |
мереудаленияотточкиСвеличинаC |
|||||
дляперегретогопаравелика,поэтомуизобараидетболее.пологоПо |
||||||
P |
|
|
|
|
||
|
НаначальномучасткевблизисостояниянасыщениявеличинаC |
|||||
|
|
|
|
|
|
P |
C |
P |
¹ |
©wS |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
. |
|
|
|
¸ |
¨ |
tgD |
|
|
|
|
|
|
|
|
|
|
T |
|
· |
§wT |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
перегретогопара |
|
|
|
|
|
|
||||||||
коэффициенткасательнойкизобаре |
|
|
.Ðèñ1.3.8 |
|
|
|||||||||||
|
|
|
T |
|
|
|
|
T |
|
|
|
|
|
|
||
следует,чтоугловой |
P |
C |
|
dS |
S |
E |
σ |
S |
χ |
S |
||||||
|
|
|
||||||||||||||
dT |
dq |
|
||||||||||||||
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
издифференциальногоуравнения |
|
|
|
|
|
|
||||||||||
|
|
P |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
взависимостиотC.Действительно, |
|
|
|
|
|
|
||||||||||
Крутизнаэтойкривойизменяется |
|
|
|
|
|
A |
||||||||||
|
|
|
|
|
|
|||||||||||
|
|
|
|
вкривуюСD. |
|
|
|
|
|
|
||||||
изобараимеетизломипревращается |
|
|
C |
B |
||||||||||||
|
|
|
|
|
|
|||||||||||
етсяпоуравнению21),.2.(8вточкеС |
|
|
|
|
|
|
||||||||||
Энтропияперегретогопараопределя- |
|
D |
|
|
|
|
||||||||||
|
|
|
|
|
|
|||||||||||
. |
s |
гопара,когдаэнтропияравнаS |
|
|
|
|
|
T |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
ствуетсостояниюсухогонасыщенно- |
|
|
|
|
|
|
||||||||||
H = H |
; dH = 0, d 2H > 0. |
(9.2.5) |
|
min |
|
3. V = const, T = const, ò.å. dV = 0 è dT = 0; |
|
|
поскольку |
|
|
TdS |
d TS SdT , |
|
то уравнения первого и второго законов термодинамики можно записать как
dU d TS δ SdT PdV
èëè
d U TS δ SdT PdV . |
(9.2.6) |
Термодинамическая функция (U-TS) называется свободной энергией или изохорно-изотермическим потенциалом. Обозна- чим ее
F |
U TS. |
(*) |
Таким образом, |
|
|
dF δ 0 |
(9.2.7) |
|
и в состоянии равновесия |
|
|
F = F ; dF = 0, d 2F > 0. |
(9.2.8) |
|
min |
|
|
4. P = const, T = const, ò.å. dP = 0 è dT = 0, |
|
|
dH d TS δ SdT VdP. |
(9.2.9) |
|
Термодинамическая функция (H-TS) называется изобарно-изо- |
||
термическим потенциалом. Обозначим ее |
|
|
) |
H TS, |
(**) |
отсюда |
|
|
d) δ 0, |
|
|
Ô = Ô , dÔ = 0, d 2Ô > 0. |
(9.2.10) |
|
min |
|
|
Из уравнений (*) и (**) следует, что величины Ф и F связаны между собой соотношением
) F PV . |
(9.2.11) |
Заканчивая рассмотрение вопроса о термодинамических потенциалах, познакомимся также с понятием химического потенциала.
Глава 9
РАВHОВЕСИЕ ТЕРМОДИHАМИЧЕСКИХ СИСТЕМ И ФАЗОВЫЕ ПЕРЕХОДЫ
9.1. Гомогенные и гетерогенные
термодинамические системы
Гомогенной называется такая система, химический состав и физические свойства которой во всех ее частях одинаковы или изменяются непрерывно (без скачка) от одной точки системы к другой. Примером может являться мысленно выделенный столб воздуха, представляющий собой смесь ряда газов, в основном, азота и кислорода. В результате действия силы тяжести будут непрерывно изменяться от одной точки к другой как состав, так и физические свойства.
Гетерогенной называется система, состоящая из двух и более различных гомогенных областей. Гомогенные области в гетерогенной системе называются фазами. Каждая фаза отделена друг от друга поверхностью раздела, при переходе через которую скачкообразно изменяются химический состав или физические свойства вещества, например, вода с плавающим в ней льдом. Химический состав этих фаз одинаков, но физические свойства резко отличаются друг от друга.
Гомогенная система и каждая фаза гетерогенной системы могут состоять из одного или нескольких чистых веществ.
Гомогенная система или фаза гетерогенной системы, состоящая из нескольких чистых веществ, называется раствором или смесью.
Все чистые вещества и растворы могут находиться в четырех агрегатных состояниях: газообразном, жидком, твердом и плазменном.
9.2. Термодинамическое равновесие
Термодинамическое равновесие – это такое состояние, к которому при данных внешних условиях стремится термодинамическая система. Если внешние условия неизменны, то состояние равнове-
120 |
117 |
119 |
|
|
|
|
Всостоянииравновесия |
.2.(94) |
dHδ0. |
|
|
|
|
|
|
èëè |
.2.(93) |
dHδTdSVdP |
|
|
|
|
|
.2P=const,S=const,.å.òdP=0èdS=0, |
|
|
|
min |
.2.(92) |
,dU=0,dU>0. |
U=U |
|
2 |
|
|
кимобразом,всостоянииравновесия |
|
системыубывает,достигаяминимумавсостоянииравновесия;та- |
||
.е.тсприближениемксостояниюравновесиявнутренняяэнергия |
||
.2.(91) |
dUδ0, |
|
|
|
|
получаем,чтокритериемравновесиясистемыявляетсяусловие |
||
|
dUδTdSPdV, |
|
|
.1V=const,S=const,.å.òdV=0,dS=0 |
|
|
можныхслучаеввзаимодействиясистемысо.средой |
|
Hайдемкритерииравновесиядлякаждогоизэтихчетырехвоз- |
||
|
P=const,T=.const |
|
|
пературавсистемеоставалисьпостоянными: |
|
имеханическойработой,ностакимусловием,чтобыдавлениеитем- |
||
•системаможетобмениватьсясокружающейсредойитеплом, |
||
|
V=const,T=const; |
|
|
системыоставаласьпостоянной: |
|
мениватьсясокружающейсредойтепломтак,чтобытемпература |
||
•объемсистемысохраняетсяпостоянным,носистемаможетоб- |
||
|
P=const,S=const; |
|
|
энтропиясистемыоставалисьпостоянными: |
|
имеханическойработой,ностакимусловием,чтобыдавлениеи |
||
•системаможетобмениватьсясокружающейсредойитеплом |
||
|
V=const,S=const; |
|
|
пиясистемыоставаласьпостоянной: |
|
ниватьсясокружающейсредойтеплом,причемтак,чтобыэнтро- |
||
•объемсистемыостаетсяпостоянным,носистемаможетобме- |
||
118
|
|
сякравновесию,сокружающейсредой: |
||||||
Рассмотримрядусловийвзаимодействиясистемы,стремящей- |
||||||||
|
|
|
|
|
|
|
|
max |
|
<.0 |
,dS |
dS= |
, |
S=S |
|||
|
|
2 |
0 |
|
|
|
||
зом,всостоянииравновесиядляизолированнойсистемы |
||||||||
азнак”=”–ужедостигнутомусистемой.равновесиюТакимобра- |
||||||||
здесьзнак“>”соответствуетнеравновесномусостояниюсистемы, |
||||||||
|
|
|
|
0 |
dSτ |
|
|
|
|
|
|
|
, |
|
|
|
|
тогдаусловиеравновесиядляизолированнойсистемы |
||||||||
, |
dUPdV |
TdSτ |
0è |
dU=0;dV= |
||||
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
òåìû |
равновеснойизолированнойсистемеdS=.0Дляизолированнойсис- |
||||||||
имеетмаксимальновозможноедляданнойсистемызначение,.е.тв |
||||||||
.системыВсостоянииравновесияэнтропияизолированнойсистемы |
||||||||
Ранеемыустановиликритерийравновесиядляизолированной |
||||||||
|
тойчивогоравновесиядлячистых.веществ |
|||||||
устойчивого.равновесияРассмотримболееподробносостояниеус- |
||||||||
метастабильногосостояния,исистемаперейдетвновоесостояние |
||||||||
.яниеОднакодостаточносильноевоздействиевыведетсистемуиз |
||||||||
ствиеснято,системавозвратитсявисходноеметастабильноесосто- |
||||||||
переходувдругоесостояние;послетогокактакоевнешнеевоздей- |
||||||||
шиеповеличиневнешниевоздействия(возмущения)неприводятк |
||||||||
можетнаходитьсявтечениедлительноговремени,причемнеболь- |
||||||||
(метастабильноесостояние)–этосостояние,вкоторомсистема |
||||||||
Hаконец,состояниеотносительноустойчивогоравновесия |
||||||||
|
|
|
|
|
|
|
яниеустойчивого.равновесия |
|
титсявисходноесостояние,аперейдетвновоесостояние–состо- |
||||||||
весия(лабильноесостояние),изнеговывести,тоонауженевозвра- |
||||||||
Еслисистему,находящуюсявсостояниинеустойчивогоравно- |
||||||||
|
|
|
|
|
|
|
|
.равновесия |
воздействие,тосистемасамавозвратитсявисходноесостояние |
||||||||
стиизнегорассматриваемуюсистему,азатемснятьэтовнешнее |
||||||||
характернотем,чтоесликаким-либовнешнимвоздействиемвыве- |
||||||||
Состояниеустойчивогоравновесия(стабильноесостояние) |
||||||||
|
|
|
|
|
|
|
|
.равновесия |
состоянияустойчивого,неустойчивогоиотносительноустойчивого |
||||||||
сияудерживаетсявсистемескольугодно.долгоСледуетразличать |
||||||||
