
- •ФГБОУ ВО УГМУ Минздрава России Кафедра биохимии
- •Введение в биохимию
- •РАЗДЕЛЫ БИОХИМИИ КАК НАУКИ
- •Виды биохимических научных направлений и учебных дисциплин
- •Биохимия детского возраста
- •Возрастные периоды у детей
- •Федеральное государственное бюджетное образовательное учреждение высшего образования «Уральский государственный медицинский университет»
- •Структура дисциплины
- •Клиническая биохимия детского возраста
- •Цель электива
- •Методы исследования биохимии и смежных наук - аналитические физико-химические:
- •УЧЕБНЫЙ ПЛАН
- •Исследования в биохимии In silico
- •Методы исследования биохимической лаборатории ЛПУ
- •Задачи лекции в изучении биохимии
- •Учебный сайт каф. биохимии
- •Дисциплина «биохимия» в медицинских ВУЗах России (педиатрические факультеты), в т.ч. УГМУ
- ••Зав. учебно-метод. работой к.х.н. доцент Каминская Людмила Александровна
- •Направление научных исследований коллектива кафедры УГМУ
- •Тематика НИР каф. биохимии
- •НИРС (СНО) Публикационная активность студентов
- •Бывшие студенты Яковлев Н.,(2 курс ОЛД) Жиборкин Г. в биохимической лаборатории
- •Ст. 2 курса ОЛД Яковлев Н. проводит спектрофотометрический анализ крови лаб. животных
- •Н. Яковлев, ст. 2 курса, со стендовым докладом на международной конференции г. Астрахань
- •И.В. Гаврилов, В.Н. Мещанинов, Д.Ю. Гребнев, ст. 4 курса ОЛД М. Балуева, О.
- •Ст. 5 курса ОЛД М. Балуева, О. Молостова на 3 съезде геронтологов РФ,
- •Российский диплом 2 степени 3 Российского съезда геронтологов, Новосибирск, ст. 6 курса Балуева
- •Дипломы НОМУС УГМУ
- •В. Н. Мещанинов, Д. Л. Щербаков, В. А. Лукаш
- •Защищенные диссертации (10)
- •Сравнительная характеристика успеваемости ФАКУЛЬТЕТОВ по итоговой первичной аттестации студентов 2 курса по БАЗОВОЙ
- •Мнение студентов о взаимной связи практического занятия и лекции
- •Отношение к БРС
- •ВЛИЯНИЕ СТВОЛОВЫХ КЛЕТОК НА ОНТОГЕНЕЗ ЧЕЛОВЕКА
- •Белки-высокомолекулярные азотосодержащие
- •Структурная единица белка - аминокислоты
- •Белки: структура и функции.
- •Биологические функции белков.
- •Доказательства наличия пептидной связи.
- •Уровни организации белковой молекулы.
- •Вторичная структура
- •Четвертичная структура - олигомерное объединение субъединиц-протомеров в единую структуру, проявляющую характерные для данного
- •Физико-химические свойства белков
- •Белки – амфотерные электролиты. Заряд белковой молекулы.
- •ИЭТ – тот pH среды, при котором белок находится в изоэлектрическом состоянии. Заряд
- •Методы разделения белков по заряду
- •Молекулярная масса белков
- •Методы определения молекулярной массы белков
- •Методы определения (разделения) белков по массе
- •2. Гельхроматография (гельфильтрация)
- •Ультрафильтрация (молекулярные фильтры)
- •Растворимость
- •Влияет на растворимость:
- •2. Температура
- •Свойства белков в растворе
- •Денатурация – любое негидролитическое изменение структуры белка, приводящие к изменению его биологических и
- •Химическая (ковалентная) модификация
- •Выделение и очистка белка
- •Классификация белков
- •Простые
- •Сложные белки
- •Первичная структура
- •Третичная структура
- •Четвертичная структура
- •Производные гемоглобина
- •Типы гемоглобинов
- •Кровь взрослого человека
- •Фосфопротеиды
- •Гликопротеиды
- •Особенности действия ферментов
- •Специфичность
- •Строение ферментов
- •Субстрат
- •Алостерический центр
- •Аллостерический центр
- •Структура ферментов
- •В сложном ферменте простетическая группа может быть представлена:
- •коферменты
- •Косубстрат - кофермент, который присоединен к белковой части слабыми нековалентными связями
- •Кофакторы – это ионы металлов, необходимые для проявления каталитической активности ферментов
- •Номенклатура ферментов
- •Классификация ферментов
- •1. Оксидоредуктазы
- •2. Трансферазы
- •3. Гидролазы
- •4. Лиазы
- •5. Изомеразы
- •6. Лигазы (синтетазы)
- •БЛАГОДАРЮ ЗА ВНИМАНИЕ !

2. Гельхроматография (гельфильтрация)
lg,мм
106
105
104
х Vэ
Принцип антисита (медленно – мелкие, быстро – крупные молекулы)

Ультрафильтрация (молекулярные фильтры)
Диализ – неспособность молекул белка проходить через полупроницаемые мембраны – способ очистки белка от низкомолекулярных соединений.
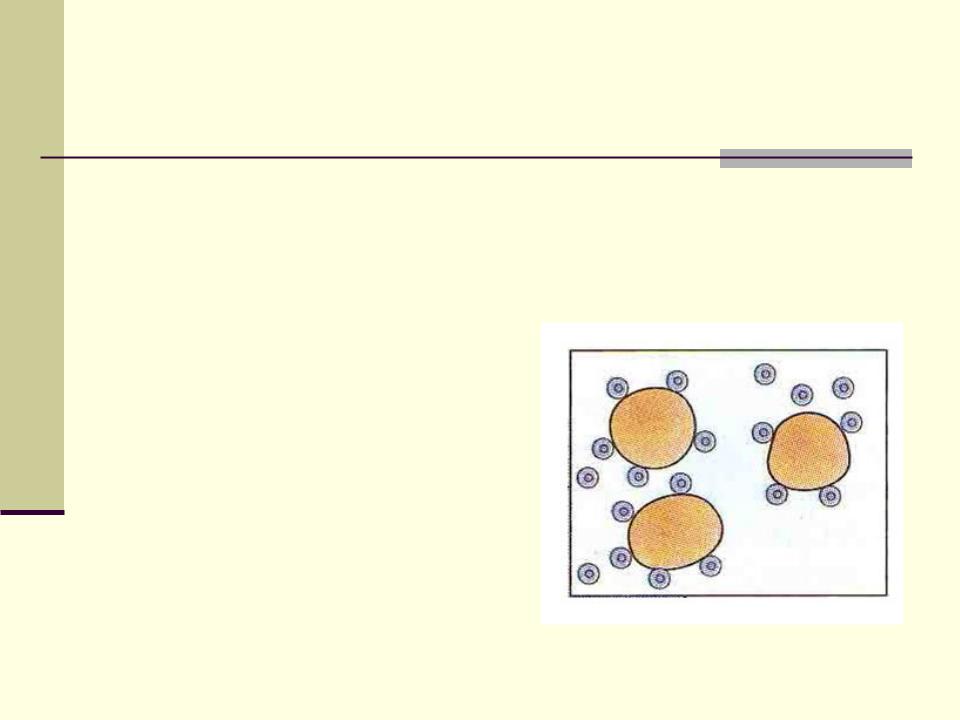
Растворимость
Зависит от:
АК состава (чем больше полярных групп, тем больше растворимость)
Особенностей организации молекулы (Г>Ф)
Свойств растворителя
Стабильность придают:
Заряд белковой молекулы
Наличие гидратной оболочки

Влияет на растворимость:
1. Концентрация нейтральных солей
Ионная сила раствора: |
|
|||
μ |
|
∑c ∙ b |
2 |
С – концентрация |
= |
|
b - валентность |
||
|
2 |
|
|
|
Высаливание – осаждение белка из раствора солями щелочных и щелочноземельных металлов (NH4)2SO4, Na2SO4
Процесс обратимый.
Каждый белок высаливается при определенной ионной силе (концентрации соли) A – 100%, Г – 50% (NH4)2SO4


2. Температура
растворимость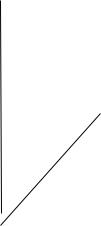
денатурация
40º t

3. pH
pH = pJ (0) изоэлектрическое осаждение
Методы фракционирования по растворимости:
Изоэлектрическое осаждение
Высаливание
Осаждение водоотнимающими средствами (спирт, ацетон на холоду по Кону)

Свойства белков в растворе
Медленно дифундируют
Не проходят через полупроницаемые мембраны
Опалесцируют
Рассеивают свет
Способны к набуханию
Характеризуются высокой вязкостью
Обладают низким Росм и высоким Ронк
Поглощают УФ λ=280нм

Денатурация – любое негидролитическое изменение структуры белка, приводящие к изменению его биологических и физико- химических свойств
Нативный белок – белок с неизменной структурой и свойствами.
Факторы денатурации:
Физические (t, давление, УЗ)
Химические (кислоты, щелочи, тяжелые металлы)
Биологические (протеолитические ферменты) Признаки денатурации:
Потеря биологической активности;
Изменение конформации белковой молекулы;
Увеличение числа функциональных групп (появляются гидрофобные);
Уменьшение растворимости и осаждение;
Изменение вязкости, оптической активности, прозрачности растворов белка;
Изменение окрашиваемости (гистология);
Большая доступность действию протеолитических ферментов.

Химическая (ковалентная) модификация
1) |
Фосфатная модификация |
ОН |
|
|
Белок-ОН + АТФ |
ПК |
Белок – О – Р = О |
|
Протеин- |
||
|
(сер, тир, тре) |
ОН |
|
|
|
фосфатаза |
|
2) |
Ацетатная модификация |
СН3 |
|
Белок – ОН + СН2СО~SKoA |
Белок – О – С = О |
||
3)Метилирование
4)Аминирование
5)АДФ-рибозилирование
Химическая модификация – способ регуляции функциональной активности белка in vivo
