
- •Таблица 3
- •Удельная теплоемкость стекла (Ст) равна 0,753 Дж/г·град, раствора (Ср) – 4,184 Дж/г·град, ρ – плотность раствора – 1 г/мл, V и С – объем и молярная концентрация кислоты (основания).
- •РАБОТА 8. БУФЕРНЫЕ СИСТЕМЫ
- •Таблица 8
- •Таблица 9
- •ЦЕЛЬ ЗАНЯТИЯ:
- •ОПЫТ 1. Определение поверхностной активности веществ
- •ОПЫТ 3. Зависимость величины адсорбции от природы сорбента
- •ОПЫТ 4. Зависимость величины адсорбции от природы растворителя
- •ОБРАЗЕЦ ОТВЕТА НА КОНТРОЛЬНЫЕ ВОПРОСЫ:
- •ЦЕЛЬ ЗАНЯТИЯ:
- •ЗАДАНИЕ:
- •Таблица 19
- •КОНТРОЛЬНЫЕ ВОПРОСЫ:
- •ЛИТЕРАТУРА:
- •Таблица 21
|
|
|
Таблица 11 |
|
Исследуемая |
Среднее число |
σ, Эрг/см2 |
Наличие желчи |
|
жидкость |
капель, n |
|||
|
|
|||
Вода |
|
72,75 |
|
|
Моча № 1 |
|
|
|
|
Моча № 2 |
|
|
|
ВЫВОДЫ:
1.Поясните, почему σ мочи отличается от σ воды?
2.Укажите роль солей желчных кислот в моче (ПАВ или ПИАВ).
3.Определите содержание солей желчных кислот (нормальное, выше нормы, ниже нормы).
ОПЫТ 3. Зависимость величины адсорбции от природы сорбента
Выполнение: в пробирку налейте смесь (1:1) водных растворов метиленовой сини и эозина (флуоресцина) и добавьте немного измельченного мела. Содержимое пробирки взболтайте и фильтруйте через предварительно смоченный фильтр на воронке. Сравните цвет полученного фильтрата с цветом
исходной смеси красителей.
ПРИМЕЧАНИЕ: формула метиленовой сини – С16Н18N3+Cl-, флуоресцина – С20Н12О5, эозина – С20Н8О5Br4.
ВЫВОДЫ:
1.Учитывая взаимную полярность сорбента и красителей, поясните, почему сорбируется только метиленовая синь.
2.Укажите вид адсорбции красителя на меле.
3.Составьте схему адсорбции.
ОПЫТ 4. Зависимость величины адсорбции от природы растворителя
Выполнение: в одну пробирку налейте 5 мл водного раствора метиленовой сини, а в другую – столько же спиртового раствора этого красителя. В каждую пробирку добавьте равные порции активированного угля. Содержимое пробирок взболтайте и быстро фильтруйте. Сравните окраски фильтратов. Аналогично проведите опыт по адсорбции на меле.
ВЫВОДЫ:
36

1.Поясните, почему краситель лучше адсорбируется из водного раствора, учитывая полярность сорбента и растворителей (правило Ребиндера).
2.Сравните величину адсорбции красителя на угле и меле.
3.Составьте схемы адсорбции.
КОНТРОЛЬНЫЕ ВОПРОСЫ:
1.Какое поверхностное натяжение имеют водные растворы NaCl, Na2SO4, этилового спирта, стирального порошка «Лотос» по отношению к воде? К какому типу веществ они относятся (ПАВ или ПИАВ)?
2.Исследуйте влияние природы сорбента и сорбтива на процесс
адсорбции на примере: водный раствор метиленовой сини С16Н18N3+Cl-, водный раствор FeCl3, адсорбент – уголь. Сделайте выводы о влиянии природы растворителя на процесс адсорбции.
3.Исследуйте процесс адсорбции красителя метил-виолет на угле и на меле из водного и спиртового растворов. Сделайте выводы о влиянии природы растворителя на процесс адсорбции. Сравните полноту адсорбции на угле и на меле.
ОБРАЗЕЦ ОТВЕТА НА КОНТРОЛЬНЫЕ ВОПРОСЫ:
ВОПРОС: Какое из веществ будет наиболее полно
адсорбироваться на поверхности угля из водного раствора:
метил-виолет С16Н18N3+Cl- или малахитовый зеленый
С23Н25N2+Cl-?
ОТВЕТ: Красители имеют дифильную природу, уголь – неполярный адсорбент, поэтому на нем будут адсорбироваться малополярные (дифильные) вещества. Вода – полярный растворитель и не имеет сродства к сорбенту, поэтому конкуренции растворителя и сорбтива не произойдет.
СХЕМА АДСОРБЦИИ
Из двух красителей наиболее полно будет адсорбироваться метил-виолет, т.к., согласно правилу Дюкло-Траубе, поверхностная активность органических веществ одного гомологического ряда возрастает в 2-3 раза с ростом углеродной цепи на группу –СН2– .
ЛИТЕРАТУРА:
37
1. С. 423-446; 3. С. 153-167; 5. С. 101-107; 6. С. 681-702.
38
РАБОТА 10. ХРОМАТОГРАФИЯ
Хроматографические методы находят широкое применение в клинической практике. Хроматографию на бумаге и тонкослойную хроматографию используют для определения аминокислот, углеводов, нуклеотидов, кетокислот и гормонов и др. в биологических жидкостях (сыворотка крови, моча, слюна, пот) или в экстракте из тканей в норме и при различных патологических состояниях. Методом хроматографии на бумаге установлены состав и содержание некоторых веществ при заболеваниях с нарушением азотистого обмена, например, при болезнях печени, почек, недостаточности витаминов, психических заболеваниях, вызванных токсическим действием отдельных аминокислот.
Аминоизомасляная кислота впервые была открыта в моче при помощи бумажной хроматографии. Эта аминокислота встречается в больших количествах у отдельных индивидуумов (семейный признак), она найдена примерно у 5-10 % населения.
Аминоацидурия хроматографически определяется при почечной коме и некрозах печени, злокачественных новообразованиях, нефритах, ожогах, голодании. Обнаружение на хроматограммах в моче детей аргининянтарной кислоты (АЯК) впервые позволило описать и выяснить патогенез наследственного психического заболевания детей, названного аргининянтарной ацидурией. Высокое содержание АЯК в цереброспинальной жидкости вызывает отравление центральной нервной системы. Тонкослойную хроматографию на оксиде алюминия и силикогеле используют для качественного и количественного определения гормонов коры надпочечника (17-кетостероидов) и половых гормонов (андростерона и эстрогенов) в плазме, крови и моче. Этот метод применяют для ранней диагностики беременности и гормональных заболеваний.
Сочетание электрофореза и бумажной хроматографии впервые позволило установить различие в аминокислотном составе нормального гемоглобина человека и гемоглобина больных серповидноклеточной анемией, положив начало изучению болезненных процессов, совершающихся на молекулярном уровне.
39
Хроматография оказалась незаменимой для изучения патогенеза болезней, протекающих с нарушением различных других сторон обмена веществ, что открыло новые диагностические возможности и указало пути рациональной терапии некоторых заболеваний. Широкое применение находит хроматография в судебно-медицинской экспертизе.
ЦЕЛЬ ЗАНЯТИЯ:
1.Освоить экспериментальные методы разделения красителей с помощью метода бумажной хроматографии.
2.Освоить экспериментальный метод разделения ионов методом колоночной хроматографии.
3.Освоить экспериментальный метод разделения компонентов мочи на анионите.
4.Научиться оценивать разделение компонентов с помощью расчета отношения скоростей их перемещения к скорости перемещения фронта растворителя (величина Rf).
5.Научиться идентифицировать вещество на основании сопоставления скоростей и перемещения его и «свидетеля» по слою сорбента.
6.Научиться качественно оценивать разделение компонентов, близких по химической природе.
ЗАДАНИЕ:
Выполните четыре опыта, дайте оценку использованных методов по механизму и технике выполнения, объясните положение окрашенных зон в бумажной и колоночной хроматографии, рассчитайте Rf у компонентов смеси и у «свидетелей». Напишите схему ионного обмена при поглощении и элюировании, подтвердите выделение ионов ОН- в растворе при поглощении и С1- в элюате, оформите отчет.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ К ВЫПОЛНЕНИЮ РАБОТЫ:
ОПЫТ 1. Разделение медпрепаратов методом бумажной хроматографии (демонстрационный)
В пробирку налейте по 1 мл Н2О, толуола и 10 капель смеси, состоящей из растворов I2 и бриллиантового зеленого. Пробирку закройте пробкой и хорошо встряхните. Смесь разделится на две окрашенные зоны. Затем на полоске фильтровальной бумаги
40
проведите стартовую линию карандашом на расстоянии 1 см от края. Поставьте точку в центре линии стеклянной палочкой, смоченной смесью I2 и «зеленки».
В стакан (100-150 мл) налейте 5 мл смеси растворителей (Н2О + толуол), опустите в эту смесь конец бумажной полоски и оставьте на некоторое время. Когда будет ясно видно два цветных пятна на бумаге, отметьте карандашом фронт распространения растворителя. Проведите прямую через центр нанесенной капли и образовавшихся пятен, измерьте расстояние от центра нанесенной капли до центра каждого пятна и занесите в табл. 12 полученные результаты.
|
|
|
Таблица 12 |
|
Название |
Длина пути |
Длина пути фрон- |
Величина |
|
компонента |
компонента |
та растворителя |
коэффициента |
|
смеси |
|
|
подвижности |
|
|
|
|
|
|
Объясните распространение цветных пятен, учитывая, что бумага отрицательно заряжена, вода полярный, а толуол неполярный растворитель.
ОПЫТ 2.
а) Разделение красителей методом бумажной хроматографии
В стакан (100-150 мл) налейте 0,1 М раствор NaOH. Фильтровальную бумагу вырежьте полоской 30 мм и укрепите на проволоке. Простым карандашом нанесите стартовую линию на расстоянии 3 см от нижнего края полоски и финишную линию для растворителя на расстоянии от стартовой линии 7-8 см. На стартовой линии отметьте карандашом центры для четырех капель. Хорошо отточенными спичками нанесите чистые красители в отмеченные центры в следующей последовательности от левого края бумаги: 1) тимоловосиний; 2) метилкрасный; 3) фуксин.
На предметное стекло нанесите по 1 капле фуксина и метилкрасного и 2 капли тимоловосинего красителя, а затем чистой спичкой перемешайте капли и также нанесите смесь на подготовленную бумажную полоску. Затем опустите бумажную полоску с нанесенными каплями в стакан с раствором 0,01 М
41
NaOH таким образом, чтобы проволока лежала на краях стакана. Когда фронт растворителя достигнет финишной прямой, выньте полоску из стакана и аккуратно подсушите над электроплиткой. Проведите параллельные прямые из центра капель до финишной прямой и замерьте это расстояние до центра каждого цветного
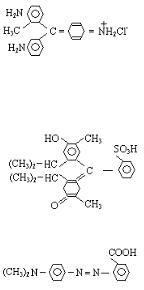
пятна. Заполните такую же таблицу, как в опыте 1. Учитывая, что формула фуксина
или: R(NH2)+3Cl-
тимолового синего
или: R/−SO3H(α1)
и метилового красного СООН
или: R//−COOH(α2),
объясните распределение цветных пятен, если бумага отрицательно заряжена.
б) Разделение сахаров методом круговой бумажной хроматографии
Выполнение: в фильтре диаметром 12-13 см вырежьте от края к центру полоску шириной 4-5 мм и отогните ее под прямым углом к плоскости фильтра. На расстоянии 0,5 см от центра фильтра по кругу нанесите капилляром раствор смеси сахаров и растворы чистых сахаров («свидетели»). Места нанесения капель (старт) отметьте предварительно карандашом. Капли аккуратно подсушите над электроплиткой. В чашку Петри налейте 10 мл смеси растворителей: бутанол-ацетон-вода (соотношение 7:2:1) и сверху поместите фильтр, погрузив вырезанный сектор в растворитель. Бумагу прижмите второй чашкой Петри. Когда фронт жидкости дойдет до края чашки, бумагу высушите и
42
проявите сахар анилинфталатом. Зарисуйте хроматограмму. Данные занесите в табл. 12, как в опыте 1.
1.Дайте оценку использованного метода распределения по механизму и технике выполнения.
2.Укажите, какие из растворителей выполняют роль подвижных и неподвижных.
3.Укажите, какой компонент смеси обладает большей подвижностью и почему.
в) Разделение α-аминокислот методом радиальной бумажной хроматографии
Радиальную хроматографию проводят на бумаге в чашке Петри. Растворитель перемещается от центра к периферии и захватывает аминокислоты, которые распределяются на концентрических кругах и обнаруживаются после высушивания бумаги и обработки нингидриновым реактивом.
Выполнение: в фильтре диаметром 12-13 см вырежьте в центре отверстие диаметром 1,0 см. Простым карандашом разделите круг на четыре части и поместите его на ножку из фильтровальной бумаги в виде трубочки высотой 2 см, вставленной в отверстие диска. Диск держите за края, чтобы избежать появления пальцев на хроматограмме.
Отступив от центра 1 см в каждом секторе, отмерьте карандашом растворы индивидуальных α-аминокислот (1,2,3) и раствор их смеси (4). Бумагу просушите на воздухе в течение 10 мин.
На дно чашки Петри налейте 10 мл раствора смеси растворителей: бутанол-уксусная кислота-вода (соотношение 4:1:1) и сверху поместите фильтр, чтобы ножка упиралась в дно.
Бумагу накройте плотно второй чашкой Петри. Когда фронт
жидкости дойдет до края чашки, бумагу пинцетом поместите в сушильный шкаф на 10 мин (90-100 оС) или просушите над электроплиткой.
Для выявления пятен хроматограмму опрыскайте нингидриновым раствором или сухую хроматограмму одним движением смочите раствором нингидрина, налитого в чашку Петри. Хроматограмму поместите на 5 мин в термостат с целью удаления растворителя и фиксации аминокислоты в виде отдельных полос, окрашенных в розово-фиолетовый цвет, где
43
каждое пятно соответствует определенной аминокислоте. Зарисуйте хроматограмму или данные ее занесите в табл. 12.
ОПЫТ 3. Разделение ионов Fe3+, Cu2+, Co2+ методом колоночной хроматографии
На чистом предметном стекле смешайте по 2 капли растворов солей Fe2(SO4)3, CuSO4, Co(NO3)2. Чистой пипеткой по 1 капле (но не более трех капель) закапывайте в центр колонки с оксидом алюминия. Каждый ион в колонке образует определенное место (зону). Зарисуйте полученную хроматограмму и укажите положение зоны каждого иона смеси. Дайте оценку использованного метода разделения по механизму и технике выполнения. Объясните положение окрашенных зон в колонке.
ОПЫТ 4. Выделение из мочи хлоридов методом ионообменной хроматографии (демонстрационный)
В стаканчик налейте 4-5 мл мочи (разбавлена в 15 раз) и определите рН с помощью индикаторной бумаги. Медленно пропустите мочу через колонку с анионитом. Определите рН вытекающего раствора (по индикаторной бумаге). Затем колонку промойте водой до рН = 7, после чего извлеките ионы С1-. Для этого медленно пропустите через колонку 4 мл 1 М раствора
NaOH.
Качественной реакцией с AgNO3 (1-2 капли) проверьте наличие ионов С1- в элюате. По окончании опыта промойте колонку водой до рН = 7 по индикаторной бумаге.
Напишите уравнения реакций ионного обмена при поглощении и элюировании.
КОНТРОЛЬНЫЕ ВОПРОСЫ:
1.Какие виды хроматографии вам известны?
2.Преимущество применения хроматографии перед другими методами анализа.
3.Разделите бром тимоловый синий и метиловый фиолетовый, зная, что их формулы R-SO3H и R//=N+(CH3)2Cl-. Объясните
распределение окрашенных зон, если адсорбент (бумага) имеет отрицательный заряд.
4. Выделите ионы Са2+ из плазмы крови на катионите в Н-форме.
44
5. Разделите Hg2+ и Со2+ на колонке с А12О3. Напишите уравнения реакций, если проявить колонку NaOH до поглощения катионов. Напишите качественные реакции на Hg2+ и Со2+ с NaOH. Объясните предполагаемое положение окрашенных зон. укажите вид хроматографии по механизму и технике.
ОБРАЗЕЦ ОТВЕТА НА КОНТРОЛЬНЫЕ ВОПРОСЫ:
ВОПРОС: Как, пользуясь методом ионообменной хроматографии, выделить из плазмы крови ионы Са2+? Укажите все стадии процесса и подтвердите их соответствующими уравнениями реакций.
ОТВЕТ: 1. Для перевода катионита в Н-форму колонка со смолой должна быть предварительно выдержана в растворе кислоты.
2.Для того чтобы убрать лишнюю кислоту, колонку промывают водой до тех пор, пока рН вытекаемой жидкости не станет равным 7.
3.Через колонку пропускают раствор плазмы крови, содержащей
ионы Са2+. Происходит стадия сорбции: 2R-H + Ca2+ → R2Ca + 2H+. Универсальной индикаторной бумагой проверяют содержащиеся в элюате Н+: рН < 7. Процесс необходимо вести в динамическом режиме.
4.Затем колонку промывают вновь водой, чтобы отмыть ее от частиц, не адсорбированных на сорбенте.
5.Затем проводят стадию десорбции (элюирования): R2Ca + 2H+ → 2R-H + Ca2+. Колонка восстанавливает Н-форму и готова к работе. Ионы Са2+ можно подтвердить в элюате реакцией взаимодействия в щелочной среде (аммиачный буфер) с металлиндикатором хромоген черный, окрашивающим раствор в розовый цвет.
ЛИТЕРАТУРА:
1. С. 446-449; 3. С. 168-174; 5. С. 107-113; 6. С. 702-707.
45
РАБОТА 11. СТРУКТУРООБРАЗОВАНИЕ. ИЗОЭЛЕКТРИЧЕСКАЯ ТОЧКА БЕЛКОВ
Ворганизме человека и животных многие жидкости и плотные ткани содержат высокомолекулярные соединения, среди которых наибольшее значение имеют белки. Белки – полимеры аминокислот – являются полиэлектролитами. Каждый белок характеризуется определенным значением рН, когда он является нейтральной частицей (рНИЭТ). Величина рНИЭТ различных белков колеблется в широких пределах.
Реакция крови сдвинута в щелочную сторону от рНИЭТ белков плазмы и гемоглобина, поэтому эти белки находятся в крови в виде анионов. Являясь сильными сопряженными основаниями, они связывают кислые продукты метаболизма и играют существенную роль в механизме буферного действия крови. В клиническом анализе при электрофоретическом разделении белков сыворотки крови, мочи, спинномозговой жидкости величину рНИЭТ необходимо знать при выборе поддерживающей среды.
Вживом организме примером студней, образованных ВМС, могут служить протоплазма клетки, хрусталик глаза. Процессы обезвоживания и набухания ВМС наблюдаются при регенерации тканей, отеках, воспалениях. Процессы старения белков связаны со структурообразованием полимеров. Биологическое значение процессов старения студней проявляется в изменении проницаемости клеточных мембран, что вызывает нарушение обмена клетки с окружающей средой. Образование слоистых камней в желчном пузыре и почках объясняется периодичностью химических реакций в студнях. Этим же свойством студней пользуются при иммунологических методах исследований плазменных и сывороточных белков (образование преципитатов при реакциях между антителами и антигенами).
Полученные знания помогут студентам-медикам при изучении курсов нормальной анатомии (создание искусственных органов), хирургии (применение искусственных органов), микробиологии
46
(искусственные среды), гигиены питания, фармакологии (изучение лекарственных форм).
ЦЕЛЬ ЗАНЯТИЯ:
1.Освоить экспериментальные методы определения изоэлектрической точки белков.
2.Научиться получать студни и гели.
3.Ознакомиться с явлениями синерезиса и периодических структур.
ЗАДАНИЕ:
Выполните пять опытов, дайте объяснения механизма и напишите уравнения реакций в демонстрационных опытах.
ЗАДАНИЕ 1.
Определите рН изоэлектрической точки по набуханию.
ЗАДАНИЕ 2.
Определите рН изоэлектрической точки по высаливанию (осаждение).
ЗАДАНИЕ 3.
Определите ИЭТ белка методом электрофореза (демонстрационный).
ЗАДАНИЕ 4.
Получите гель кремниевой кислоты, покажите необратимость процесса гелеобразования.
ЗАДАНИЕ 5.
Получите студень желатина и докажите обратимость студнеобразования.
ЗАДАНИЕ 6.
Дайте объяснение периодическим реакциям в студнях.
ЗАДАНИЕ 7.
Объясните явление синерезиса в студнях на примере крахмала.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ К ВЫПОЛНЕНИЮ РАБОТЫ:
ОПЫТ 1. Определение ИЭТ белка по набуханию
В пять сухих мерных пробирок насыпьте по 0,5 мл сухого измельченного желатина. К ним осторожно добавьте по 5 мл ацетатных буферов с рН 3,8; 4,4; 4,9; 5,4; 5,7 и перемешайте. Через 15-20 мин измерьте объем набухшего желатина в каждой пробирке. Результаты занесите в табл. 13.
Таблица 13
47
рН растворов |
3,8 |
4,4 |
4,9 |
5,4 |
5,7 |
Объем набухшего желатина, мл |
|
|
|
|
|
ВЫВОДЫ:
1.Укажите рНИЭТ желатина и обоснуйте ответ.
2.Объясните, почему при этом рН набухание минимальное.
ОПЫТ 2. Определение ИЭТ белка по высаливанию
В пять сухих мерных пробирок налейте по 2 мл ацетатных
буферных растворов с рН 3,8; 4,4; 4,9; 5,4; 5,7 и по 1 мл 0,5 % раствора желатина, перемешайте. Затем добавьте в каждую пробирку по 3 мл ацетона и снова быстро перемешайте. Занесите в табл. 14 результаты наблюдения, оценивая степень помутнения.
Таблица 14
рН растворов |
3,8 |
4,4 |
4,9 |
5,4 |
5,7 |
Степень помутнения |
|
|
|
|
|
ВЫВОДЫ:
1.Укажите рНИЭТ желатина на основании опытных данных.
2.Объясните, почему осаждение белка в этом случае максимально. При объяснении учтите механизм осаждения белка под действием ацетона
ОПЫТ 3. Определение ИЭТ белка методом электрофореза
В три U-образные трубки пипеткой налейте по 10 мл буферных
растворов с рН 3,8; 4,7; 5,7 и осторожно по 1 мл 0,4 % раствора казеина. Потом с помощью тонкого капилляра по стенке трубки добавьте дистиллированную воду (сохраните резкую границу раздела белка и воды). В воду погрузите два платиновых электрода и включите постоянный ток (100 В). Через 20-30 мин отметьте высаливание белка. Результаты опытов занесите в табл. 15.
|
|
|
Таблица 15 |
||
рН растворов |
3,8 |
4,4 |
|
4,9 |
|
Наличие осаждения |
|
|
|
|
|
Заряд частиц белка (+, −, 0) |
|
|
|
|
|
ВЫВОДЫ: |
|
|
|
|
|
1.Определите рНИЭТ казеина по результатам опыта.
2.Объясните механизм электрофореза белка.
48
3. Объясните, почему при рНИЭТ частицы белка наименее подвижны.
ОПЫТ 4. Получение геля
а) В пробирку налейте 5 мл 20 % раствора силиката натрия и при перемешивании стеклянной палочкой добавьте 3 мл 2 М H2SO4. Образуется аморфный продукт, через несколько минут переходящий в белый гель. При стоянии в течение часа на его поверхности появляются капли жидкости.
б) В пробирку поместите несколько кусочков ксерогеля кремниевой кислоты, добавьте 5 мл дистиллированной воды, сделайте вывод об обратимости или необратимости процесса гелеобразования.
ВЫВОДЫ:
1.Напишите уравнение реакции получения геля кремниевой кислоты.
2.Укажите строение мицеллы, полученной при избытке H2SO4.
3.Объясните, какой процесс происходит при стоянии геля.
ОПЫТ 5. Получение студня
а) Налейте в пробирку 2-3 мл горячего 6 % раствора желатина и охладите под струей воды из водопроводного крана. Объясните, почему желатин не выливается из пробирки.
б) К небольшому количеству измельченного желатина в пробирке добавьте 5 мл дистиллированной воды, перемешайте и дайте набухнуть при комнатной температуре. сделайте вывод об обратимости процесса студнеобразования.
ОПЫТ 6. Периодические реакции в студнях (демонстрационный)
Запишите реакцию между AgNO3 и K2Cr2O7, зарисуйте концентрические кольца бурого цвета, полученные в чашке Петри. Чем объясняется неравномерность распределения осадка в студне?
ОПЫТ 7. Явление синерезиса (демонстрационный)
К полученному при стоянии студня крахмала и раствору над ним добавьте I2. Что представляет собой явление синерезиса?
КОНТРОЛЬНЫЕ ВОПРОСЫ:
1. Если в смеси имеется два белка, рНИЭТ = 4,7; рНИЭТ = 9,5, к какому электроду они будут передвигаться при рН = 8,5?
49
2.У белка рНИЭТ = 9,7. Будет ли краситель, имеющий отрицательный заряд, взаимодействовать с этим белком в нейтральной среде?
3.Покажите, пользуясь схемой гелеобразования, является ли образование геля Fe(OH)3 обратимым.
4.Будет ли синерезис ускоряться, если при этом рН = рНИЭТ? дайте ответ, основываясь на структуре ВМС при рНИЭТ.
ОБРАЗЕЦ ОТВЕТА НА КОНТРОЛЬНЫЕ ВОПРОСЫ:
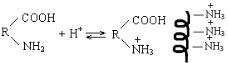
ВОПРОС: При каком рН надо делить белки на катионите? ОТВЕТ: На катионите можно отделить положительно заряженные ионы от нейтральных и отрицательных. При рН <
рНИЭТ частицы белка имеют заряд (+) и строение растянутой спирали:
Поэтому через катионит надо пропускать смесь белков в буферном растворе с таким значением рН, чтобы одни
находились в форме
R |
/ COOH |
|
|
||
|
||
|
\ N H |
|
|
3 |
(рН < рНИЭТ), а остальные при рН >
рНИЭТ или рН = рНИЭТ.
ЛИТЕРАТУРА:
1. С. 539-540, 544-545; 3. С. 215-218, 229-234, 239, 242-244; 5. С. 127-128; 6. С. 748-751.
50
РАБОТА 12. ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ И СПЛАВОВ
Актуальность темы обусловлена тем, что металлы и сплавы находят широкое применение в медицине. В терапевтической стоматологии сплавы металлов на основе ртути, галлия используются в качестве постоянных пломбировочных материалов. сплавы на основе золота, серебра, нержавеющей стали на основе железа с добавками хрома, никеля, кобальта, марганца используются для изготовления протезов в ортопедической стоматологии. В качестве материалов припоев для спаивания отдельных деталей протезов также применяются сплавы. Все используемые материалы должны обладать химической и электрохимической устойчивостью.
Знание о поведении металлов и сплавов в различных средах, их коррозионной устойчивости необходимо при последующем изучении курсов терапевтической и ортопедической стоматологии.
ЦЕЛЬ ЗАНЯТИЯ:
1.Ознакомиться с явлением электрохимической коррозии металлов в различных средах.
2.Научиться записывать электрохимические процессы на электродах.
3.Научиться оценивать возможность протекания анодного и катодного процессов.
4.Ознакомиться с явлением пассивации металла.
ЗАДАНИЕ:
Выполните три лабораторных опыта и составьте отчет по работе.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ К ВЫПОЛНЕНИЮ РАБОТЫ:
ОПЫТ 1. Коррозия металлов в нейтральной среде
Выполнение: в U-образную трубку налейте раствор NaCl, к которому добавьте 2-3 капли фенолфталеина и красной кровяной соли K3[Fe(CN)6]. В одно колено трубки опустите очищенный железный гвоздь, в другое – медную проволоку. Оба электрода соедините проводником. Что при этом наблюдаете?
ВЫВОДЫ:
51
1. Учитывая значения потенциалов Ео 2 |
/ Fe |
0,44B, |
Fe |
|
E |
o |
2 |
|
0,34B, |
|
Cu |
/ Cu |
||||
|
|
|
o |
|
|
|
E |
2H |
|
|
O |
2 |
O/ 4OH |
|
2 |
|
|
0,4B
,
напишите электрохимические процессы на электродах. Какой из металлов окисляется, т.е. подвергается коррозии и почему?
2.Объясните появление малинового окрашивания в колене с медным электродом.
3.Объясните, почему в колене с железным электродом раствор становится синим?
ОПЫТ 2. Коррозия металлов в кислой среде
Выполнение: а) в одну пробирку налейте 3 мл 0,1 М раствора
НС1, в другую – 3 мл 1 М раствора НС1. Опустите в эти пробирки кусочки железа (гвозди).
По выделению пузырьков водорода судите о протекании коррозии. Оцените, имеются ли различия в скорости коррозии железа в растворах с различной концентрацией ионов водорода.
б) Опустите в пробирку с кислотой медную проволочку. Убедитесь в отсутствии коррозии.
в) Поместите в эти же растворы кислот кусочки цинка. Оцените скорость коррозии цинка в разбавленном и концентрированном растворах кислот.
г) Коснитесь кусочка цинка в разбавленном растворе железным гвоздем. Наблюдайте интенсивное выделение водорода на железе. Опустите в раствор медную проволоку и наблюдайте выделение водорода на ней при касании цинка.
ВЫВОДЫ:
1.Напишите уравнения катодного и анодного процессов коррозии железа и цинка. Докажите возможности ее протекания, учитывая значения потенциалов процессов. Почему коррозия меди в кислоте не протекает?
2.Исходя из независимости скорости коррозии железа от концентрации кислоты и возрастания скорости коррозии цинка с концентрацией кислоты, определите, скорость какого процесса (катодного или анодного) определяет скорость коррозии.
52
3. Объясните, почему при касании цинка железом или медью скорость коррозии возрастает. На поверхности каких металлов происходит катодный и анодный процессы?
ОПЫТ 3. Пассивация железа
Выполнение: зачищенный гвоздь опустите в раствор K2CrO4, затем, промыв водой, в раствор CuSO4. Наблюдается ли изменение цвета поверхности гвоздя?
Потерев гвоздь о стенку сосуда, вновь опустите его в раствор с CuSO4. Что происходит?
ВЫВОДЫ:
1.Укажите, какая реакция может протекать на поверхности железа при погружении его в раствор сульфата меди.
2.Объясните, почему после обработки железа в растворе K2CrO4 медь не выделяется на поверхности железа?
3.Объясните влияние трения.
КОНТРОЛЬНЫЕ ВОПРОСЫ:
1.Корродирует ли железо в кислой среде? Корродирует ли медь в кислой среде? Протекает ли коррозия этих металлов в кислой среде в присутствии кислорода? Запишите уравнения анодного и катодного процессов.
2.Объясните, за счет чего происходит процесс электрохимической коррозии медной амальгамы в полости рта.
E |
o |
|
|
|
0,34B, |
E |
o |
|
|
|
Cu |
2 |
|
/ Cu |
Hg |
2 |
|
||||
|
|
|
||||||||
|
|
|
|
|
|
|
0,85B. / Hg
Чем можно объяснить высокую коррозионную устойчивость серебряной амальгамы?
EoAg / Ag 0,80B
3. Поясните, почему нежелательны стальные протезы при наличии металлических пломб в полости рта? Запишите уравнения возможных процессов.
ЛИТЕРАТУРА:
2. С. 234-237; 5. С. 98-100; 6. С. 654-661.
53
РАБОТА 13. МЕТОД КОМПЛЕКСОНОМЕТРИИ. ОПРЕДЕЛЕНИЕ ОБЩЕЙ ЖЕСТКОСТИ ВОДЫ (для медико-профилактического факультета)
Вода, содержащая большое количество солей кальция и магния, называется жесткой. Жесткость воды определяется количеством ммоль экв ионов кальция и магния в 1 л воды. Жесткость природных вод меняется в широких пределах. Она различна в различных водоемах и в разное время года. Имеется следующая примерная классификация вод: до 4 ммоль экв/л – мягкая; 4-8 – средней жесткости; 8-12 – жесткая: 12 – очень жесткая.
Очень жесткая вода при нагревании дает накипь, затрудняет окраску и стирку, не годится для ряда производств. Установлено, что жесткость воды влияет на состояние и деятельность сердечно-сосудистой системы.
ЦЕЛЬ ЗАНЯТИЯ:
1.Ознакомиться с возможностями метода трилонометрии.
2.Научиться записывать реакции образования внутрикомплексных соединений.
3.Познакомиться с условиями проведения анализа, выбором индикатора.
4.Освоить методику трилонометрического титрования.
5.Овладеть методикой трилонометрического определения содержания ионов кальция и магния в водопроводной воде.
6.Научиться на основании результатов титрования рассчитывать содержание ионов Са2+ и Mg2+ в воде.
ЗАДАНИЕ:
Выполните трилонометрическое определение содержания ионов Са2+ и Mg2+ и рассчитайте жесткость воды в ммоль экв/л. Представьте отчет.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ К ВЫПОЛНЕНИЮ РАБОТЫ:
Рабочий раствор: трилон Б СЭ = 0,01 моль экв/л. Вспомогательный раствор: аммиачно-буферный (рН = 9,5-10,0). Индикатор: хромоген черный.
Способ титрования: прямой.
54
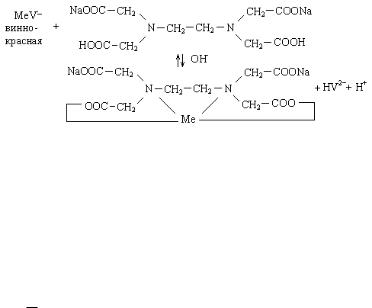
Для установления точки эквивалентности используется индикатор хромоген черный, который в зависимости от рН раствора ионизирует по-разному:
H3V |
↔ H2V- + H+ |
↔ HV2- + 2H+ |
↔ V3- + 3H+ |
рН<6 |
pH=6 |
pH=7-11 |
pH>11,5 |
|
винно-красный |
синий |
оранжевый |
При рН = 9,5-10,0 комплекс Mg2+ и Са2+ (Ме2+) с индикатором имеет винно-красную окраску:
Ме2+ + HV2- |
→ MeV- + H+ |
синий |
винно-красный |
При титровании трилоном Б в точке эквивалентности наблюдается полный переход металла из непрочного комплекса с индикатором в более прочный комплекс с трилоном Б, и винно-
красная окраска меняется на синюю: |
|
|
|
|||||
MeV |
- |
+ |
Na2H2I |
ОН |
|
Na2MeI + |
2- |
+ |
|
|
HV |
+ H |
|||||
винно-красн. |
б/цветн. |
|
|
б/цветн. |
синяя |
|||
или:
В коническую колбу с помощью цилиндра отмерьте 20 мл воды. Добавьте 5 мл буферного раствора мерной пробиркой и несколько кристалликов индикатора. Исследуемый раствор приобретает винно-красную окраску. титруйте из бюретки трилоном до перехода винно-красной окраски в синюю. Показания бюретки отметьте с точностью до 0,1 мл. Титрование повторите до получения трех результатов, отличающихся не более чем на 0,1±0,2 мл. Результаты титрования занесите в табл.
16.
Исследуемый раствор: вода
По V тр. рассчитайте содержание ионов Mg2+, Са2+ в ммоль экв/л, т.е. жесткость воды, сделайте вывод.
55

Таблица 16
|
мл |
|
№ опыта |
иссл.р-ра, |
Vтр., мл |
|
V |
|
120,0
220,0
320,0
|
|
i |
|
|
V |
|
V |
,мл |
|
n |
||||
|
|
|||
|
(V V ) |
|
|
V |
i |
, |
|
n |
|||
|
|
||
МЛ |
|
|
Относит. ошибка
V |
100% |
|
V |
||
|
Жесткость воды, ммоль экв/л
КОНТРОЛЬНЫЕ ВОПРОСЫ:
1.Почему определение ионов Mg2+, Са2+ необходимо проводить в щелочной среде?
2.Как рассчитывается эквивалент определяемого элемента в методе трилонометрии?
3.Возможны ли другие аспекты применения комплексонов в биологии и в медицине, кроме аналитических целей?
4.Какие вам известны методы уменьшения жесткости воды?
ЛИТЕРАТУРА:
1. С. 250-252; 2. С. 226; 4. С. 151-155; 6. С. 263-265.
56
РАБОТА 14. МЕТОД КОМПЛЕКСОНОМЕТРИИ. ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ КАЛЬЦИЯ
В ПЛАЗМЕ КРОВИ (для лечебно-профилактического и
педиатрического факультетов)
Химический состав крови довольно стабилен, несмотря на то, что в кровь постоянно поступают и выводятся различные по составу и действию вещества. Любые сдвиги состава крови характеризуют определенные патологические изменения в организме. Вот почему исследования крови представляют особую важность для клиники и помогают врачу правильно поставить диагноз.
Биологическая функция кальция заключается в регулировании ферментных систем и, в частности, процессов свертывания крови. Содержание ионов кальция в крови 9,8 мг % или 98 мг/л.
ЦЕЛЬ ЗАНЯТИЯ:
1.Ознакомиться с возможностями метода трилонометрии.
2.Научиться записывать реакции образования внутрикомплексных соединений.
3.Ознакомиться с условиями проведения анализа, выбором индикатора.
4.Освоить методику титрования.
5.Овладеть методикой трилонометрического определения содержания ионов кальция в плазме крови.
6.Научиться на основании результатов титрования рассчитывать содержание ионов кальция (Са2+) в плазме.
ЗАДАНИЕ:
Выполните трилонометрическое определение и рассчитайте содержание ионов кальция в плазме крови в мг % и в мг/л. Представьте отчет по работе.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ К ВЫПОЛНЕНИЮ РАБОТЫ:
Рабочий раствор: трилон Б, Сэ = 0,01 моль экв/л. Исследуемый раствор: плазма крови.
Вспомогательный раствор: аммиачно-буферный (рН = 9,5-10). Индикатор: хромоген черный.
57
Способ титрования: прямой.
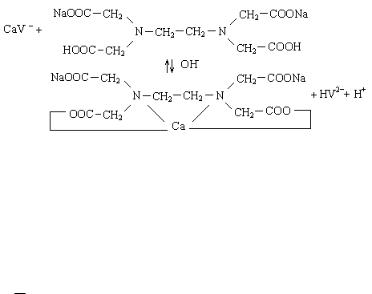
Для установления точки эквивалентности используется индикатор хромоген черный, который в зависимости от рН раствора ионизирует по-разному:
H3V |
↔ H2V- + H+ |
↔ HV2- + 2H+ |
↔ V3- + 3H+ |
рН<6 |
pH=6 |
pH=7-11 |
pH=11,5 |
|
винно-красный |
синий |
оранжевый |
При рН = 9,5-10 комплекс Са2+ с индикатором имеет виннокрасную окраску:
Са2+ + HV2- |
→ СаV- + H+ |
синий |
винно-красный |
При титровании трилоном Б в точке эквивалентности наблюдается полный переход металла из непрочного комплекса
с индикатором |
в более |
прочный |
комплекс |
с |
трилоном |
Б |
|||
(бесцветным), и винно-красная окраска меняется на синюю: |
|
||||||||
- |
+ |
Na2H2I |
ОН |
|
Na2СаI |
+ |
2- |
+ H |
+ |
СаV |
|
HV |
|
||||||
винно-красн. |
б/цветн. |
|
|
б/цветн. |
|
синяя |
|
||
или:
В коническую колбу с помощью пипетки отмерьте 10 мл плазмы крови. Добавьте 5 мл буферного раствора мерной пробиркой и несколько кристалликов индикатора. Исследуемый раствор приобретает винно-красную окраску. Титруйте из бюретки трилоном Б до перехода винно-красного окрашивания в синее. Показания бюретки отметьте с точностью до 0,1 мл. Титрование повторите до получения трех результатов, отличающихся не более чем на 0,1±0,2 мл. Результаты титрования занесите в табл.
17.
По V тр. рассчитайте содержание ионов Са2+ в плазме, в мг % и мг/л, сравните с нормой, сделайте вывод.
58
Таблица 17
|
мл |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
опыта№ |
ра-р.иссл, |
мл,V.тр |
|
|
|
|
|
|
|
|
|
|
Относит. |
||||||
|
V |
|
|
|
|
(V Vi ) |
|
|
ошибка |
||||||||||
|
|
|
|
|
V |
, |
|
||||||||||||
|
|
|
V |
i |
,мл |
|
n |
|
|
|
|
|
|
|
|||||
|
|
|
n |
|
|
|
|
|
|
V |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
МЛ |
|
|
|
|
|
100% |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V |
|||||
|
V |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
110,0
210,0
310,0
КОНТРОЛЬНЫЕ ВОПРОСЫ:
Содержание Са2+, мг/л
1.Почему определение ионов Са2+ необходимо проводить в щелочной среде?
2.Возможно ли применение метода трилонометрии для анализа магния, железа, других биогенных элементов в живых организмах?
3.Как рассчитывается эквивалент определяемого элемента в методе трилонометрии?
4.Рассчитайте содержание ионов Са2+ в исследуемой плазме в моль ион/л по результатам титрования.
5.Возможны ли другие аспекты применения комплексонов в биологии и в медицине, кроме аналитических целей?
ЛИТЕРАТУРА:
1. С. 250-252; 2. С. 226; 4. С. 151-155; 6. С. 263-265.
59
РАБОТА 15. МЕТОД КОМПЛЕКСОНОМЕТРИИ. ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ КАЛЬЦИЯ
В СЛЮНЕ (для стоматологического факультета)
Метод трилонометрии находит широкое применение в стоматологической практике. Стоматологи используют его для определения содержания кальция в биоптатах зубной эмали. По соотношению кальция и фосфора в биоптатах судят о резистентности эмали (устойчивости против кариозного разрушения) и ряде других заболеваний.
Слюна может обладать деминерализующей активностью. Состав ее может нарушить равновесие процессов де- и минерализации эмали и быть одним из пусковых механизмов возникновения кариеса зубов.
В норме содержание ионов Са2+ в слюне колеблется в пределах 5,2-9,7 мг/100 мл. При кариесе отклонений нет. При беременности и после родов наблюдается снижение содержания кальция в слюне.
ЦЕЛЬ ЗАНЯТИЯ:
1.Ознакомиться с возможностями метода трилонометрии.
2.Научиться записывать реакции образования внутрикомплексных соединений.
3.Ознакомиться с условиями проведения анализа, выбором индикатора.
4.Освоить методику титрования.
5.Овладеть методикой трилонометрического определения содержания ионов кальция в слюне.
6.Научиться на основании результатов титрования рассчитывать содержание ионов кальция (Са2+) в слюне.
ЗАДАНИЕ:
Выполните трилонометрическое определение и рассчитайте содержание ионов кальция в слюне в мг/100мл. Представьте отчет по работе.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ К ВЫПОЛНЕНИЮ РАБОТЫ:
Рабочий раствор: трилон Б, Сэ = 0,01 моль экв/л. Исследуемый раствор: слюна.
60

Вспомогательный раствор: аммиачно-буферный (рН = 9,5-10). Индикатор: хромоген черный.
Способ титрования: прямой.
Для установления точки эквивалентности используется индикатор хромоген черный, который в зависимости от рН раствора ионизирует по-разному:
H3V |
↔ H2V- + H+ |
↔ HV2- + 2H+ |
↔ V3- + 3H+ |
рН<6 |
pH=6 |
pH=7-11 |
pH=11,5 |
|
винно-красный |
синий |
оранжевый |
При рН = 9,5-10 комплекс Са2+ с индикатором имеет виннокрасную окраску:
Са2+ + HV2- |
→ СаV- + H+ |
синий |
винно-красный |
При титровании трилоном Б в точке эквивалентности наблюдается полный переход металла из непрочного комплекса
с индикатором |
в более |
прочный |
комплекс |
с |
трилоном |
Б |
|||
(бесцветным), и винно-красная окраска меняется на синюю: |
|
||||||||
- |
+ |
Na2H2I |
ОН |
|
Na2СаI |
+ |
2- |
+ H |
+ |
СаV |
|
HV |
|
||||||
винно-красн. |
б/цветн. |
|
|
б/цветн. |
|
синяя |
|
||
или:
В коническую колбу с помощью пипетки отмерьте 10 мл слюны. Добавьте 5 мл буферного раствора мерной пробиркой и несколько кристалликов индикатора. Исследуемый раствор приобретает винно-красную окраску. Титруйте из бюретки трилоном Б до перехода винно-красной окраски в синюю. Показания бюретки отметьте с точностью до 0,1 мл. Титрование повторите до получения трех результатов, отличающихся не более чем на 0,1±0,2 мл. Результаты титрования занесите в табл.
18.
61

Таблица 18
|
мл |
|
№ опыта |
иссл.р-ра, |
Vтр., мл |
|
V |
|
110,0
210,0
310,0
|
|
i |
|
|
V |
|
V |
,мл |
|
n |
||||
|
|
|||
|
(V V ) |
|
|
V |
i |
, |
|
n |
|||
|
|
||
МЛ |
|
|
Относит. ошибка
V |
100% |
|
V |
||
|
Содержание Са2+, мг/100мл
По |
V тр. рассчитайте содержание ионов Са2+ в слюне, в |
мг/100 мл, сравните с нормой, сделайте вывод.
КОНТРОЛЬНЫЕ ВОПРОСЫ:
1.Почему определение ионов Са2+ необходимо проводить в щелочной среде?
2.Как рассчитывается эквивалент определяемого элемента в методе трилонометрии?
3.Рассчитайте содержание ионов Са2+ в слюне в г/л по результатам титрования.
4.Возможно ли применение данного метода для анализа магния, железа, других биогенных элементов в биологических жидкостях?
5.Возможны ли другие аспекты применения комплексонов в биологии и в медицине, кроме аналитических целей?
ЛИТЕРАТУРА:
1. С. 250-252; 2. С. 226; 4. С. 151-155; 6. С. 263-265.
62
