
УП- Биоорганическая химия
.pdfЧАСТЬ 3. УГЛЕВОДЫ
Углеводы (carbohydrates, англ.), или сахариды (от греч. sákkharon – сахар),
составляют бóльшую часть органического вещества на Земле. Достаточно сказать, что они составляют более 80% сухого веса растений. По своему элементному составу углеводы проще, чем аминокислоты и нуклеиновые кислоты: в них входят три элемента – углерод,
водород и кислород. Общая формула простых углеводов Сn(Н2О)n, где n≥3. Все многообразие углеводов разделяют на моносахариды, представляющие мономерные углеводные единицы, олигосахариды, состоящие из небольшого количества мономерных единиц, и полисахариды, в которых количество мономерных единиц может достигать нескольких миллионов. Основным источником углеводов являются растения, в которых они образуются из углекислого газа и воды в результате фотосинтеза. Ежегодно на нашей планете растениями и животными синтезируется около 100 миллиардов тонн углеводов в виде целлюлозы и других продуктов.
До 1960-х годов углеводы рассматривали как пассивный источник энергии
(например, глюкоза и крахмал) или структурный элемент (например, целлюлоза). И
действительно, углеводы не катализируют какие-либо процессы как ферменты или не реплицируют сами себя как нуклеиновые кислоты. Отсутствие жесткой детерминированности отражается в гораздо большей гетерогенности углеводов как по составу, так и по размеру, в отличие от других биомолекул. Однако исследования последних десятилетий показали, что присущая углеводам гетерогенность лежит в основе их биологической активности. Разнообразие углеводных фрагментов, расположенных на белках и поверхности клеток, обеспечивает множество событий узнавания между ними.
Некоторые углеводы и их производные играют ключевую роль в функционировании иммунной системы, оплодотворении, свертываемости крови и других важнейших систем.
Знание структуры и химических свойств углеводов – от моносахаридов до огромных разветвленных полисахаридов и их производных, составляет основу для понимания их биологической роли.
3.1. Моносахариды
Моносахариды – это молекулы, в состав которых входят одна или несколько гидроксильных групп и карбонильная группа, т.е. это полигидроксикарбонильные соединения. В названиях моно и дисахаридов часто присутствует окончание -оза. Если карбонил представлен альдегидной группой, то углевод называется альдозой, если
111

кетонной группой, то кетозой (Рис. 3.1). В зависимости от количества углеродных атомов
(3, 4, 5 и т.д.), входящих в молекулу, они называются треоза, тетроза, пентоза и т.д.
Максимальные моносахариды, которые мы будем рассматривать в рамках данного курса,
имеют 6 атомов углерода, т.е. являются гексозами.
Самым маленьким углеводом альдозой, является глицериновый альдегид – альдотриоза (Рис. 3.1). Атом углерода С-2 в этой молекуле является хиральным центром
Рис. 3.1. Структура моносахаридов. Каждый из углеродных атомов типа Н-С-ОН в моносахаридах является хиральным центром, как это показано на альдозе треозе – глицериновом альдегиде. Кетоза треоза – дигидроксиацетон, не имеет хиральных центров, они у кетоз появляются, начиная с тетроз (см. Рис. 3.3).
(нетрудно видеть, что все четыре заместителя у этого углерода разные) и, стало быть,
молекула глицеринового альдегида существует в виде 2-х стереоизомеров. Как мы уже обсуждали это при изучении аминокислот (См. Часть 1.1.3), для обозначения абсолютной конфигурации таких изомеров используют предложенную Фишером систему L- и D-
изомеров. При изображении молекул в плоскости рисунка связи, изображенные по вертикали – над и под хиральным центром, в пространстве обращены от зрителя и
«уходят» за плоскость страницы, а атомы, расположенные по горизонтали – обращены к зрителю и находятся над плоскостью страницы. Изомеру, у которого гидроксильная
112
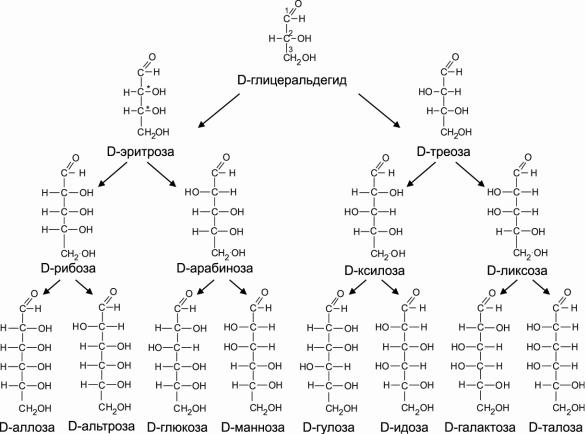
группа находится слева от хирального центра, присвоили L-конфигурацию, а с противоположным расположением – D-конфигурацию. Большинство природных углеводов обладают D-конфигурацией и потому префикс D обычно опускают. На Рис. 3.2
приведены структуры и названия альдоз, включающих от 3 до 6 углеродных атомов.
Обратите внимание – при нумерации атому карбонильного углерода всегда присваивается номер 1. Такое же семейство альдоз можно изобразить и для L-глицеринового альдегида.
Общее количество возможных углеводных стереоизомеров равняется 2n, где n – это количество хиральных атомов углерода в молекуле. На Рис. 3.3 приведены структурные формулы и названия D-кетоз с длиной от 3 до 6 атомов углерода. Принадлежность к D-
или L-конфигурации определяют по расположению гидроксила, максимально удаленного от карбонильной группы.
Рис. 3.2. Структурные формулы альдоз D-ряда.
113

Углеводы, отличающиеся по конфигурации только по одному атому углерода,
называются эпимерами. Так, из показанных на Рис. 3.2 моносахаридов глюкоза и манноза являются эпимерами по С-2 атому, а глюкоза и галактоза – эпимеры по С-4 атому.
Для обозначения наиболее часто встречающихся моносахаридов и их производных используют трехбуквенные обозначения. В Таблице 3.1 приведены такие названия некоторых моносахаридов, которые мы будем рассматривать в этой главе.
Рис. 3.3. Структурные формулы кетоз D-ряда.
Таблица 3.1. Трехбуквенные обозначения некоторых моносахаридов.
Название |
|
Обозначение |
|
|
|
Арабиноза |
|
Ara |
Галактоза |
|
Gal |
Глюкоза |
|
Glc |
Ксилоза |
|
Xyl |
Манноза |
|
Man |
Рибоза |
|
Rib |
|
|
|
|
114 |
|

|
Фруктоза |
|
Fru |
|
|
Фукоза |
|
Fuc |
|
|
Галактозамин |
|
GalN |
|
|
Глюкозамин |
|
GlcN |
|
|
Глюкуроновая кислота |
|
GlcA |
|
|
N-ацетилгалактозамин |
|
GalNAc |
|
|
N-ацетилглюкозамин |
|
GlcNAc |
|
|
|
|
|
|
Обратите внимание, что пентоза рибоза |
уже встречалась нам как структурный |
|||
элемент нуклеотидов. Однако там она имеет циклическое строение с атомом кислорода в
цикле. Рассмотрим этот структурный вопрос подробнее.
Известно, что при взаимодействии карбонильных соединений со спиртами
образуются соединения под названием «полуацетали» или «полукетали» (см. Рис. 3.4). В
случае углеводных молекул и карбонильная группа и спиртовая находятся в одной и той
же молекуле, и взаимодействие между ними приводит к образованию
внутримолекулярного полуацеталя или полукеталя.
Рис. 3.4. При взаимодействии карбонильных соединений (альдегидов или кетонов) со спиртами происходит образование полуацеталей (полукеталей) и далее ацеталей (кеталей). Когда обе функциональные группы – и карбонильная и гидроксильная, находятся в одной молекуле, возможно образование циклических полуацеталей по аналогичному механизму.
115

И, действительно, показано, что в растворе моносахариды, у которых в молекуле
число углеродных атомов ≥ 5, т.е. пентозы и гексозы, находятся в виде кольцевых
молекул, как это показано на Рис. 3.5 для глюкозы. В результате взаимодействия
альдегидной группы у С-1 атома и гидроксильной группы получается 6-членный
гетероцикл, названный пиранозой по аналогии с известным циклическим соединением
пираном (Рис. 3.5).
Рис. 3.5. Пятичленные циклические формы моносахаридов называют фуранозами, а шестичленные – пиранозами, по аналогии с соответствующими гетероциклическими соединениями фураном и пираном (на данном рисунке гидроксильные группы не приведены). Пример образования циклической формы для молекулы глюкозы показывает, что при этом появляется еще один хиральный центр – атом С1 и полученные при этом варианты пираноз называют греческими буквами α и β. Жирной чертой показана часть цикла, обращенная к читателю (над страницей).
Нетрудно видеть, что в полученной пиранозе появился еще один хиральный центр –
атом С-1. Образовавшаяся гидроксильная группа при С-1 может располагаться двумя
разными способами – над и под плоскостью пиранозного кольца. Вариант, когда ОН
группа находится под кольцом, называют α-глюкопиранозой, а когда под кольцом, то – β-
глюкопиранозой. Такие α- и β-изомеры называются аномерами. В растворе аномеры
легко переходят один в другой (этот процесс называется мутаротацией от лат. muto-
изменяю и rotatio – вращение), и в результате образуется равновесная смесь, в которой α- 116

и β-аномеры глюкозы составляют около 33% и 63%, соответственно. Помимо пиранозной
формы глюкоза образует пятичленные – фуранозные циклические формы. Линейная, а
также фуранозная форма глюкозы (Рис. 3.6) составляют в равновесной смеси менее 1%.
Вопрос: как можно следить за процессом мутаротации?
Образование циклической формы имеет место и в случае кетоз. Во фруктозе
гидроксильная крупа при С-5 атоме взаимодействует с кетонной группой при С-2 и при
этом образуется пятичленный гетероцикл (см. Рис. 3.5, 3.7). По аналогии с известным
Рис. 3.6. В растворе глюкоза существует в нескольких формах. Показано содержание каждого изомера при установившемся равновесии в растворе.
Рис. 3.7. Образование циклической формы рибозы и фруктозы. Формально эту реакцию можно рассматривать как присоединение ОН группы к двойной связи С=О.
117

соединением – фураном, такие пятичленные циклы называют фуранозами. Фуранозы, как и пиранозы, существуют в виде α- и β- аномеров.
Углеводные компоненты нуклеозидов представляют собой β-аномеры рибозы и дезоксирибозы.
Для изображения циклических форм моносахаридов используют проекционные формы Хеуорса, как на Рис. 3.5. При этом связи, обращенные к зрителю, изображают жирными линиями. Как и многие другие циклические соединения, пиранозы не являются плоскими молекулами, а образуют в пространстве конформации кресла и редко ванны.
При этом заместители у атомов углерода могут быть либо аксиальными (ax), т.е.
расположенными параллельно вертикальной оси молекулы, либо экваториальными (aq),
т.е. расположенными перпендикулярно этой оси, как это показано на Рис. 3.8.
Рис. 3.8. Цикл глюкопиранозы, как и других пираноз, образует конформации кресла (на рисунке) или ванны. Штрихом показана ось, относительно которой определяют расположение гидроксильных групп (аксиальное или экваториальное).
3.2. Химические свойства моносахаридов
Углеводы проявляют химические свойства функциональных групп, входящих в состав молекулы – гидроксильных и карбоксильных (Рис. 3.9), и участвуют, например, в
реакциях этерификации спиртовых групп с получением простых и сложных эфиров,
восстановления с получением полиспиртов и окисления с получением карбоновых кислот.
При окислении карбонильной группы получают полиоксикислоты, к названию которых добавляют суффикс -оновые (например, глюконовая кислота). При окислении концевой гидроксильной группы получаемые оксикислоты называют, добавляя суффикс -уроновые
(например, глюкуроновая кислота).
Моносахариды альдозы проявляют слабые восстанавливающие свойства.
Вспомните реакцию «серебряного зеркала» – восстановление ионов серебра Ag1+ до свободного серебра Ag0, которая происходит при взаимодействии азотнокислого серебра
118

(AgNO3) с альдегидами. Имеющееся равновесие между линейной (альдегид свободен) и
циклической формами моносахаров обеспечивает такую реакцию: при окислении
Рис. 3.9. Химические свойства моносахаридов.
119

линейной формы молекулы часть циклической переходит в линейную, компенсируя ее
«недостачу» (принцип Ле-Шателье).
Гидроксильная группа при атоме С1 обладает повышенной реакционной способностью по сравнению с остальными гидроксильными группами в молекуле. При взаимодействии с электронно-донорными соединениями (спиртами, аминами, тиолами) они первыми вступают в реакцию конденсации с образованием молекулы воды и аддуктов (продуктов присоединения) с общим названием гликозиды (напр., О-, N-гликозиды). Присоединение спиртов к аномерному атому С1 по существу представляет собой реакцию полуацеталя со спиртами с получением ацеталя, как это показано на Рис. 3.4. Получаемаяпри этом связь называется гликозидной. При взаимодействии двух молекул моносахарида образуется молекула дисахарида, в которой мономеры объединены О-гликозидной связью. Рис. 3.10
дает примеры дисахаридных молекул, образующихся из двух молекул глюкозы, т.е.
гомодисахаридов. Образование дисахарида может происходить по разным гидроксильным группам второго мономера. Принято изображать и читать полученные производные,
начиная с мономера, у которого в гликозидной связи участвует аномерный атом С1. В
случае, когда в дисахариде имеется доступный для окисления («свободный») аномерный атом углерода, он, как и мономер, проявляет слабые восстанавливающие свойства и такие сахара называют восстанавливающими.
Рис. 3.10. Гомодисахариды, образованные молекулами глюкозы
120
