
УП- Биоорганическая химия
.pdf
клетки. Несмотря на то, что бактерия синтезирует целевой белок правильной первичной последовательности, его пространственная структура и, соответственно, функция часто не соответствуют природному варианту.
Отметим, что в природе существует большая группа живых существ, способных жить в необычных (экстремальных) условиях среды, например: высокие/низкие температуры, чрезмерное давление, повышенная/пониженная кислотность. Их общее название – э . Оптимальные условия активности белков этих организмов
. Оптимальные условия активности белков этих организмов
Рис. 1.19. Слева. Температурная денатурация рибонуклеазы А и апомиоглобина. Справа. Денатурация рибонуклеазы в присутствии высоких концентраций сильно полярного соединения гуанидин хлорида (GuHCl). Среднюю точку интервала, в котором происходит денатурация, называют температурой плавления (t° пл.). Хорошо виден скачкообразный переход молекул белка в денатурированное состояние в узком диапазоне смены параметров среды.
сильно сдвинуты, например, белки бактерий-термофилов функционируют при высоких температурах термальных источников (около 100°С). Выделенный из бактерий Thermus aquaticus фермент ДНК-полимераза (Taq-полимераза) оказался незаменимым, он и его аналоги активно используются в качестве инструмента для молекулярно-генетических исследований. Позднее в рамках нашего курса (Часть 2) мы рассмотрим его применение для установления последовательности ДНК.
Следующий уровень организации белковой молекулы – четвертичная структура
белка – это структура, которую образуют несколько независимо сфолдингованных полипептидных цепей для обеспечения эффективного выполнения специфической функции белка. Полипептиды, входящие в состав такого белка, называют субъединицами.
41
Они могут быть одинаковыми – гомоили разными – гетеро-. Субъединицы в большой молекуле объединяются с помощью всех типов взаимодействий функциональных групп на их поверхности, кроме ковалентных.
1.3Связь пространственная структура–функция белка
Пространственная структура белков представляет собой различные комбинации известных нам вторичных структур – α-спиралей и β-листов и других, ориентированных относительно друг друга таким образом, что конечная форма позволяет молекуле выполнять ее биологическую функцию. В данном разделе мы проследим связь структура-
функция на примере нескольких хорошо изученных белков.
Все белки можно разделить на 2 группы со схожими пространственными структурами, свойствами и поведением в различных средах – фибриллярные и глобулярные белки. Отдельную группу составляют белки, иммобилизованные на клеточных мембранах – так называемые мембраносвязанные белки.
Фибриллярные белки имеют вытянутую форму, образуя длинные тяжи или фибриллы, потому они так и называются. Эти белки практически нерастворимы в воде и составляют основу всех соединительных тканей. Рассмотрим несколько примеров фибриллярных белков.
Хорошо изученным представителем таких белков является коллаген – важнейший белок, обеспечивающий прочность структур организма: соединительнотканного слоя кожи, сухожилий, хрящей, органического вещества костной ткани и роговицы глаза. (Рис. 1.20). Коллаген составляет 25-33% от всего белка организма взрослого человека (6% от массы тела). В его составе бóльшую часть аминокислот представляют глицин (почти 30%)
лизин и пролин. Первичную структуру коллагена можно представить чередованием триплетов Gly-Y-Z, где Y всегда пролин или лизин, Z может быть любой. В составе коллагена крайне мало цистеиновых и метиониновых остатков и никогда не бывает триптофана. Полипептидая цепь сильно вытянута и образует повторяющиеся повороты за счет пролиновых остатков – в целом образуя так называемую альфа-цепь (не путать с альфа-спиралями!). Три полипептидные цепи оплетают друг друга, и полученная при этом плотная тройная спираль образует коллагеновые фибриллы. Тройную спираль коллагена можно рассматривать как субъединичный белок, состоящий из трех одинаковых субъединиц, он называется тропоколлаген. Остатки глицина помещаются внутри этих фибрилл благодаря своей подвижности и маленькому размеру. Далее фибриллы пакуются в пучки, образуя крупные надмолекулярные комплексы. Остатки пролина и лизина в
42

коллагене часто гидроксилированы, т.е. к ним присоединены гидроксильные группы (Рис.
1.20), и это имеет важное значение для обеспечения прочности и особых свойств
коллагена. Гидроксилирование этих аминокислот происходит посттрансляционно (т.е.
после синтеза полипептида на рибосомах) с участием специальных ферментов –
пролилгидроксилазы |
или |
лизилгидроксилазы. |
Их |
общее |
название |
– |
пептидилгидроксилазы, указывает на то, что
Рис. 1.20. Коллаген – фибриллярный белок, выполняющий структурную функцию, богат глициновыми и пролиновыми остатками, благодаря которым молекула образует повторяющиеся повороты. В плотно упакованных коллагеновых фибриллах, образованных тремя коллагеновыми спиралями, глицины находятся в центральной части (показаны красными шариками). Показаны гидроксилированные остатки пролина и лизина. Между линейными полипептидными цепями пролина встречаются поперечные ковалентные «сшивки».
гидроксилирование, которое они катализируют, происходит тогда, когда эти
аминокислоты уже находятся в составе полипептида. Связывание цепей коллагена между
собой происходит за счет образования ковалентных связей между гидроксилизином,
лизином и пролином, образующими поперечные сшивки. Пример такой сшивки приведен
на рисунке 1.20 Необходимо отметить, что помимо поперечных сшивок коллагеновых
43
цепей гидроксилизин образует ковалентные связи с углеводами, находящимися в
окружении мышечных тканей (см. далее, Часть 3. Углеводы).
Было показано, что для обеспечения функционирования пептидилгидроксилаз необходима аскорбиновая кислота (витамин С) в качестве кофактора. Витамин С не синтезируется в организме человека (а также гориллы, морских свинок и фруктовых летучих мышей). Нарушения в работе гидроксисилаз приводят к образованию коллагена с несовершенной пространственной структурой и, как следствие, нарушению прочности всех соединительных тканей организма. Это ведет к ряду серьезных заболеваний, одним из них является цинга, описание которой встречается еще в мемуарах участников крестовых походов 13-го века. Но особенно острой проблемой цинга стала во времена великих географических открытий, приводя к гибели до 80% экипажей морских экспедиций, которые находились в многомесячных плаваниях без выхода на сушу. Несмотря на достаточный рацион средневековых мореплавателей, в нем не хватало свежей зелени, овощей и фруктов – основного источника витамина С. Цингой разной степени тяжести болеют люди и сейчас, она проявляется местными кровотечениями, расшатыванием и выпадением зубов, плохим заживлением ран, болями и слабостью костей, в повышенной раздражительности и подавленном настроении. Обеспечить организм достаточным количеством витамина С можно путем введения в рацион питания соответствующих продуктов и препаратов.
Кератин – основной белок соединительных тканей, волос, костей, когтей и
панцирей. Он богат гидрофобными аминокислотными остатками (A, V, L, I, M, F),
образующими протяженные α-спирали с утолщениями на N- и C-концах молекул. Пара
молекул кератина образует суперскрученную двунитевую левозакрученную спираль.
Боковые радикалы взаимодействуют друг с другом, образуя компактную упаковку.
Множество плотно упакованных двунитевых спиралей образуют скрученные
протофибриллы и фибриллы – большие надмолекулярные комплексы. Прочность этих
комплексов обеспечивается дополнительными ковалентными связями: в кератине это
множество дисульфидных мостиков, образующихся между цистеиновыми остатками
(например, в роговой ткани носорога цистеин составляет до 18%).
Изменяя структуру входящего в состав волос кератина действием температуры и химических реагентов, можно изменить их вид – сделать курчавыми или, наоборот, распрямить кудряшки. Влажные волосы при нагревании растягиваются: альфа-спирали кератина раскручиваются, пока не примут плоскую бета-конформацию. При охлаждении они возвращаются в прежнее состояние. Для долгосрочной завивки волос их туго накручивают на бигуди и при нагревании обрабатывают восстанавливающими реагентами для восстановления SH-групп цистеинов. Влажность и тепло разрушают альфа-спиральные структуры, и волосы на бигудях растягиваются. Затем
44

восстановители смывают и обрабатывают волосы окислителями. При этом между кератиновыми волокнами образуются новые цистеиновые сшивки, но уже другие, фиксирующие структуру вьющихся волос.
Еще один представитель фибриллярных белков – фиброин шелка. В отличие от коллагена и кератина, фиброин состоит из полипептидных цепей, образующих бета-
листы. Фиброин в основном состоит из аланина и глицина (бóльшая часть его первичной структуры образована пептидом Gly-Ser-Gly-Ala-Gly-Ala) и отличается чрезвычайно плотной упаковкой (у этих аминокислот нет громоздких боковых радикалов). Структура стабилизируется водородными связями, характерными для ß-листов, и Ван-дер-
Ваальсовыми взаимодействиями и, поскольку это сравнительно слабые взаимодействия,
проявляет гибкость. Фиброин составляет основу нитей паутины и коконов насекомых,
например, тутового шелкопряда.
Все перечисленные фибриллярные белки обладают высокой прочностью,
практически не растворяются в воде и выполняют структурную функцию.
Глобулярные белки растворимы в водных средах, в целом могут быть представлены в виде шара (глобулы) с гидрофобным ядром, изолированным от внешней водной среды, и гидрофильным внешним слоем, образованным аминокислотами с полярными либо заряженными боковыми радикалами, которые образуют водородные и электростатические связи с водным окружением. Глобулярные белки обладают самыми разнообразными пространственными структурами и выполняют комплекс функций, без которых немыслима жизнедеятельность организма – каталитическую, транспортную,
защитную, структурную и пр.
Часто структура белка содержит несколько специфических участков (сайтов),
каждый из которых выполняет собственную функцию, обеспечивая активность белка в целом. Рассмотрим несколько примеров.
На рисунке 1.21 представлена молекула Са2+-регулируемого фотопротеина обелина,
полученного из морского гидроида Obelia longissima. Это сравнительно небольшой одноцепочечный белок (мол. масса – 22,2 кДа). Его полипептидная цепь организована восемью α-спиралями, соединенными 4-я петлями, три из которых являются специфическими кальций-связывающими сайтами, т.е. присоединяют ионы кальция c
помощью ионных и донорно-акцепторных связей. Внутри белка в полости, образуемой рядом гидрофобных аминокислот (в частности, четырьмя триптофановыми остатками),
находится гидрофобная молекула субстрата этого белка – пероксицелентеразин. Помимо
гидрофобных эта молекула иммобилизована еще и сетью водородных связей (Рис. 1.21).
45
Когда к белку присоединяются ионы кальция, запускается реакция декарбоксилирования субстрата (отщепляется молекула СО2), и высвобождается энергия пероксидной связи в виде кванта голубого света. Таким образом, при раздражении гидроид Obelia longissima светится (биолюминесцирует). Передача нервного импульса
Рис. 1.21. Пространственная (3D) структура Са2+-регулируемого фотопротеина обелина (PDB ID: 1QV0) организована 8-ю α-спиралями (показаны в виде лент), соединенными петлями; внутри белковой глобулы изображена в виде стержневой структуры иммобилизованная молекула субстрата – пероксицелентеразина.
происходит с помощью потоков ионов кальция. Фотопротеин присоединяет ионы кальция,
и в результате развивается биолюминесцентный ответ. Подобное устройство биолюминесцентной системы встречается и в ряде других организмов, например, медуз
Aequoria и Mitrocoma. На рисунке 1.22 приведены аминокислотные последовательности трех этих фотопротеинов. Можно заметить, что белки содержат одинаковые или аналогичные аминокислотные остатки в сайте связывания субстрата, а также в кальций-
связывающих сайтах. Кстати говоря, другие кальций-связывающие белки, никак не связанные с биолюминесценцией, например, кальмодулин и тропонин С, присоединяют
Ca2+ c помощью петель аналогичного строения, их общее название EF-hand мотивы. Они представляют собой сочетание α-спираль-петля-α-спираль (helix-loop-helix), при этом
46

Рис. 1.22. Вверху: аминокислоты активного сайта обелина, образующие сеть водородных связей с субстратом – пероксицелентеразином (показаны красным цветом). Внизу: аминокислотные последовательности фотопротеинов из разных организмов. Подчеркнуты кальций-связывающие петли (I, II, III) и выделены синим аминокислоты, образующие связи с Ca2+. Гидрофобные аминокислоты активного центра показаны желтым, аминокислоты, образующие водородные связи с субстратом – зеленым. Большими латинскими буквами показаны участки, образующие α-спирали. По материалам [1].
47
петля обязательно содержит аминокислоты с отрицательно-заряженными боковыми радикалами – Asp, Glu, которые связывают Ca2+, а в ее середине обязательно находится глицин (говорят «высококонсервативный» глицин) для обеспечения подвижности мотива при комплексообразовании с Са2+ (см. Рис. 1.22).
 Гидроидный полип Obelia longissima
Гидроидный полип Obelia longissima
Свечение живых организмов называется биолюминесценцией, и в природе это явление наблюдается довольно часто как на суше (светляки, черви, грибы), так и в мировом океане (бактерии, кишечнополостные, ракообразные, рыбы). Считается, что биолюминесценция выполняет защитную функцию (отпугивает хищника), либо аттрактивную (приманивает жертву или сексуального партнера). В ряде случаев вопрос, для чего животные светятся, остается открытым.
Биолюминесцентная система медуз Aequoria и Clytia и некоторых других состоит из
двух белков – фотопротеина и зеленого флуоресцентного белка (GFP). Этот небольшой
одноцепочечный белок (мол. масса около 26 кДа) сформирован в виде 8-ми β-слоев и
соединяющих их петель (Рис. 1.23). В целом молекула представляет собой β-бочонок (β-
barrel) – так называют подобные пространственные структуры. Подобные бочонки
образуют такие белки, как стрептавидин (субъединица), транспортные белки липокалины
и другие. На одной из петель последовательности GFP три соседние аминокислоты – S65,
Y66, G67, в результате самопроизвольного окисления образуют хромофорную группу
(этот процесс называют созреванием хромофора), которая находится внутри глобулы и
изолирована от внешней среды стенками бочонка. При облучении зрелого GFP синим
светом хромофорная группа поглощает энергию и переходит в возбужденное состояние.
При переходе в основное состояние избыток энергии освобождается в виде кванта света в
более длинноволновой области – наблюдается свечение белка в зеленой области. Этот
эффект называется флуоресценцией. Данный белок нашел широкое применение в молекулярной биологии, цитологии, биотехнологии и медицине как высокочувствительный световой репортер. К настоящему времени получено целое
семейство мутантных вариантов GFP, которые излучают свет почти во всем видимом
диапазоне спектра – от голубого до темнокрасного. За открытие этого белка, а также
определение его свойств и разработку методов его применения группе исследователей, в
48

Рис. 1.23. Пространственная структура зеленого флуоресцентного белка (GFP, PDB ID: 1GFL) организована β-листами в виде бочонка, внутри которого показан хромофор в виде стержневой структуры. Структура хромофора формируется в результате автоокисления трех аминокислот одного из линейных участков белка.
том числе профессору Осаме Шимомуре (Япония, США), была присуждена Нобелевская премия 2008 г.
В зависимости от состава все белки можно разделить на две группы – простые,
образованные только полипептидной цепью, и сложные, в составе которых помимо полипептида имеются так называемые простетические группы – витамины (биотин,
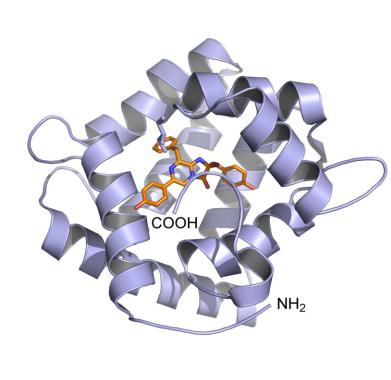
тиаминпирофосфат В1, FAD и пр.), гемы, ионы металлов и т.д., необходимые для выполнения специфических функций белка. Примером сложного белка является миоглобин (Рис. 1.24).
Название этого белка происходит от греч. myos – мышца и лат. globus – шар. Это небольшой глобулярный белок (17,8 кДа), 75% структуры которого составляют α-спирали.
Внутри глобулы в специальной полости (кармане) иммобилизована специфическая молекула – гем, представляющая собой порфириновое кольцо c ионом железа Fe2+ в
центре (Рис. 1.24). Ион железа связан с порфирином двумя ковалентными и двумя координационными связями. В этом комплексе Fe2+ удерживает еще одна координационная связь от гистидина полипептидной цепи белка с порядковым номером
93 (His93). Его другое обозначение – His F8, т.е. гистидин, находящийся в 8-м положении
α-спирали F миоглобина. Шестая координационная связь железа присоединяет молекулу
49

кислорода. Функция гема заключается в его способности связывать кислород обратимо.
Белок выполняет роль водорастворимого носителя гема, предохраняет Fe2+ от окисления
при его взаимодействии с О2 и регулирует величину сродства к О2. При понижении концентрации кислорода (например, при интенсивной работе мышц или кислородном
голодании) происходит его диссоциация от миоглобина для восполнения его содержания.
Таким образом, миоглобин является сложным глобулярным белком, выполняющим
функцию хранения и доставки кислорода в мышцах, в том числе и мышце сердца.
Рис. 1.24. Пространственная структура миоглобина (PDB ID: 3RGK) – сложного белка, в состав которого входит гем (показан в виде стержневой структуры в кармане белка. Справа приведена структурная формула гема, нагруженного молекулой кислорода. Ион Fe2+ образует шесть координационных связей, 4 из которых с молекулой порфирина, одну с His93 миоглобина и одну с кислородом.
Вбольших количествах миоглобин содержится в мышцах морских млекопитающих
–дельфинов и тюленей (3,5 и 7,7% от массы тела, соотетственно). Кашалот совершает длительные (от 40 минут до 1,5 часов) глубоководные погружения (до 2000 м) при охоте за гигантскими кальмарами. При этом снабжение кислородом мозга и сердца животного происходит за счет запасов О2 в мышцах, где миоглобина в 8-9 раз больше, чем у наземных животных. В мышцах кит запасает 41% кислорода, в то время как в легких – всего 9%, и этот запас кислорода выделяется в кровь при длительном погружении.
Миоглобин кашалота был первым белком, для которого британским биохимиком Дж. Кендрю с сотрудниками в 1957-60 гг. была определена пространственная структура методом рентгеноструктурного анализа. За эти исследования в 1962 г. он был удостоен Нобелевской премии по химии (совместно с М.Ф. Перуцем).
50
