
Биоинженерия / Polioxialkanoaty_POA__biorazrushaemye_polimery_dlya_meditsiny
.pdf
Рис. 6.7. Хроматограмма образца ПОБ/ПОВ после дополнительной очистки;
соотношение С4:С5 = 84.91:15.09 мол. % (Sevastianov et al., 2003).
Таблица 6.5 Абсолютные (ВРП) и относительные (ОВРП) значения времени
рекальцификации плазмы для дополнительно очищенных образцов ПОА (Севастьянов с соавт., 2001)
Образец |
ВРП, с |
ОВРП |
||
|
|
|
|
|
Исходная плазма |
201 7 (n = 6) |
1.0 |
0.1 |
|
|
|
|
|
|
ПОБ |
136 1 (n = 4) |
0.68 |
0.05 |
|
|
|
|
|
|
ПОБ-со-ПОВ (15 мол. %) |
153 2 (n = 4) |
0.80 |
0.06 |
|
(однократная очистка) |
||||
|
|
|
||
|
|
|
|
|
ПОБ-со-ПОВ (15 мол. %) |
160 3 (n = 4) |
0.76 |
0.06 |
|
(двукратная очистка) |
||||
|
|
|
||
|
|
|
|
|
Таблица 6.6 Значения абсолютной (kинд)обр и относительной (Кинд) констант скоростей
активации системы комплемента, индуцированной поверхностью очищенных образцов ПОА (Севастьянов с соавт., 2001)
Образец |
(kинд)обр см–2с–1 |
(Кинд) |
|
|
(n = 3) |
(n = 3) |
|
|
|
|
|
Купрофан (контроль 1) |
(2.5 0.2) 10–6 |
1.00 0.08 |
|
|
|
|
|
ПЭ (контроль 2) |
(2.1 |
0.1) 10–6 |
0.84 0.09 |
|
|
|
|
ПОБ |
(2.3 |
0.2) 10–6 |
0.92 0.10 |
|
|
|
|
ПО-со-ПОВ (15 мол. %) |
(2.0 |
0.1) 10–6 |
0.80 0.07 |
(однократная очистка) |
|
|
|
ПОБ-со-ПОВ (15 мол. %) |
(1.10 |
0.08) 10–6 |
0.44 0.05 |
(двукратная очистка) |
|
|
|
220
Из сравнения данных таблиц 6.3–6.4 и с аналогичными данными таблиц 6.5–6.6 видно, что дополнительной очисткой удалось полностью устранить выявленный отрицательный, с точки зрения гемосовместимости, эффект активации ферментных систем крови для очищенных по ранее принятой схеме образцов как ПОБ, так и ПОБ- со-ПОВ. Следует отметить, что дополнительная двукратная процедура перерастворения и очистки ПОБ-со-ПОВ не изменила значение ОВРП образцов (таблица 6.5), но существенно снизила индуцированную поверхностью сополимера активацию системы комплемента (таблица 6.6).
Эти результаты показали, что фактoром, активирующим ферментные системы крови являются микропримеси длинноцепочечных жирных кислот – компонентов ЛПС клеточных стенок бактерий R.eutropha – продуцента исследуемых ПОА. Дополнительно очищенные образцы ПОБ и ПОБ-со-ПОВ, не содержащие данных примесей, в реакции активации системы комплемента показали себя лучше с точки зрения гемосовместимости по сравнению с взятыми в качестве контроля купрофаном и полиэтиленом.
Таким образом, специальные технология очистки позволяет получать образцы ПОА, свободные от длинноцепочечных гидроксикислот – компонентов клеточной стенки, 99.9 % чистоты, пригодные для контакта с кровью.
6.3. Результаты исследования биосовместимости ПОА in vivo
Результаты исследований медико-биологических свойств полиоксиалканоатов на экспериментальных животных, представленные в литературе, немногочисленны и посвящены главным образом выявлению токсичности материала. Развитие тканевой инженерии – нового направления трансплантологии и биоматериаловедения явилось сильным стимулом для медико-биологических исследований ПОА.
Полиоксибутират и его смеси с полиэтиленом изучены в качестве заменителя кожи в сравнении с полилактидами при имплантации лабораторным крысам на длительное время (Beumer et al., 1978). Отмечено наличие воспалительных реакций тканей в первый период, однако далее, на фоне формирующегося фиброза происходила деградация полимеров, и воспалительные реакции прекращались. Примерно через две недели после имплантации во всех исследованных полимерных матриксах наблюдали формирование пор и прорастание их новыми клетками. Отрицательного влияния ПОБ на структуру и морфологию тканей внутренних органов экспериментальных животных не обнаружено.
221
В работе (Harrison et al., 1994) изучены свойства и кинетика деградации ПОБ и его смесей с полиэтиленом при имплантации крысам на срок до 52 недель. Макро- и микроскопия тканей показала наличие неспецифического воспаления тканей в раннем периоде (первые две недели), при этом отмечено, что имплантанты были достаточно прочными и не влияли на пролиферативную активность клеток в окружающих тканях. При имплантации пленочных образцов композита «полиоксибу- тират-полиуретаны» под кожу лабораторным животным в области брюшины не обнаружено признаков перерождения тканей и образования опухолей. Через год толщина капсулы вокруг имплантатов составляла у разных животных от 60 до 250 мкм (Saad et al., 1997b).
Однако в одной из последних работ в ходе исследования ПОБ применительно к сердечно-сосудистой хирургии получены отрицательные результаты (Unverdorben et al., 2002). Стенты, изготовленные из ПОБ и имплантированные в подвздошную артерию кроликам, вызывали выраженную воспалительную реакцию, повышенную продукцию коллагена, а также сужение и повреждение стенок сосудов.
Профессором Гоголевски с сотрудниками (Gogolewski et al., 1993a, b) изучена реакция тканей на ПОБ и ПОБ-со-ПОВ in vivo в сравнении с полилактидами при имплантации внутрибрюшинно мышам. Вокруг полимерных имплантатов отмечена типичная реакция тканей с участием мононуклеарных макрофагов, фагоцитирующих ПОА, и формирование фиброзной капсулы. Однако воспалительная реакция тканей проявлялась в разной степени в зависимости от типа материала. При использовании полилактидов она исчезала к исходу первого месяца после операции, а у животных, которым были имплантированы ПОБ и ПОБ-со-ПОВ, воспалительные реакции сохранялись в течение трех месяцев. При этом наличие оксивалерата усиливало воспаление. На более поздних сроках (от 3 до 6 месяцев после имплантации) негативные проявления воздействия оксивалерата исчезали, и состояние тканей было одинаковым во всех группах животных. Негативных реакций вокруг полимерных имплантатов из ПОА в виде абсцессов и некрозов тканей не отмечено. Близкие результаты получены при имплантации сополимеров ПО-со-ПОВ с различным включением оксивалерата (7, 14 и 22 мол. %) внутримышечно овцам на срок до 90 недель (Сhaput et al., 1995 a,b). Неблагоприятных реакций в виде некрозов или абсцессов в месте имплантатов не обнаружено. В течение первой послеопрерационной недели зарегистрировано небольшое воспаление тканей вокруг имплантатов с участием нейтрофиллов, лейкоцитов, макрофагов и фибробластов и начало формирования фиброзной капсулы. Воспалительная реакция была более значительной на имплантаты, содержащие 14 и 22 мол. % оксивалерата. К трем месяцам после имплантации воспаление тканей значительно уменьшилось, сформированная плотная капсула была
222
представлена высоко организованными мышечными волокнами и хорошо васкулиризированной. На более поздних сроках, спустя полгода и далее после имплантации, в капсуле и близлежащих тканях отмечено много жировых клеток. На всех сроках исследования в зависимости от доли включения оксивалерата в ответе тканей, характере и длительности тех или иных реакций отмечены некоторые различия, усиливающиеся с ростом включения оксивалерата.
Однако в работах других авторов (Borkenhagen et al., 1998) негативного влияния оксивалерата in vivo не обнаружено. Были исследованы сополимеры ПОБ-cо-ПОВ с различными включениями оксивалерата в качестве нервопроводящих каналов на лабораторных животных в ходе четырехмесячного эксперимента. Зависимости процесса регенерации аксона от химического состава имплантата не выявлено. Отмеченные незначительные воспалительные реакции не влияли на регенерацию тканей, а наличие оксивалерата не усиливало постоперационного воспаления. В целом, результаты по регенерации нервопроводящих каналов, полученные при использовании сополимера ПОБ-со-ПОВ, не отличались от таковых при исследова-
нии ПОБ-имплантатов (Hazari et al.,1999).
Таким образом, однозначного ответа на вопрос о биологической инертности сополимерного материала по сравнению с полиоксибутиратом на сегодня нет. Нельзя не отметить, однако, что воспалительные и другие нежелательные реакции при испытаниях новых биоматериалов и конструкций могут быть обусловлены не только составом, формой изделия и местом имплантации, но в значительной мере химической чистотой материала. Например, в работе (Tang et al., 1999) в ходе исследования тканевой реакции крыс, которым был имплантирован полиоксибутират, было установлено, что выщелачиваемые в ходе деструкции полимера примеси, в том числе низкомолекулярные фракции полиоксибутирата, могут быть в значительной мере ответственными за развитие воспаление и, в частности, повышенное отложение коллагена.
6.3.1. Биологическое воздействие ПОА in vivo
Сравнительное исследование биологической совместимости полиоксиалканоатов двух типов, гомогенного ПОБ и сополимеров ПОБ- со-ПОВ, выполнено в серии острых и хроническом экспериментах на лабораторных животных с использованием образцов ПОА, синтезированных Ralstonia eutropha B 5786 (Севастьянов с соавт., 2001; Шишацкая с соавт., 2002а–г; к; Шишацкая, 2003; Volova et al., 2003).
Определение раздражающего действия водных вытяжек ПОБ и ПОБ-со-ПОВ с различным включением оксивалерата (4 и 18 мол. %), выполненное на белых мышах линии Balb/c в виде накожных аппликаций и при введение проб в коньюктивальную полость глаза кроликам, показало отсутствие раздражающего эффекта в обоих вариан-
223
тах. На месте кожных аппликаций у опытных животных не отмечено явлений гиперемии, отека, сухости, шелушения и других реакций по сравнению с контролем. При введении вытяжек ПОА в коньюктивальную полость животным раздражающее действие на слизистые отсутствовало. Аллергической реакции немедленного типа у животных при этом также не наблюдали (Севастьянов с соавт., 2001).
Сенсибилизирующее действие ПОА определяли по реакции дегрануляции тучных клеток лабораторных крыс (по 5 животных в каждой группе), вводя в наружную поверхность уха 0.02 мл исследуемых вытяжек. На третий день животным проводили 7 накожных аппликаций по 0.5 мл вытяжки на выстриженные участки кожи бока размером 1 1 см. Контрольным животным проводили аппликации модельной среды в том же режиме. Через сутки после последней аппликации проводили провокационную внутрикожную пробу 0,02 мл свежеприготовленной вытяжки в противоположный аппликациям бок каждого животного. Ответную реакцию наблюдали через 15 мин., 24 и 48 ч. По стандартной методике определяли образование комплекса антиген-антитело. Препараты микроскопировали под большим увеличением, считая тучные клетки (клетки-мишени), подвергшиеся дегрануляции, и нормальные.
Во всех экспериментальных группах животных, сенсибилизированных по вышеописанной методике, дегрануляция тучных клеток составила менее 10 % относительно контроля. Это позволяет сделать вывод об отсутствии сенсибилизирующего эффекта испытуемых образцов.
Далее авторами было исследовано общетоксическое действие ПОБ и ПОБ-со-ПОВ в виде вытяжек в остром опыте (7 суток) на белых мышах линии Balb/c (общее число животных 28). Животным однократно внутрибрюшинно вводили вытяжки ПОБ и ПОБ-со-ПОВ (включение оксивалерата 15 мол. %) и наблюдали в течение 7 суток. Положительному контролю вводили физиологический раствор, отрицательным контролем служили интактные животные. Оценивали общее состояние и поведение животных, массу тела и внутренних органов и макроскопию внутренних органов (см. таблицы 6.7–6.9).
Внешних проявлений интоксикации у животных после введения вытяжек в течение наблюдаемого периода не выявлено. Поведение мышей в опыте не отличалось от контрольных групп. Отклонений в массе тела, а также массе внутренних органов у экспериментальных животных относительно контроля не зафиксировано (таблица 6.7). Макроскопические исследования внутренних органов животных через 7 дней от начала эксперимента патологических изменений не выявили.
Анализ морфологического состава периферической крови мышей в контрольных и опытных группах показал, что колебания концентрации эритроцитов и лейкоцитов были в пределах физиологических величин (таблица 6.8). Достоверных сдвигов в лейкоцитарной формуле крови животных, получивших вытяжки полимеров, также не выявлено.
224
Таблица 6.7 Показатели общетоксического действия водных вытяжек ПОАв опыте на белых
мышах (М* ± m) (Севастьянов с соавт., 2001)
|
1 группа |
2 группа |
3 группа |
4 группа |
|
Показатель |
интактный |
положитель- |
|||
ПОБ |
ПОБ/ПОВ |
||||
|
контроль |
ный контроль |
|||
|
|
|
|||
Масса тела (г): |
|
|
|
|
|
исходная |
21.20 ± 0.14* |
22.24 ± 0.13 |
23.54 ± 0.20*** |
23.60 ± 0.19*** |
|
конец опыта |
24.10 ± 0.32 |
25.07 ± 0.45 |
26.33 ± 0.36 |
26.10 ± 0.39 |
|
Масса органов (г): |
|
|
|
|
|
печень |
1.19 ± 0.04 |
1.20 ± 0.03 |
1.24 ± 0.05 |
1.21 ± 0.04 |
|
селезенка |
0.15 ± 0.01 |
0.14 ± 0.01 |
0.15 ± 0.00 |
0.15 ± 0.01 |
|
почки |
0.33 ± 0.02 |
0.34 ± 0.01 |
0.34 ± 0.03 |
0.35 ± 0.02 |
|
легкие |
0.20 ± 0.02 |
0.20 ± 0.02 |
0.21 ± 0.02 |
0.21 ± 0.02 |
|
сердце |
0.15 ± 0.00 |
0.16 ± 0.01 |
0.14 ± 0.00 |
0.17 ± 0.01** |
*– достоверное отличие между 1 и 2 группами (0.99);
**– достоверное отличие между 3 и 4 группами;
***– достоверное отличие 3 и 4 групп от 2 группы.
Таблица 6.8 Морфология периферической крови мышей на 7 день после введения
вытяжек(М* ± m) (Севастьянов с соавт., 2001)
|
1 группа |
2 группа- |
3 группа |
4 группа |
|
Показатель |
(интактный |
(положитель- |
|||
ПОБ |
ПОБ-со-ПОВ |
||||
|
контроль) |
ный контроль) |
|||
|
|
|
|||
Эритроциты,109/мл |
8.05 ± 0.03 |
7.99 ± 0.04 |
8.00 ± 0.03 |
7.99 ± 0.04 |
|
Лейкоциты,109/мл: |
7.65 ± 0.06 |
7.57 ± 0.08 |
7.57 ± 0.06 |
7.67 ± 0.07 |
|
палочкоядерные, % |
2.50 ± 0.52 |
3.57 ± 0.48 |
4.00 ± 0.69** |
6.71 ± 0.58*** |
|
сегментоядерные, % |
48.00 ± 2.30 |
54.00 ± 2.14 |
46.71 ± 2.52 |
49.00 ± 2.28 |
|
лимфоциты, % |
40.50 ± 2.42 |
39.43 ± 1.95 |
41.43 ± 2.53 |
37.62 ± 2.34 |
|
моноциты, % |
9.00 ± 0.67 |
7.86 ± 0.80 |
7.86 ± 0.46 |
6.72 ± 0.71 |
|
|
|
|
|
|
** – достоверное отличие между 3 и 4 группами (0.99);
***-достоверное отличие 3 и 4 групп от 2 группы;
В конце эксперимента перед забоем животных определяли иммунотоксичность ПОА по фагоцитарной активности макрофагов перитонеальной жидкости испытуемых животных. Фагоцитарная активность макрофагов во всех экспериментальных группах была сопоставима с контролем. Результаты показали отсутствие иммунотоксического эффекта со стороны ПОБ и сополимеров ПОБ-со-ПОВ
Токсикологическое и биологическое действие ПОА (в виде моножильных шовных нитей) изучено в хроническом опыте длительностью 6 мес. на белых крысах линии Вистар (Шишацкая, 2003; Ши-
225

шацкая с соавт., 2003 а; г; Volova et al., 2003). Экспериментальные образцы шовных нитей, изготовленные Ю. П. Некрасовым по методике (Gordeev et al., 2001) из образцов ПОА, синтезированных в Институте биофизики СО РАН, имели следующие характеристики (таблица 6.10). Перед имплантацией нити автоклавировали.
Были взяты половозрелые самки с исходной массой 180–200 г, по 18 животных в каждой группе: I – отрицательный (интактный) контроль; II – положительный контроль (хирургический шелк), III – биодеградируемая нить сравнения (кетгут), IV – экспериментальная нить ПОБ-со-ПОВ (включение оксивалерата 15 мол. %), V – экспериментальная нить ПОБ. Животным под ингаляционным наркозом (диэтиловый эфир) в асептических условиях на наружной поверхности правого бедра делали линейный продольный разрез кожи и мышцы длиной 2 см. На мышцу накладывали три одиночных узловых шва из испытуемого материала (общая длина 3.0–3.5 см), кожную рану ушивали шелком (Шишацкая с соавт., 2002 а, б, г).
Таблица 6.9 Оптическая плотность раствора с лизированными перитониальными
макрофагами мышей в эксперименте (Dопыт) относительно контроля (Dконтр.) Севастьянов с соавт.., 2001)
Наименование образцов |
Dопыт/Dконтр |
|
|
ПОБ |
6.8 ± 1.1/7.1 ± 0.8 |
|
|
ПОБ-со-ПОВ |
|
(включение оксивалерата – 15 мол. %) |
6.9 ± 0.8/7.1 ± 0.7 |
|
|
Таблица 6.10 Характеристики экспериментальных образцов шовных нитей из ПОА ( М* ± м)
(Волова с соавт., 2003)
Показатель |
ПОБ |
ПОБ-со-/ПОВ |
||
|
|
|
||
Абсолютная разрывная нагрузка (Fр), Н |
7.10 ± 0.21 |
9.40 ± 0.19 |
||
|
|
|
||
Коэффициент вариации по нагрузке, % |
16.4 ± 1.82 |
3.00 ± 2.12 |
||
|
|
|
|
|
Прочность при разрыве, МПа |
205 |
± 31 |
274 |
± 27 |
|
|
|
|
|
Относительное разрывное удлинение, % |
27.80 |
± 1.02 |
37.70 |
± 1.74 |
|
|
|
||
Коэффициент вариации по удлинению, % |
12.1 ± 1.46 |
6.5 ± 0.81 |
||
|
|
|
||
Модуль упругости, ГПа |
3.75 |
3.13 |
||
|
|
|
|
|
*– среднее из 10 измерений |
|
|
|
|
226
Впериферической крови (забор из хвоста) с использованием общепринятых методов проводили развернутый анализ крови, определяли СОЭ, содержание гемоглобина и форменных элементов. В крови, забранной у наркотизированных животных из левого желудочка сердца, определяли биохимические показатели. С использованием серийных наборов реагентов для клинических исследований в сыворотке крови анализировали общее содержание и фракции белка, остаточный азот, мочевину, креатинин и активность ферментов: лактатдегидрогеназы (ЛДГ), кислой и щелочной фосфомоноэстераз (КФ, ЩФ), аланин- и аспартаттрансфераз (АЛТ и АСТ).
Исследование лимфоидной ткани («имплантационный тест») проводили патоморфологическим анализом отпечатков паховых лимфатических узлов животных (2 и 4 недели после имплантации); анализировали строение ЛУ и соотношение популяций иммунокомпетентных клеток. В середине (8 недель) и в конце эксперимента (24 недели) проводили макро- и микроскопические исследования внутренних органов (печени, почек, сердца, селезенки и легких). Оценивали общую гистоархитектонику внутренних органов (окраска гема- токсилин-эозином). Реакцию тканей на ПОА исследовали общепринятыми гистологическими методами; для этого спустя 1, 2, 4, 8, 16 и 24 недели после операции из бедренной мышцы животных иссекали фрагмент тканей с имплантатами. После фиксации в 10 % формалине материал заключали в парафин; из блоков готовили срезы толщиной 5–10 мкм. Анализировали общую реакцию ткани на имплантированные экспериментальные нити (окраска гематоксилинэозином) и процессов развития коллагеновых волокон (окраска пикрофуксином по Ван-Гизону) в сравнении с таковыми при имплантации шелковой нити и кетгута. С использованием Image Analysis System «Carl Zeiss Jena» проводили анализ изображений и морфометрические исследования срезов.
Втечение эксперимента все животные, которым были имплантированы нити из ПОБ и ПОБ-со-ПОВ, были здоровы и активны, равномерно прибавляли в весе. Достоверных изменений по сравнению с двумя контрольными группами обнаружено не было. Относительные массы внутренних органов у животных экспериментальных групп также не отличались от таковых в контроле. Макроскопические исследования внутренних органов у всех животных на всех сроках наблюдения отклонений не выявили (Шишацкая с соавт., 2002а; Шишацкая, 2003).
Анализ морфологического состава периферической крови в контрольных и опытных группах показал, что в основном эти показатели находились в пределах физиологической нормы и не отличались существенно у животных экспериментальных групп относительно контролей. Незначительное повышение количества лейкоцитов (от
10–11 до 12.5–13.0 109/л) и уровня СОЭ (до 3.0–3.5) отмечены на
227
седьмые сутки после оперативного вмешательства у всех оперированных животных относительно интактных. Лейкоцитоз на данном сроке у животных, раны которых были ушиты кетгутом, был достоверно (p = 0,05) выше относительно обеих экспериментальных групп и сохранялся на более поздних сроках (2 и 4 недели после операции). Достоверное повышение СОЭ отмечено только на первом наблюдаемом сроке и только у животных III и V групп относительно отрицательного контроля. Далее показатель был в границах физиологической нормы у всех животных. В лейкоцитарной формуле экспериментальных животных на всех сроках наблюдения достоверных систематических изменений не выявлено.
Биохимические исследования во всем комплексе показателей, не выявили между группами животных достоверных отклонений, выходящих за пределы физиологических величин (Шишацкая с соавт., 2002б). Анализ динамики содержания мочевины, креатинина и остаточного азота в сыворотке крови свидетельствуют об отсутствии негативного влияния имплантированных полимерных нитей на показатели азотного обмена и функцию почек животных. Содержание белка в сыворотке крови, а также его фракционный состав во всем массиве данных не выявили патологических изменений. Исключение составило достоверное падение величины «альбумины/глобулины» у всех оперированных животных (до 0.77 ± 0.02 – 0.81 ± 0.01) относительно интактных (0.89 ± 0.01 – 0.91 ± 0.02). Однако это изменение имело место только на первом сроке наблюдения (одна неделя после операции) и отражало наличие постоперационного воспаления; далее величина была сопоставима с контролем. Динамика активности АЛТ и АСТ как показателя дезинтоксикационной функции печени была в пределах физиологической нормы у всех животных в течение всего опыта
Выраженные изменения зарегистрированы у оперированных животных в показателях активности лактатдегидрогеназы в сыворотке крови. В течение первых двух недель у всех оперированных животных (2–5 группы) по сравнению с интактным контролем был повышен уровень лактатдегидрогеназы. В первую неделю после операции показатель у всех оперированных животных был выше более, чем в 3–4 раза по сравнению с интактной группой. Более выраженными изменения были у животных, раны которых были ушиты кетгутом. (рис. 6.8). На 14-е сутки после операции активность ЛДГ снизилась, а через 8 недель практически сравнялась с интактным контролем.
228
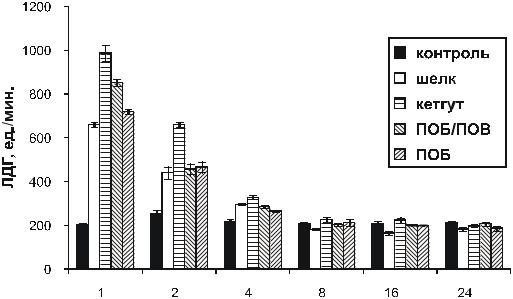
Рис. 6.8. Динамика активности лактатдегидрогеназы (ЛДГ)сыворотки крови крыс в хроническом эксперименте (Шишцкая с соавт., 2000 б).
Изменение активности ЛДГ отражает, как известно, биохимические изменения в тканях, имеющие место на стадии повреждения и связанные, наряду с высвобождением кислых липидов и их перекисным окислением, с активацией реакций гликолиза, которые сопровождаются накоплением в тканях молочной кислоты и ацидозом (Воспаление, 1981; Шехтер, Серов,1995).
Для определения степени влияния имплантированных полимерных нитей на органы иммунитета и выявления возможной сенсибилизации иммунокомпетентных систем животных исследована реакция лимфоидной ткани (Шишацкая с соавт., 2000б). Проанализированы макро- и микроскопические характеристики паховых правых (регионарных по месту имплантации) и левых (отдаленных) лимфоузлов (ЛУ). Во всех группах животных через 2 и 4 недели после начала эксперимента ЛУ имели плотно-эластическую консистенцию, бобовидную форму с гладкой поверхностью. Размеры ЛУ лежали в переделах 0.15 0.18 – 0.25 0.35 см. При микроскопии рисунок ЛУ сохранен; изменений средней площади лимфоидных узелков и в соотношении между корковым веществом и паракортикальной зоной не выявлено. Достоверных систематических изменений в соотношении клеточных популяций ЛУ (анализировали малые лимфоциты, бласты, плазматические, ретикулы, митозы) у экспериментальных групп относительно контролей не выявлено. В течение всего наблюдаемого периода доминирующей популяцией ЛУ были малые лимфоциты; соотношение зрелых клеток и делящихся также не изменилось. Это
229
