
Биоинженерия / Polioxialkanoaty_POA__biorazrushaemye_polimery_dlya_meditsiny
.pdf
Рис.6.17. Гигантские многоядерные клетки инородных тел с упорядоченным кольцевидным расположением ядер (ГКИТ) в тканях, окружающих ПОБ-нити:
2 (а) и 16 (б) недель после имплантации. Полутонкий срез. Толуидиновый синий. Маркер 0,01 мм. (Шишацкая, 2003)
Через 8 недель гистологическая картина в зоне имплантации ПОБ
иПОБ-со-ПОВ практически не изменилась, равно как и толщина капсул
иих клеточный состав. Капсулы пронизаны сосудами микроциркуляторного русла (рис. 6.18); в них преобладали коллагеновые волокна зрелого типа (рис. 6.16). В зоне, примыкающей к ПОБ и ПО-со-ПОВ, попрежнему регистрировалось большое количество активных макрофагов. Их количество было сопоставимо с показателями активности КФ в сыворотке крови животных (рис. 6.12). Увеличение активности КФ свидетельствует об усиление фагоцитарной реакции макрофагов, являющихся, как установлено недавно, одним из активных агентов биодеструкции ПОА (Williams and Martin, 2002). В структуре ФК, окружающих имплантаты из ПОБ и ПОБ-со-ПОВ, идентифицированы активные фибробластические элементы и формирующиеся коллагеновые волокна.
240

Рис. 6.18: а – полутонкий срез. Кровеносный сосуд (кс) во вновь образованной ткани вокруг ПОБ-нити (п) (4 недели после операции).
Маркер 0,01 мм.
б – формирующийся сосуд микроциркуляционного типа в фиброзной капсуле (8 недель после перации).
Обозначения: эк – эндотелиальные клетки. Маркер 5 мкм.
(Шишацкая, 2003).
Средняя толщина капсул (ТК) вокруг ПОБ и ПОБ-со-ПОВ составила на этом сроке, соответственно, 161.20 ± 5.93 и 158.08 ± 4.37 мкм; рядность фибробластов (РФ) – 9.50±0.57 и 10.57±0.67. Это было сопоставимо с ТК вокруг шелка на этом сроке (рис. 6.19б) (173.17±5.46 мкм), однако увеличения количества макрофагальных клеток вокруг шелка не отмечено. В тканях, окружающих кетгут, попрежнему отмечены лейкоцитарные клетки; толщина фиброзной капсулы составила 514.21±12.01 мкм (рис. 6.19А).
Спустя 16 недель после операции вокруг шовных нитей зафиксировано значительное истончение капсул (рис. 6.11), до 54.09 ± 3.28 и 43.71 ± 3.11 мкм вокруг ПОБ и ПОБ-со-ПОВ, соответственно, при снижении РФ в них до 4.64 ± 0.37 и 3.36 ± 0.37. Однако количество активных макрофагов в тканях, примыкающих к ПОА-имплантатам, по-прежнему высоко (табл. 6.10). Отмечены макрофаги непосредственно на полимерных нитях (рис. 6.16), появились ГКИТ с 10–12 ядрами (рис. 6.17). Среди фибробластических элементов преобладали зрелые клетки. В периферических частях капсул наблюдалось образование зрелой соединительной ткани в виде пучков коллагеновых волокон и прилегающих к ним цепочек фиброцитов. Здесь же определялись активные фагоцитирующие макрофаги и ГКИТ. Это позволяет предположить миграцию продуктов деструкции материала.
241
А |
Б |
В |
1
2
3
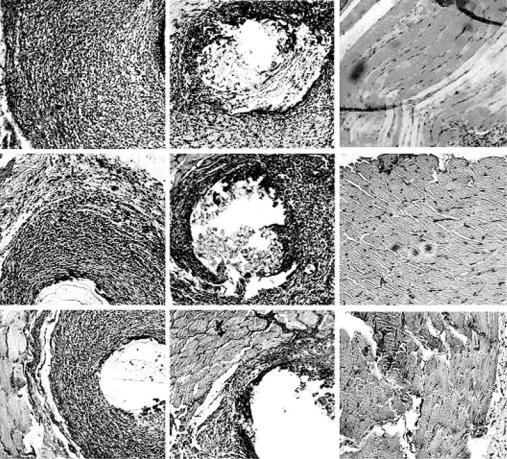
Рис. 6.19. Морфология тканей вокруг имплантатов из кетгута (А), шелка (Б) через 8, 16 и 24 недели после операции, соответственно, 1, 2 и 3 (обозначено слева).
Мышечная ткань у интактных животных на этих же сроках. Гематоксилин–эозин. Маркер – 0,01 мм
(из неопубликованных данных Шишацкой).
Через 24 недели после операции была отмечена дальнейшая инволюция фиброзных капсул вокруг имплантированных нитей из ПОБ и ПОБ-со-ПОВ (рис. 6.11); ТК уменьшились до 48.02 ± 5.25 и 33.73 ± 2.05 мкм, соответственно. В капсулах преобладали зрелые коллагеновые волокна, в них по-прежнему присутствовали активные фагоцитирующие макрофаги. Вокруг шелка значительного истончения фиброзных капсул не наблюдали; к концу эксперимента ТК составили 125–132 мкм. В месте имплантации кетгута, несмотря на активную деструкцию (к 4 мес. он не определялся в тканях), плотные капсулы сохранялись. Через 16 и 24 недели после имплантации ТК составили,
соответственно, 342,00 ± 9,68 и 272,14 ± 4,11 мкм (рис. 6.19). Пучки коллагеновых волокон в ФК вокруг кетгута были гораздо толще и занимали практически весь объем капсулы (рис. 6.20).
242

Рис. 6.20. Ультратонкий срез тканей вокруг кетгута: а и б – пучки коллагеновых волокон (кв) (8 и 16 недель после операции). Обозначения:
м – макрофаги, ф – фиброциты. Маркер – 1 мкм (Шишацкая, 2003)
Дальнейшее наблюдение за состоянием тканей у животных, которым были имплантированы нити из ПОБ и ПОБ-со-ПОВ, не выявило неблагоприятных явлений в прилегающих тканях. Спустя 36 недель ТК вокруг нитей из полиоксиалканоатов составляла 20–40 мкм. Имплантаты были окружены здоровыми тканями из вновь сформированных волокон, ориентированных вокруг нитей.
Через 48 недель толщина фиброзных капсул не превышала 5–10 мкм (рис. 6.21). В непосредственной близости с нитями – по-прежнему значительное количество моно- и полиядерных макрофагальных клеток.
Рис. 6.21. Морфология тканей вокруг ПОБ-со-ПОВ спустя 36 (а) и 48 (б) недель после имплантации. Гематоксилин – эозин. Маркер – 0,01 мм (Volova et al., 2003a).
243
Таким образом, установлено, что воспалительная и регенераторная реакции тканей животных на имплантаты из ПОА, на всем протяжении эксперимента, независимо от химического состава материала, была одинаковой. Присутствие оксивалерата в полимере не изменяло длительности и интенсивности воспаления, а также характера развития фиброзной капсулы вокруг нитей. В течение двенадцати месяцев наблюдения в месте имплантации ПОА обоих типов неблагоприятных проявлений в виде гнойного воспаления, некроза, кальцификации и малигнизации фиброзных капсул не отмечено.
В целом, выполненные комплексные исследования полиоксиалканаотов и изделий из них в условиях in vitro и in vivo свидетельствуют о высоких медико-биологических свойствах данного материала. Это позволяет рекомендовать данный класс биодеградируемых полимеров для создания био- и гемосовместимых изделий медицинского назначения, в том числе, и в качестве матриц в биоискусственных органах.
244
Глава 7. ОБЛАСТИ ПРИМЕНЕНИЯ ПОЛИОКСИАЛКАНОАТОВ
Полиоксиалканоаты, как уже было отмечено, по ряду физикохимических свойств сходны с синтетическими полимерами (полипропиленом, полиэтиленом). Помимо термопластичности, полиоксиалканоаты обладают оптической активностью, антиоксидантными свойствами, пьезоэлектрическим эффектом и, что самое главное, биоразрушаемостью и биосовместимостью. Полиоксиалканоаты чрезвычайно различаются между собой по структуре и свойствам (гибкости, кристалличности, температуре плавления и др.) в зависимости от таксономического положения и физиолого-биохимических свойств микроорганизмов-продуцентов, условий биосинтеза и типа углеродного субстрата. Более того, недавно продемонстрированные возможности получения на основе ПОА композитов с различными природными и синтетическими материалами, позволяющие направленно изменять их структуру, состав и, следовательно, базовые свойства материала – пластичность, механическую прочность, температурные и другие характеристики, еще более усиливают привлекательность ПОА и расширяют возможные сферы применения.
Линейная структура молекул ПОА придает им свойство термопластичности и изменения прочности (возрастание по направлению растяжения). При нагревании молекулярные цепи в ПОА легко сдвигаются относительно друг друга, в результате этого материал размягчается и приобретает текучесть. Данное технологическое свойство имеет большую коммерческую ценность, так как позволяет с использованием различных методов (прессования, экструзии и др.) получать из ПОА разнообразные изделия и материалы. Гомогенный полиоксибутират по механическим свойствам сходен с полипропиленом и полистерином, однако обладает лучшими газобарьерными свойствами (например, по отношению к кислороду) и большей устойчивостью к ультрафиолету, характеризуется также хорошей водостойкостью и теплоустойчивостью, при этом проницаемость для водяного пара через него втрое ниже по сравнению с полипропиленом.
Из ПОА возможно получение гибких пленок различной толщины, в том числе полупроницаемых мембран, нитей, нетканых материалов, различных полых форм (бутыли, контейнеры, коробки и пр.), а также гелей и клеев. Совокупность характерных свойств делает их перспективными для применения в различных сферах, – медицине, фармакологии, пищевой и косметической промышленности, сельском и коммунальном хозяйстве, радиоэлектронике и других сферах (Abe, Doi, 1992; Brandle et al., 1990; Luzier, 1992; Muller, Seebach, 1993 et al.) (рис. 7.1).
245

Рис. 7.1. Продукция из Биопола
(Asrar and Grauys, 2002).
Масштабы применения полиоксиалканоатов в настоящее время сдерживаются достаточно высокой стоимостью (практически на порядок более высокой, по сравнению с полиолефинами). Однако возрастающие требования к охране окружающей среды, с одной стороны, и имеющиеся перспективы снижения стоимости биополимеров за счет повышения эффективности производства, с другой, делают полиоксиалканоаты одним из перспективных материалов XXI века.
Уже сейчас сферы применения полиоксиалканоатов – самые различные. Данные материалы активно исследуются с целью переработки в США, Скандинавии и Европе, особенно в Германии и Голландии. Совет объединенной Европы утвердил концепцию необходимости замены не разрушаемых синтетических пластиков биодеградируемыми полимерами, а с 1993 г санкционировано применение упаковочной продукции из ПОА в пищевой промышленности.
7.1. Использование полиоксиалканоатов в медицине
Развитие науки приводит к все более широкому внедрению в медицине высокомолекулярных соединений, в том числе синтезируемых живыми системами, то есть биополимеров (Amass et al., 1998; Angelova, Hunkeler, 1999). Разнообразие полимеров, варьирование в широких пределах их стереоконфигурации и молекулярной массы, возможность получения композитов в разнообразных сочетаниях с различными веществами, – все это является основой для получения широчайшего спектра новых материалов с новыми ценными свойствами (Gregor, 1975; Kronenthal et al., 1975; «Полимеры медицинского назначения», 1981;
Платэ, Васильев, 1985; Williams, 1987; Alper, 1991; Адамян, 1994; Amass et al., 1998; «Биосовместимость», 1999; Nasseri et al., 2001).
246
Среди применяемых и активно разрабатываемых в настоящее время биоматериалов – алифатические полиэфиры, полиамиды, сегментированные полиэфируретаны, полимеры молочной и гликолевой кислот (полилактиды и полигликолактиды), силикон, полиэтилентерефталат (ПЭТФ) и с недавних пор – полимеры оксипроизводных жирных кислот (полиоксиалканоаты, ПОА) (Amass et al., 1998; More and Sauders, 1998; Биосовместимость, 1999; Sudesh et al., 2000).
Сферы применения полиоксиалканоатов в медицине потенциально широки и могут включать сердечно-сосудистую хирургию, ортопедию, урологию, стоматологию и др. (Amass et al., 1998; Madison, Huisman, 1999; Williams et al., 1999; Sudech, Doi, 2000; Stock et al., 200l; Asrar and Gruys, 2002). Особенно перcпективным считается применение ПОА в клеточной и тканевой трансплантологии для реконструктивной хирургии тканей и создания биоискусственных орга-
нов (Williams and Martin, 2002):
Сформировавшееся в последние годы мультидисциплинарное направление биоматериаловедения и трансплантологии – тканевая инженерия, остро нуждается в специализированных биосовместимых материалах. Тканевая инженерия ориентирована на создание конструкций, обеспечивающих восстановление, укрепление и улучшение функций тканей (Mooney and Vacanti, 1993; Williams et al., 1999; Heath, 2000; Humacher, 2000; Sodian et al., 2000; Nasseri et al., 2001). Мате-
риалы, применяемые в тканевой инженерии, должны обладать спектром специальных свойств. Прежде всего, продукты деградации материала не должны быть токсичными, конструкция должна сохранять свою форму и обладать достаточной прочностью до тех пор, пока новая ткань организма-хозяина в месте имплантации полностью не восстановится; материал, применяемый для изготовления конструкции, не должен быть иммунногенным, он должен поддерживать рост клеток и организацию их в ткань, в свою очередь, сам имплантат должен беспрепятственно отводить продукты обмена клеток.
Техника получения биоактивных имплантатов и биоискусственных органов включает: 1) изготовление биосовместимых и биоабсорбируемых конструкций (инкубаторов) для культивирования аутологических клеток пациента или клеток, взятых из банка, 2) выращивание клеток и формирование тканей in vitro и 3) последующую имплантацию полученных конструкций пациенту (рис. 7.2).
Применение таких биоконструкций, дополнительно нагруженных лекарственными препаратами (антибиотиками, гормонами, витаминами, белковыми факторами и др.), является революционным направлением в реконструктивной и прецизионной хирургии и в трансплантологии и имеет огромные перспективы.
247

Рис. 7.2. Применение ПОА в тканевой инженерии (Williams et al., 1999).
Ключевой проблемой для успеха создания таких биоконструкций является наличие адекватного биодеградирующего и биосовместимого материала. В настоящее время ПОА рассматриваются в качестве особо перспективного материала для изготовления матриц при конструировании тканевых протезов и биоискусственных органов. Наиболее многообещающим представляется использование этих полимеров для регенерации поврежденных кожных покровов, изготовления имплантатов кровеносных сосудов и клапанов сердца, закрытия дефектов мягких и костных тканей.
7.1.1. Сердечно-сосудистая хирургия
В настоящее время основное биомедицинское применение ПОА ориентировано на конструкции для сердечно-сосудистой хирургии. Одним из наиболее разработанных направлений является использование полиоксибутирата (ПОБ) в качестве нетканых лоскутов для закрытия дефекта перикарда в постоперационном периоде для предотвращения спаечного процесса (Bowald and Johansson, 1990; Malm et al., 1992a, b).
Группа сотрудников Медицинского университета и отделения торакальной и сердечно-сосудистой хирургии госпиталя г. Ланда в Швеции под руководством профессора Малма исследовала возможность снижения осложнений, имеющих место после операций на открытом сердце, за счет имплантирования полимерных лоскутов из ПОБ в качестве временного перикарда (Malm et al., 1992a, b). Животных (были взяты овцы) наблюдали в течение 2.5 лет относительно контроля (у животных после иссечения участка перикарда перикардиальная полость была оставлена открытой). В ходе опыта у экспериментальных животных развития спаечного процесса между сердцем и грудиной не отмечено (рис. 7.3). Показано, что в ответе тканей на имплантацию ПОБ принимали участие многоядерные макрофаги. По мере формирования новой ткани на фоне деструкции полимерного лоскута в многоядерных макрофагах было отмечено наличие включений частичек ПОБ. С применением СЭМ выявлено, что на перикардиальной поверхности регенерированной ткани со стороны сердца сформировался мезотелеподобный слой, который полностью покрывал подлежащий слой коллагена.
248

Рис. 7.3. Макроскопические снимки фрагментов тканей в месте имплантации: A – 12 месяцев после имплантации модельного перикарда из ПОВ, место регенерированных тканей отмечено стрелками; спаечный процесс отсутствует; B – развитие спаечного процесса через 12 месяцев после операции, перикард был оставлен открытым (Malm et al., 1992а).
Рис. 7.4. Электронные микрофотографии ткани перикарда после операции:
(A) – поверхностный слой регенерированной ткани из мезотелеобразующих клеток спустя 24 месяца после операции в месте имплантации лоскута из ПОБ; (В) – вид нормальной ткани нативного перикарда, (аналогичен А);
(C) – поверхность ткани перикарда в контрольной группе (слой мезотелия отсутствует)
(Malm et al., 1992а).
Морфология поверхности вновь сформированных тканей была сходной с нативным перикардом (рис.7.4).
В следующей работе авторов (Malm et al., 1994) биодеградируемые нетканые пленочные лоскуты из ПОБ были имплантированы в правый вентрикулярный тракт и легочную артерию овцам. В контрольной группе животным имплантированы лоскуты из дакрона. Животных наблюдали в течение 3–12 месяцев после операции. Регенерированный сосуд на основе ПОБ имел сходные структурные и биохимические показатели с нативными тканями.
Исследованы имплантаты – протезы легочной артерии и створок клапана легочной артерии, изготовленные из ПОА. Экспериментальным животным имплантировали полимерные трубочки, засеянные аутоклетками из сонной артерии, контрольным – полимерные трубочки без клеток. У контрольных животных произошла окклюзия имплантатов на разных постоперационных сроках. В опытных группах все имплантаты оставались функционирующими до конца наблюдения (рис. 7.5).
249
