
Материалы и методы
Измерение флуоресценции исследуемых растворов осуществляется с помощью спектрофлуориметра. Прибор снабжён монохроматорами для выделения отдельной длины волны как возбуждающего, так и испускаемого света. Флуоресценция попадает на фотоумножители и затем количественно измеряется с помощью соответствующих электронных устройств. Схема использованной установки представлена на рисунке 2.
1

Были приготовлены растворы триптофана (210-5 М), тирозина (10-4 М), БСА (10-5 М) в двух средах – растворе NaOH и фосфатном буфере. Условия регистрации флуоресценции растворов: диапазон съемки – 285-450 нм для возб = 275 нм, 305-450 нм для возб = 295 нм, шаг -1 нм, спектральная ширина щелей – 4 нм.
РЕЗУЛЬТАТЫ
Были сняты спектры флуоресценции триптофана (210-5 М), тирозина (10-4 М), белка (10-5 М) при двух длинах волн возбуждения – 275 и 295 нм и в двух средах – растворе NaOH и фосфатном буфере.
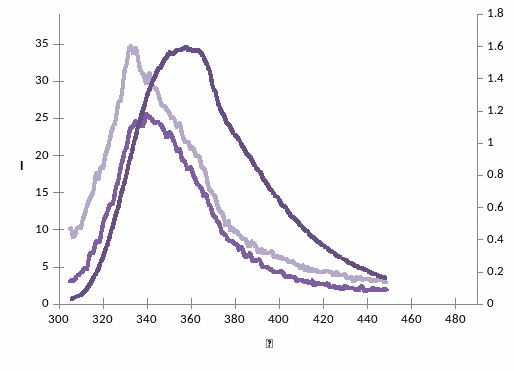
Рис. 2 – спектры флуоресценции растворов NAOH при длине волны возбуждения возб = 295 нм

Рис. 3 – спектры флуоресценции растворов, приготовленных в фосфатном буфере при длине волны возбуждения возб = 295 нм

Рис. 4 – спектры флуоресценции растворов NAOH при длине волны возбуждения возб = 275 нм

Рис. 5 – спектры флуоресценции растворов, приготовленных в фосфатном буфере при длине волны возбуждения возб = 275 нм
Таблица 1 — максимумы интенсивности флуоресценции триптофана (210-5 М), тирозина (10-4 М), белка (10-5 М) при двух длинах волн возбуждения – 275 и 295 нм и в двух средах – растворе NaOH и фосфатном буфере.
№ |
Образец |
Растворитель |
Спектр испускания |
||
возб, нм |
max, нм |
Imax, о.е |
|||
1 |
Триптофан |
NaOH |
275 |
354 |
0,912907 |
2 |
295 |
358 |
34,5374 |
||
3 |
Буфер |
275 |
351 |
1,86752 |
|
4 |
295 |
349 |
58,2136 |
||
5 |
Тирозин |
NaOH |
275 |
337 |
0,313376 |
6 |
295 |
340 |
1,17796 |
||
7 |
Буфер |
275 |
312 |
1,04004 |
|
8 |
295 |
332 |
1,06641 |
||
9 |
БСА |
NaOH |
275 |
314 |
0,234086 |
10 |
295 |
332 |
1,58962 |
||
11 |
Буфер |
275 |
341 |
0,635225 |
|
12 |
295 |
335 |
4,9806 |
||
ВЫВОДЫ
Спектры флуоресценции БСА и триптофана схожи между собой. Известно, что флуоресценция белка определяется в основном люминесценцией триптофана, поэтому формы спектров практически не отличаются.
Триптофан проявил pH зависимость. Возможно, это происходит ввиду повышения диссоциации фенольного кольца, ввиду чего произошло перераспределение зарядов на молекуле, что повлекло за собой уменьшение флуоресцентных свойств. В случае с БСА также наблюдается pH зависимость. Это может быть объяснено чувствительностью триптофана к pH т.к. именно флуоресценция триптофана оказывает основное влияние на флуоресцентные свойства белка.
Значение максимума интенсивности флуоресценции для раствора тирозина в буфере и гидроксиде натрия и раствора белка в гидроксиде натрия смещено в коротковолновую область. Это объясняется наличием дополнительного источника излучения, а именно комбинационным рассеянием света.
