
865267085
.pdfне происходит вследствие электростатического взаимодействия между ионами. В многокомпонентных системах наблюдается значительный разброс активности отдельных неорганических ионов из-за их взаимного влияния и разброс фактической осмолярности.
Существует несколько экспериментальных методов определения осмолярности водных растворов:
•По понижению температуры замерзания раствора по сравнению с чистым растворителем (криометрический метод);
•По различию между давлением пара над раствором и чистым растворителем (паровая осмометрия).
•По способности полупроницаемых мембран избирательно пропускать молекулы веществ (мембранная осмометрия). Применяется только для растворов высокомолекулярных веществ.
2.1. Криометрический метод
Экспериментальными методами определяют фактически не осмолярность, а осмоляльность, т. е. мольную концентрацию кинетически активных частиц на килограмм растворителя (мОсмоль/кг), по которой рассчитывают соответствующую осмолярность в зависимости от плотности испытуемого раствора по формуле (4.2).
С(мОсмоль/л) = С(мОсмоль/кг) · ρ |
(4.2) |
где С — осмолярность ИФР, мОсмоль/л; С — осмоляльность ИФР, мОсмоль/кг; ρ — плотность ИФР, кг/л.
Криометрический метод используется чаще остальных, но имеет такие недостатки, как значительное время подготовки прибора для измерения (3—4 часа) и высокая стоимость самого прибора.
Кроме того, экспериментальные методы, требующие стационарного приборного обеспечения, не могут использоваться в экстремальных условиях, когда требуется экстренное проведение инфузионной терапии (природные катастрофы, военные действия, травматические шоки и т. д.). В таких случаях удобно пользоваться расчетно-графическим способом, разработанным на кафедре ПТЛП (Громова Л. И., Кузьмина Ю. А., Чмут В. И. Патент на изобретение № 2357244 «Способ определения осмолярности электролитных инфузионных растворов»).
61
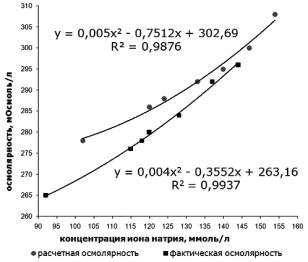
2.2. Расчетно-графический способ
Расчетно-графический способ позволяет определить фактическую осмолярность ИФР двумя методами.
2.2.1.Зная фактическую мольную концентрацию иона натрия
врастворе, которую определяют методом пламенной фотометрии, найти на графике или рассчитать по формуле (рис. 9) соответствующее значение осмолярности.
2.2.2.По рассчитанной теоретической осмолярности найти на графике (рис. 9) значение осмолярности близкое к фактическому для номинального содержания иона натрия.
На лабораторных занятиях используется метод 2.2.
Рис. 9. Зависимость осмолярности от концентрации ионов натрия
|
|
|
Таблица 7.4.1 |
|
|
Перечень оборудования, приборов, посуды |
|||
|
|
|
|
|
№ |
Наименование |
Назначение и краткая техническая |
|
Обозначение |
п/п |
характеристика |
|
||
|
|
|
||
1 |
Весы аналитические |
Для взвешивания компонентов |
|
ВАН |
2 |
Весы аптечные |
Интервал взвешивания 0,02—2,0 г |
|
ВАР |
ручные |
|
|||
|
Воронка |
Стеклянная, используется для |
|
|
3 |
предварительной фильтрации |
|
В |
|
коническая |
|
|||
|
|
инъекционных растворов |
|
|
62
Окончание табл. 7.4.1
№ |
Наименование |
Назначение и краткая техническая |
Обозначение |
|
п/п |
характеристика |
|||
|
|
|||
4 |
Емкость |
Эмалированная, для мойки флаконов |
ЕЭ |
|
|
|
Стеклянная. Для приготовления |
|
|
5 |
Колба мерная |
инъекционного раствора, емкостью |
КМ |
|
|
|
25, 50 или 100 мл |
|
|
6 |
Миллиосмометр МТ-2 |
Для определения фактической |
МТ |
|
осмолярности |
||||
7 |
Пикнометр |
Для определения плотности ИФР |
ПС |
|
стеклянный |
||||
|
|
Стеклянный. Используется для |
|
|
8 |
Стакан химический |
наполнения водой при мойке ампул и |
СХ |
|
|
|
ополаскивании ампул |
|
|
9 |
Шпатель |
Металлический |
ШП |
|
10 |
Шкаф ламинарный |
Скорость воздуха в рабочей зоне |
ШЛ |
|
509-80 |
0,79 м/с. Габарит 2065 × 1150 × 2650 мм |
|||
|
|
Полимерный, калиброванный, для |
|
|
11 |
Шприц |
наполнения флаконов, вместимость |
ШП |
|
|
|
10 мл |
|
|
12 |
Электроплитка |
Закрытого типа |
ЭП |
Методика выполнения работы 4.1. Электролитные растворы
1.Рассчитать количество компонентов необходимых для приготовления 100 мл ИФР, указанного в задании, и проверить полученный результат у преподавателя.
2.Мойка флаконов.
5 стеклянных флаконов вместимостью 10 мл поместить в эмалированную емкость и залить водой очищенной, чтобы они были полностью погружены в воду. На электроплитке нагреть емкость с флаконами до кипения воды, кипятить в течение 15 мин, выключить электроплитку и пинцетом перенести флаконы в чашку Петри.
3. Депирогенизация флаконов.
Чашку Петри с флаконами поместить в сушильный шкаф и выдерживать при температуре 120 °С в течение 30 мин. Пинцетом вынуть чашку Петри с флаконами и охладить в ламинарном шкафу до комнатной температуры.
4. Мойка и стерилизация пробок.
5 резиновых пробок для флаконов поместить в стеклянный химический стакан, залить водой очищенной, довести на электроплитке до кипения и кипятить в течение 30 мин. Снять стакан с электроплитки, пинцетом перенести пробки в чашку Петри, за-
63
крыть крышкой и перенести в ламинарный шкаф. 5. Приготовление и фильтрация ИФР.
Раствор готовят массообъемным методом и фильтруют (раз-
дел 5.2, п.п. 5.2.3 и 5.2.4).
6. Розлив ИФР и укупорка флаконов.
Вламинарном шкафу полимерным шприцем заполнить по 10,5 мл ИФР подготовленные флаконы и укупорить подготовленными пробками.
7. Обкатка колпачками.
Влабораторных условиях не проводится.
8. Термическая стерилизация.
В лабораторных условиях не проводится. 9. Маркировка.
Флаконы с ИФР маркируют этикеткой установленной формы.
Методика выполнения работы 4.2. Осмолярность. Методы определения
1.Рассчитать теоретическую осмолярность и ионный состав ИФР по формуле 4.1 (варианты заданий А и Б).
2.Использовать оставшийся в мерной колбе раствор для определения осмолярности (варианты заданий В и Г) на миллиосмометре.
2.1.Согласно инструкции по эксплуатации миллиосмометра определить осмоляльность раствора.
2.2.Определить плотность ИФР с помощью пикнометра. Плотность раствора рассчитывают по формуле (4.3):
= ((m2 – m) – 0,0012)/(m1 – m) + 0,0012 |
(4.3) |
где m — масса пустого пикнометра, г;
m1 — масса пикнометра с водой для инъекций, г; m2 — масса пикнометра с ИФР, г;
0,0012 — плотность воздуха при 20 °С и барометрическом давлении 760 мм рт. ст.
2.3.По значению осмоляльности и значению плотности рассчитать по формуле (4.2) соответствующую осмолярность раствора.
3.Рассчитать теоретическую осмолярность по формуле 4.1 и определить по графику (рис. 9) фактическую осмолярность (варианты заданий Д и Е).
4.Оформить отчет по работе 4.
64
Отчет по лабораторной работе должен содержать:
1.Задание
2.Состав ИФР
3.Все расчеты
4.Экспериментальные данные
Контрольные тесты
1.Осмолярность это
1.Суммарнаямольнаяконцентрацияионовв1лрастворителя
2.Суммарнаямольнаяконцентрацияионовв1кграстворителя
3.Суммарная мольная концентрация ионов в 1 л раствора
4.Суммарная мольная концентрация ионов в 1 кг раствора
2.Криометрический метод определения осмолярности основан на
1.Понижении температуры замерзания раствора по сравнению с растворителем
2.Понижении температуры замерзания растворителя по сравнению с раствором
3.Понижении давления над раствором по сравнению с растворителем
4.Понижении давления над растворителем по сравнению с раствором
3.ИФР упаковывают
1.В ампулы из стекла НС-1
2.Во флаконы из стекла НС-1
3.Во флаконы из стекла НС-3
4.Во флаконы из стекла МТО
4.В качестве растворителя для ИФР
1.Воду для инъекций
2.Воду очищенную
3.Воду дистиллированную
4.Воду очищенную с добавлением консерванта
5.Для первичной упаковки ИФР используют
1.Только полипропилен
2.Только полиэтилен
3.Только поливинилхлорид
4.Все перечисленные материалы
65
6.Обработка стеклянных флаконов сульфатом аммония производится для:
1.Понижения температуры плавления стекла
2.Уменьшения гидролиза стекла
3.Повышения термической стойкости
4.Улучшения качества мойки стекла
7.Фактическую осмолярность определяют методом
1.Криометрии
2.Спектрометрии
3.Жидкостной хроматографии
4.Расчета по молекулярной массе компонентов
66
Лабораторная работа № 5 Раствор Желатиноль для инфузий
Цель работы
Изучение технологии плазмозамещающего гемодинамического препарата «Раствор Желатиноль для инфузий».
Задание
1.Получить гидролизат желатина методом щелочного гидролиза с последующей нейтрализацией.
2.Провести технологический и постадийный контроль процесса гидролиза и заполнить таблицу показателей контроля.
3.Получить препарат «Раствор Желатиноль для инфузий» используя гидролизат желатина.
4.Оформить отчет.
Теоретические основы работы
Гемодинамические растворы применяют при массивных кровопотерях, для лечения шоков различного генеза, при операциях для восстановления гемодинамики и микроциркуляции крови и т. д.
Гемодинамические действие достигается за счет высокого коллоидно-осмотического давления растворов, что способствует восстановлению объема циркулирующей крови. При этом происходит прирост объема плазмы за счет привлечения в сосудистое русло тканевой жидкости и удержания ее в течение определенного времени. В состав гемодинамических растворов входят высокомолекулярные соединения (ВМС): декстраны, оксиэтилированные крахмалы, полиэтиленгликоль, модифицированный желатин. Раствор желатина был первым плазмозамещающим раствором, предложенным для лечения шока и кровопотерь.
Группу зарегистрированных в Российской Федерации препаратов на основе модифицированного желатина представляют Желатиноль (раствор для инфузий 8 % во флаконах по 200 мл и 450 мл, ООО Самсон-Мед, Россия), Гелофузин (раствор для инфузий 4 % в бутылках полиэтиленовых по 500 мл, Б.Браун Медикал АГ, Швейцария), Гелоплазма-баланс (раствор для инфузий
67
3 % в мешках пластиковых двухслойных по 500 мл, Фрезениус Каби Франс, Франция).
Желатиноль представляет собой янтарного цвета коллоидный раствор частично расщепленного желатина в изотоническом растворе натрия хлорида, со специфическим запахом, сильно вспенивающийся при взбалтывании. Коллоидноосмотическое давление 2,0—2,4 кПа , рН 6,8-7,4, относительная вязкость 2,2—3,0, осмолярность 371 мОсм/л, средняя молекулярная масса (ММ) около 20000, длительность волемического эффекта 1—2 часа.
Желатин является денатурированным белком, получаемым из коллагенсодержащих тканей скота в результате ступенчатой тепловой и химической обработок. Водные растворы желатина имеют большую вязкость и при температуре ниже 40 °С превращаются в гель, что делает их непригодными для непосредственного внутривенного введения. С целью понижения точки гелеобразования проводят модификацию желатина, в частности, путем гидролиза. В качестве гидролизующего агента может использоваться натрия гидроксид.
Методика выполнения работы
Состав препарата: |
|
Желатина пищевого |
80 г |
Натрия хлорида |
9 г |
Воды для инъекций |
до 1 л |
Таблица 7.5.1
Перечень оборудования, приборов, посуды
№ |
Наименование |
Назначение и краткая техническая |
Обозначение |
|
п/п |
|
характеристика |
|
|
1 |
Баня водяная |
для проведения гидролиза |
|
|
желатина |
|
|||
|
|
|
||
2 |
Весы аналитические |
для взвешивания компонентов |
ВАН |
|
|
|
|
|
|
3 |
Весы аптечные |
интервал взвешивания 0,02— |
ВАП |
|
2,0 г |
||||
|
|
|
||
4 |
Вискозиметр |
ВПЖ-3, стеклянный |
ВПЖ |
|
5 |
Мешалка |
с электроприводом |
М |
|
|
|
|
|
|
6 |
Палочка стеклянная |
для перемешивания |
ПСТ |
|
7 |
Пикнометр стеклянный |
класс точности 1 |
ПС |
|
|
|
|
|
68
Окончание табл. 7.5.1
№ |
Наименование |
Назначение и краткая техническая |
Обозначение |
|
п/п |
|
характеристика |
|
|
8 |
рН-метр |
лабораторный |
РН |
|
|
|
|
|
|
9 |
Стакан химический |
стеклянный |
СХ |
|
|
|
|
|
|
10 |
Стерилизатор |
ГП-20, металлический, |
СП |
|
паровой, Т=85 °С—180 °С |
||||
|
|
|
||
|
|
|
|
|
11 |
Термометр |
стеклянный, спиртовой |
Т |
|
|
|
|
|
|
12 |
Цилиндр |
стеклянный |
Ц |
|
|
|
|
|
|
13 |
Чашки выпарительные |
фаянсовые |
ЧВ |
|
|
|
|
|
|
|
|
скорость воздуха в рабочей |
|
|
14 |
Шкаф ламинарный 509-80 |
зоне 0,79 м/с; |
ШЛ |
|
|
|
габарит 2065´1150´2650 мм |
|
|
|
|
|
|
|
15 |
Шпатель |
металлический |
ШП |
|
|
|
|
|
|
16 |
Электроплитка |
закрытого типа |
ЭП |
|
|
|
|
|
Работа 5.1. Гидролиз желатина
Все технологические параметры процесса гидролиза желатина и результаты постадийного контроля оформляются в виде таблицы 7.5.2, которая приведена в конце работы.
Набухание желатина
На технических весах отвешивают 12,5 г желатина и помещают в выпарительную чашку. Цилиндром отмеривают 25 мл воды для инъекций (ВДИ), прибавляют к желатину и оставляют его для набухания на 30 мин.
Приготовление 3 % раствора натрия гидроксида
Цилиндром отмеривают 28 мл воды для инъекций и переносят в химический стакан вместимостью 50 мл. На аптечных весах отвешивают 0,85 г натрия гидроксида. Осторожно, при перемешивании, небольшими порциями добавляют натрия гидроксид в химический стакан с водой. Перемешивают стеклянной палочкой до получения прозрачного раствора.
Подготовка к гидролизу
На штатив с мешалкой устанавливают электроплитку с водяной баней при температуре (85 ± 5) °С.
69
Цилиндром отмеривают 75 мл ВДИ и помещают в фарфоровый стакан вместимостью 250 мл. Стакан помещают в подготовленную водяную баню, погружают в стакан мешалку. Включают мешалку и устанавливают скорость вращения 500 об/мин. Доводят температуруводывстаканедо(70 ± 5)°С,контролируяспомощьюстеклянного термометра. Значение температуры воды заносят в табл. 7.5.2.
Набухший желатин при включенной мешалке небольшими порциями с помощью шпателя переносят из выпарительной чашки в стакан. Перемешивание продолжают до полного растворения желатина. Полноту растворения контролируют визуально. Результат контроля заносят в табл. 7.5.2.
Цилиндром отмеривают 14 мл ранее приготовленного 3 % раствора натрия гидроксида выливают в химический термостойкий стакан вместимостью 25 мл и нагревают на водяной бане до температуры (70 ± 5)°С. Нагретый раствор натрия гидроксида осторожно, в защитных очках или маске тонкой струёй при работающей мешалке прибавляют к раствору желатина. Окончание добавления раствора натрия гидроксида считают началом гидролиза и фиксируют это время в табл. 7.5.2.
Гидролиз желатина
Выключают мешалку, отбирают два раза пипеткой на 20 мл пробы раствора желатина общим объемом 40 мл, переносят в химический стакан вместимостью 50 мл, и вновь включают мешалку и продолжают гидролиз в течение часа. Пробу используют для определения показателей раствора желатина перед началом гидролиза.
Определение рН
Проводят на лабораторном рН-метре согласно инструкции к прибору.
Результаты заносят в табл. 7.5.2.
Определение плотности раствора
Плотность раствора (и гидролизата) желатина определяют с помощью пикнометра и рассчитывают по формуле (4.3), как описано в лабораторной работе 4.2 (п. 2.2).
Определение относительной вязкости раствора желатина
Стеклянный вискозиметр имеет капилляр с радиусом R и длиной L, через который под действием силы тяжести протекает жидкость объема V, с измерительным резервуаром, ограниченным двумя метками М1 и М2. Измерение вязкости основано на
70
