
- •Закономерности протекания химических реакций. Электрохимические процессы
- •Введение
- •Тема 3. Энергетика и направленность химических процессов
- •Типовые задачи и алгоритмы их решения
- •Термодинамические величины некоторых веществ при стандартных условиях
- •Вопросы для самостоятельной подготовки к контрольной работе
- •Задачи для самостоятельного решения
- •Тема 4. Химическая кинетика и равновесие
- •Типовые задачи и алгоритмы их решения
- •Смещение химического равновесия (принцип Ле-Шателье)
- •Вопросы для самоподготовки
- •Задачи для самостоятельного решения
- •Тема 5. Химическая активность металлов. Электродные потенциалы и электродвижущие силы
- •Стандартные электродные потенциалы некоторых металлов
- •Типовые задачи и алгоритмы их решения
- •Вопросы для самостоятельной подготовки
- •Задачи для самостоятельного решения
- •Тема 6. Коррозия и защита металлических конструкций
- •Типовые задачи и алгоритмы их решения
- •4Fe(oh)3 – приблизительная формула ржавчины.
- •Вопросы для самостоятельной подготовки
- •Задачи для самостоятельного решения
- •Библиографический список рекомендуемой литературы
- •Оглавление
- •Закономерности протекания химических реакций. Электрохимические процессы
Вопросы для самостоятельной подготовки к контрольной работе
Сформулируйте основные понятия и определения химической термодинамики: система (гомогенная, гетерогенная, открытая, закрытая, изолированная), параметры состояния.
Что входит в понятие внутренняя энергии – ΔU вещества (или системы); от каких параметров она зависит?
Сформулируйте закон сохранения энергии и примените его для расчета изменения внутренней энергии в ходе процессов. Усвоить термодинамическую систему знаков.
Каким параметром обозначается тепловой эффект процессов, протекающих при постоянном давлении, понятие об энтальпии (ΔH)? Какое уравнение связывает энтальпию с внутренней энергией системы.
Сформулируйте закон Гесса и следствия из него по энтальпиям образования и сгорания химических соединений.
В чем заключается физический смысл энтропии – S? От каких параметров она зависит?
По изменению какой термодинамической функции можно судить о направленности химических процессов? Какая формула используется для расчета изменения изобарно-изотермического потенциала?
Как связана энергия Гиббса с константой равновесия и как по ее величине можно судить о выходе продуктов реакции?
Задачи для самостоятельного решения
Определите изменение внутренней энергии при испарении 2 моль толуола при 30 0С, приняв, что пары толуола подчиняются законам идеального газа. Теплота испарения толуола 31997,6 Дж/моль. Ответ: 88,41 кДж.
Газ, расширяясь при постоянном давлении 1,0133 ·105 Па от 25·10-3 м3 до 75·10-3 м3, поглощает 12570 Дж теплоты. Определите изменение внутренней энергии системы. Ответ: 7,504 кДж.
Рассчитайте тепловой эффект реакции, протекающей в изобарно-изотермических условиях по уравнению
СаСО3+SiO2→CaSiO3+CO2(Г), ΔH0реак..
Условия стандартные. Укажите к какому типу относится данная реакция - эндо- или экзотермическому.
Определите стандартную энтальпию образования доломита (СаСО3·MgCO3), если тепловой эффект реакции его разложения, протекающей по уравнению
СаСО3·MgCO3→СаО+MgO+2CO2(Г) равен 303 кДж.
В зависимости от температуры реакция
СаО+Н2О(Ж)→Са(ОН)2
может протекать в прямом и обратном направлении. Решите вопрос, рассчитав ΔG0реак., о возможности гашения извести при стандартных условиях.
При получении кальцинированной соды идет реакция
2NaHCO3↔Na2CO3+CO2(Г)+Н2О(Г).
Определите возможность протекания данного процесса в стандартных изобарно-изотермических условиях и температуру, при которой наступит состояние термодинамического равновесия.
Литература: [1, гл. 5, §§ 5.3-5.4]; [2, работы 6, 8].
Тема 4. Химическая кинетика и равновесие
Химическая кинетика изучает скорость химических реакций, механизм их протекания. Скорость реакции () зависит от концентрации реагирующих веществ и эта зависимость выражается законом действующих масс, математическое выражение которого для реакции аА + вВ ↔ сАВ имеет вид
= k СаА СвВ, (4.1)
где k – константа скорости;
СА и СВ – концентрации реагирующих веществ;
а, в – стехиометрические коэффициенты.
Выражение (4.1) называют кинетическим уравнением реакции.
При столкновении частиц, не каждое их столкновение приводит к взаимодействию, взаимодействуют только те частицы, которые в момент столкновения обладают такой энергией, которая достаточна для разрыва связей в молекулах и образования активных частиц, способных к взаимодействию. Величину такой энергии называют энергией активации системы.
Согласно правилу Вант-Гоффа, зависимость скорости реакции от температуры выражается уравнением
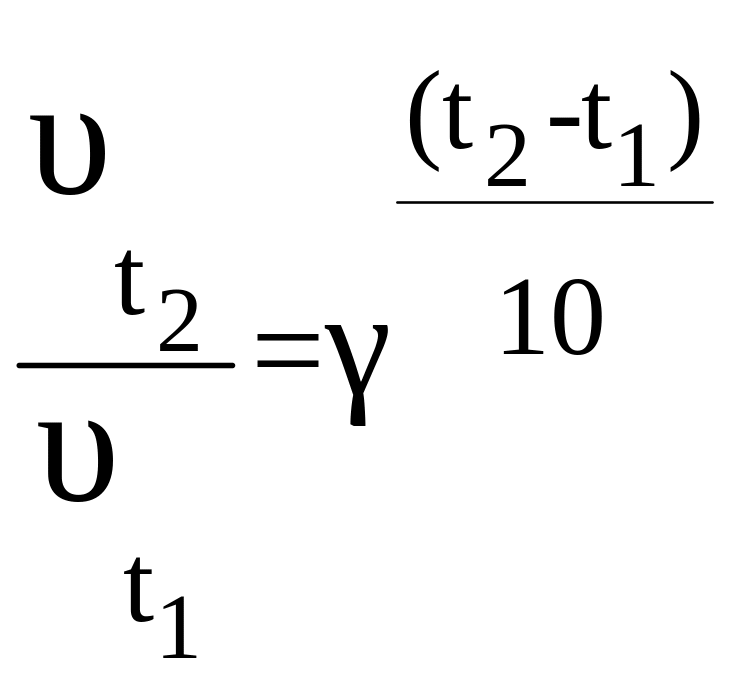 ,
(4.2)
,
(4.2)
где, γ- температурный коэффициент скорости реакции, принимающий значение от 2-х до 4-х.
Химические реакции делятся на необратимые и обратимые. Если в ходе обратимого процесса скорости прямой и обратной реакции становятся одинаковыми, то в системе наступает состояние химического равновесия. При постоянстве параметров (температуры, давления, концентрации веществ) система может находиться в состоянии равновесия неопределенно долго. Изменение хотя бы одного из этих параметров приводит к тому, что состояние равновесия нарушится и установится новое состояние равновесия. Направление смещения равновесия определяется принципом Ле-Шателье .
