
- •Свойства неорганических соединений и водных растворов электролитов
- •Введение
- •Тема 1. Основные классы неорганических соединений
- •Примеры некоторых амфотерных гидроксидов
- •1.2. Соли
- •1.3. Примеры Решения задач
- •1.4. Вопросы для самостоятельной подготовки к контрольной работе
- •1.5. Задачи и упражнения для самостоятельной работы
- •Тема 2. Равновесия в водных растворах электролитов. Водородный показатель. Гидролиз солей
- •2.1. Электролитическая диссоциация
- •Кислот, оснований, солей
- •Константа диссоциации некоторых слабых электролитов в водных растворах (25°с)
- •2.2. Примеры заданий
- •2.3. Ионные реакции двойного обмена
- •Порядок составления уравнений реакций
- •2.4. Водородный показатель рН
- •Логарифмическая шкала и водородный показатель рН
- •Расчеты значений рН и рОн для сильных кислот и оснований Примеры, в которых концентрация выражена в стандартной форме
- •Примеры расчета рН для одноосновных кислот и однокислотных оснований
- •Примеры расчета рН для многоосновных кислот и многокислотных оснований
- •Расчеты значений pH, константы диссоциации, степени диссоциации и концентрации для слабых кислот
- •Примеры расчета значений рН, константы диссоциации и концентрации для слабых кислот
- •1,810-5 Моль/л. Определить рН раствора кислоты с концентрацией 0,1 моль/л.
- •Методы измерения рН
- •Характерная окраска и области перехода ряда индикаторов
- •2.5 Гидролиз солей
- •2.6. Вопросы для самостоятельной подготовки к контрольной работе
- •2.7. Задачи и упражнения для самостоятельной работы
- •Библиографический список рекомендуемой литературы
- •Оглавление
- •Свойства неорганических соединений и водных растворов электролитов
Константа диссоциации некоторых слабых электролитов в водных растворах (25°с)
-
Химическая
формула
Название электролитов
Константа
диссоциации
HF
Фтороводородная кислота
КД = 7,0 104
HNO2
Азотистая кислота
КД = 4,0 104
CH3COOH
Уксусная кислота
КД = 1,8 105
HCN
Циановодородная кислота
КД = 8,0 1010
H2SO3
Сернистая кислота
КДI = 1,6 102
КДII = 6,3 108
H2CO3
Угольная кислота
КДI = 4,5 107
КДII = 4,7 1011
H2S
Сероводородная кислота
КДI = 6,0 108
КДII = 1,0 1014
H2SiO3
Кремневая кислота
КДI = 2,2 1010
КДII = 1,6 1012
H3PO4
Фосфорная кислота
КДI = 7,5 103
КДII = 6,2 108
КДIII = 5,0 1013
H3BO3
Борная кислота
КДI = 5,8 1010
КДII = 1,8 1013
КДIII = 1,6 1014
NH4OH
Гидроксид аммония
КДI = 1,8 105
Pb(OH)2
Гидроксид свинца
КДI = 9,6 104
КДII = 3,0 108
Zn(OH)2
Гидроксид цинка
КДII = 3,0 108
Fe(OH)2
Гидроксид железа (II)
КДII = 1,82 1011
Mg(OH)2
Гидроксид магния
КДII = 2,6 103
Cu(OH)2
Гидроксид меди (II)
КДII = 3,4 107
Ni(OH)2
Гидроксид никеля (II)
КДII = 2,5 105
Cr(OH)3
Гидроксид хрома (III)
КДIII = 1,02 1010
Al(OH)3
Гидроксид алюминия
КДIII = 1,38 109
H2O
Вода
КД = 1,86 1016
2.2. Примеры заданий
Задание 1. Составьте уравнения электролитической диссоциации следующих электролитов: НCl, H2SO4, H2SiO3, NaOH, Ca(OH)2, Al(OH)3, Zn(OH)2, ZnSO4, Al2(SO3)3, NaHCO3, K2HPO4, KH2PO4, ZnOHCl, Fe(OH)2Cl, FeOHCl2.
Запишите выражение для КД, где это возможно.
Решение.
Кислоты НCl, H2SO4 являются сильными электролитами. В растворах они диссоциируют в одну ступень с образованием катиона водорода Н+:
НCl Н+ + Cl;
H2SO4 2H+ + SO42.
Константа диссоциации для сильных электролитов не имеет смысла.
Кислота H2SiO3 – слабый электролит, диссоциирует ступенчато, количество ступеней определяется основностью кислоты, то есть количеством ионов водорода в ней. Кислота H2SiO3 – двухосновная, ступеней диссоциации две.
Первая ступень диссоциации (отщепляется один ион водорода от молекулы кислоты):
H2SiO3
H+
+ НSiO3,
КДI
(H2SiO3)
=
 .
.
Вторая ступень диссоциации (отщепляется ион водорода от сложного аниона НSiO3):
НSiO3
H+
+ SiO32,
КДII
(H2SiO3)
=
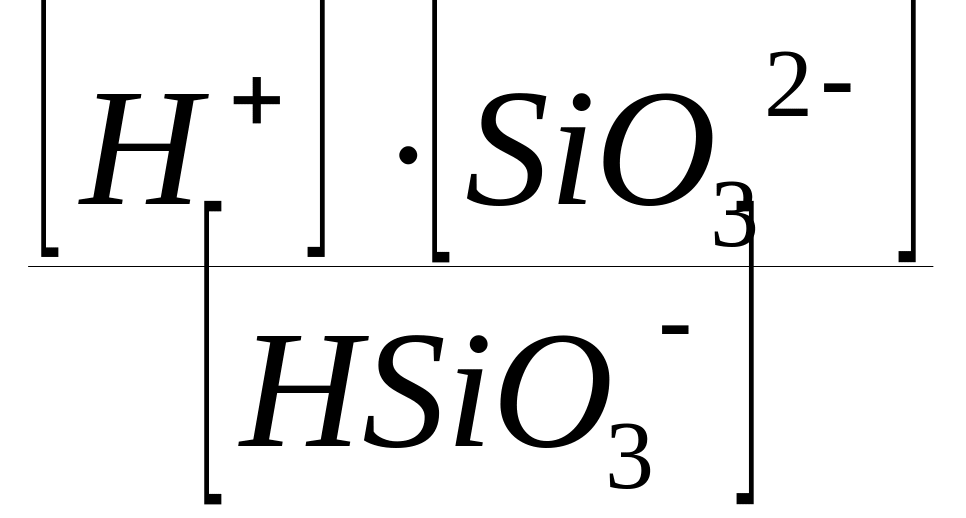 .
.
Квадратная скобка обозначает равновесную концентрацию соответствующего иона или молекулы.
Основания NaOH, Вa(OH)2 – являются сильными электролитами, диссоциируют в растворе в одну ступень с образованием гидроксид-иона ОН:
NaOH Na+ + OH;
Вa(OH)2 Вa2+ + 2OH.
Константа диссоциации для сильных электролитов не имеет смысла.
Основание Al(OH)3 – слабое основание, диссоциирует ступенчато. Число ступеней определяется кислотностью основания, то есть количеством групп ОН.
Составим уравнение электролитической диссоциации слабого трехкислотного основания Al(OH)3.
Первая ступень диссоциации (отщепляется один ион гидроксида ОН от молекулы основания):
Al(OH)3
ОН
+ Al(OH)2+;
КДI
(Al(OH)3)
=
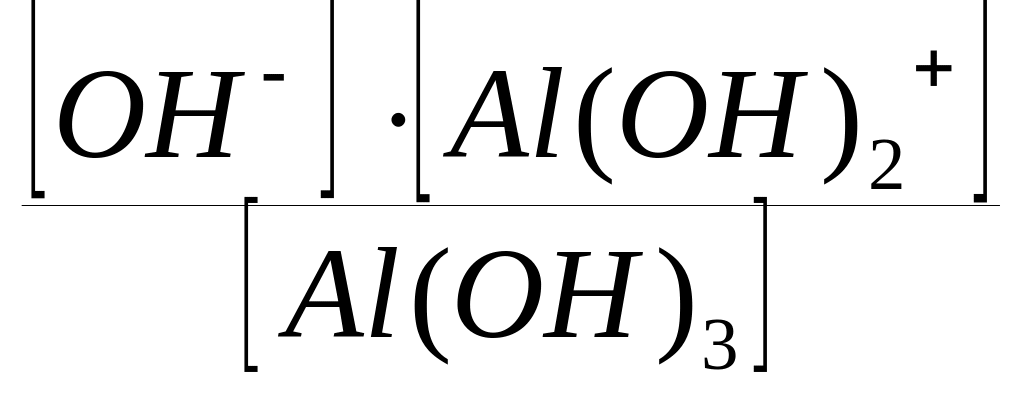 .
.
Вторая ступень диссоциации (отщепляется ион гидроксида ОН от сложного катиона Al(OH)2+):
Al(OH)2+
ОН
+ AlOH2+;
КДII
(Al(OH)3)
=
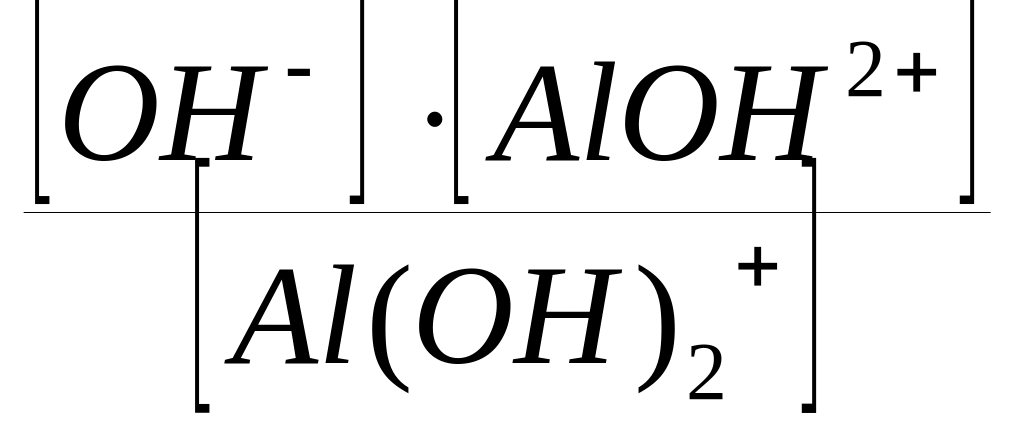 .
.
Третья ступень диссоциации (отщепляется ион гидроксида ОН от сложного катиона AlOH2+):
AlOH2+
ОН
+ Al3+;
КДIII
(Al(OH)3)
=
 .
.
Составим уравнение электролитической диссоциации гидроксида цинка Zn(OH)2 без учета её ступенчатого характера:
2Н+ + ZnO22 Н2ZnO2 Zn(OH)2 Zn2+ + 2OH.
по типу кислот в растворе по типу оснований
Таким образом, амфотерные гидроксиды (Ве(ОН)2, Zn(OH)2, Sn(OH)2, Cr(OH)3, Al(OH)3 и др.) – это слабые электролиты, которые при диссоциации образуют одновременно катионы водорода Н+ и гидроксид - анионы ОН, то есть диссоциируют по типу слабой кислоты и слабого основания.
Средние соли ZnSO4, Al2(SO3)3 – сильные электролиты, образуют при диссоциации катионы металла и анионы кислотного остатка:
ZnSO4 Zn2+ + SO42;
Al2(SO3)3 2Al3+ + 3SO32.
Константа диссоциации для сильных электролитов не имеет смысла.
Кислые соли: а) NaHCO3, б) K2HPO4, в) KH2PO4 диссоциируют ступенчато, по первой ступени по типу солей, то есть сильных электролитов, на катион металла и сложный анион.
По второй ступени сложный анион диссоциирует частично по типу кислот – на ион водорода и кислотный остаток:
а) первая ступень диссоциации
NaHCO3 Na+ + HCO3;
вторая ступень диссоциации
HCO3
H+
+ CO32;
КДII
(H2СO3)
=
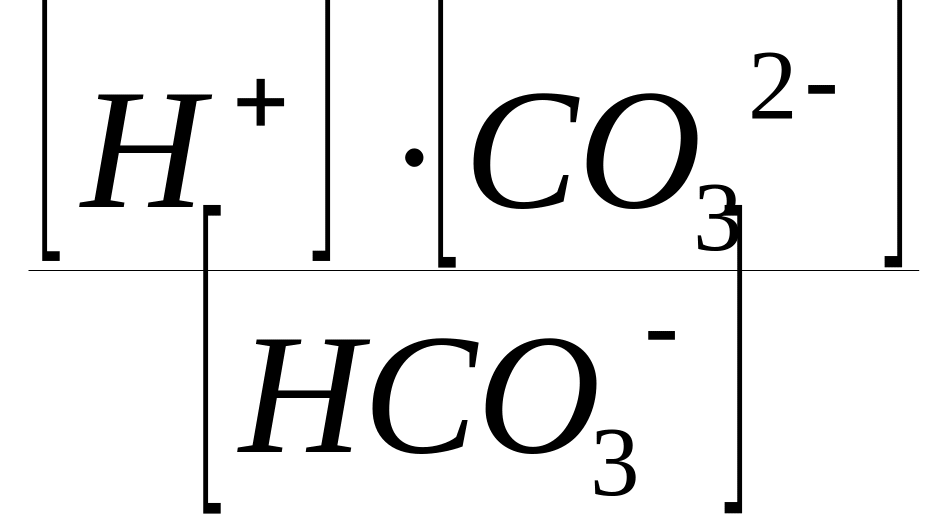 ;
;
б) первая ступень диссоциации
K2HPO4 2K+ + HPO42;
вторая ступень диссоциации
HPO42
H+
+ PO43;
КДIII
(H3РO4)
=
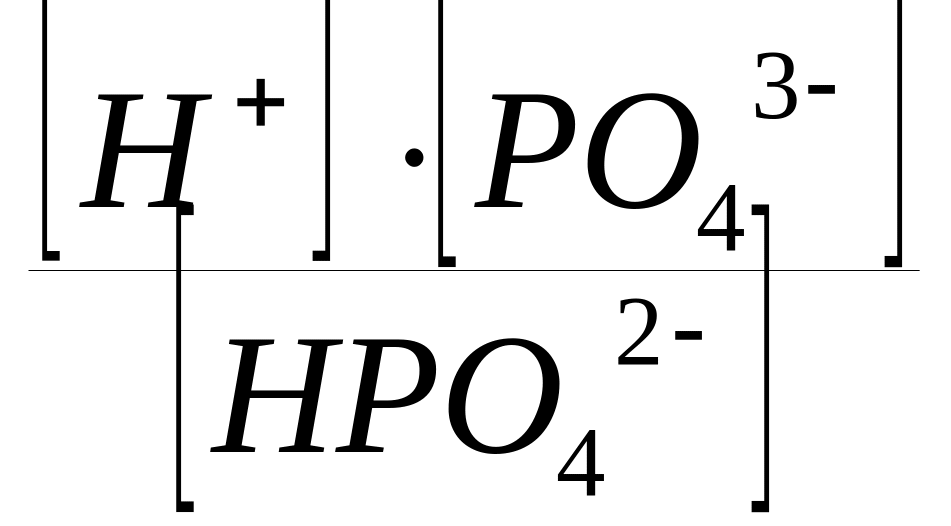 ;
;
в) первая ступень диссоциации
KH2PO4 K+ + H2PO4;
вторая ступень диссоциации
H2PO4
H+
+ HPO42;
КДII
(H3РO4)
=
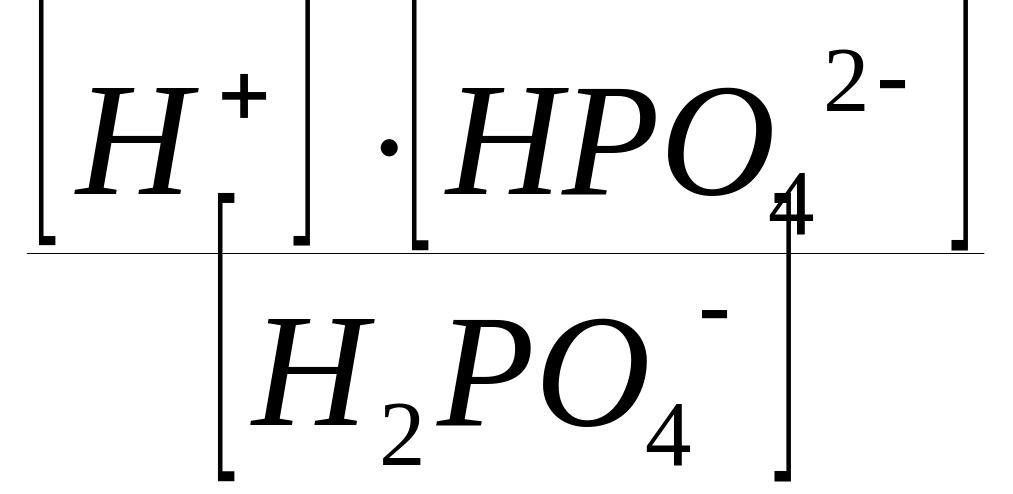 ;
;
третья ступень диссоциации
HPO42 H+ + PO43; КДIII (H3РO4) = .
Основные соли: а) ZnOHCl, б) Fe(OH)2Cl, в) FeOHCl2 – электролиты, диссоциирующие ступенчато, по первой ступени при диссоциации образуют анионы кислотного остатка и сложные катионы, состоящие из атомов металла и гидроксогрупп ОН. По второй ступени диссоциируют по типу оснований – на ион-гидроксида и катион металла.
а) первая ступень диссоциации
ZnOHCl ZnOH+ + Cl;
вторая ступень диссоциации
ZnOH+
Zn2+
+ OH;
КДII
(Zn(OH)2)
=
![]() ;
;
б) первая ступень диссоциации
Fe(OH)2Cl Fe(OH)2+ + Cl;
вторая ступень диссоциации
Fe(OH)2+
FeОН2+
+ OH;
КДII
(Fe(OH)3)
=
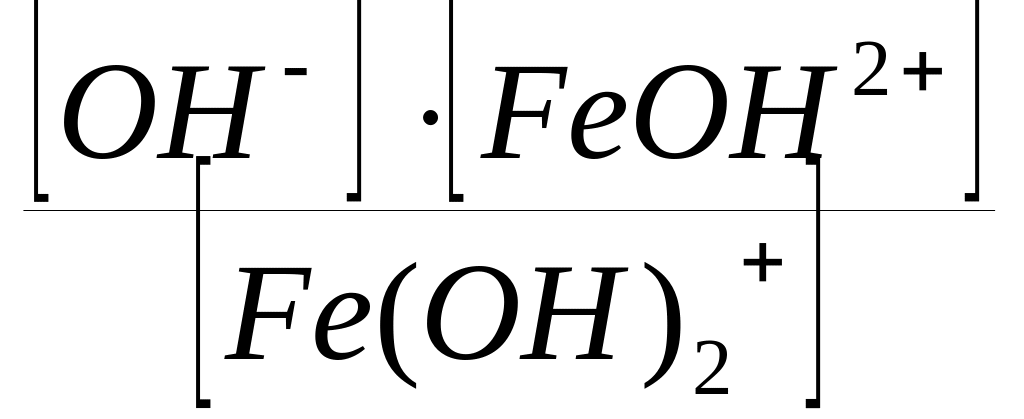 ;
;
третья ступень диссоциации
FeОН2+
Fe3+
+ OH;
КДIII
(Fe(OH)3)
=
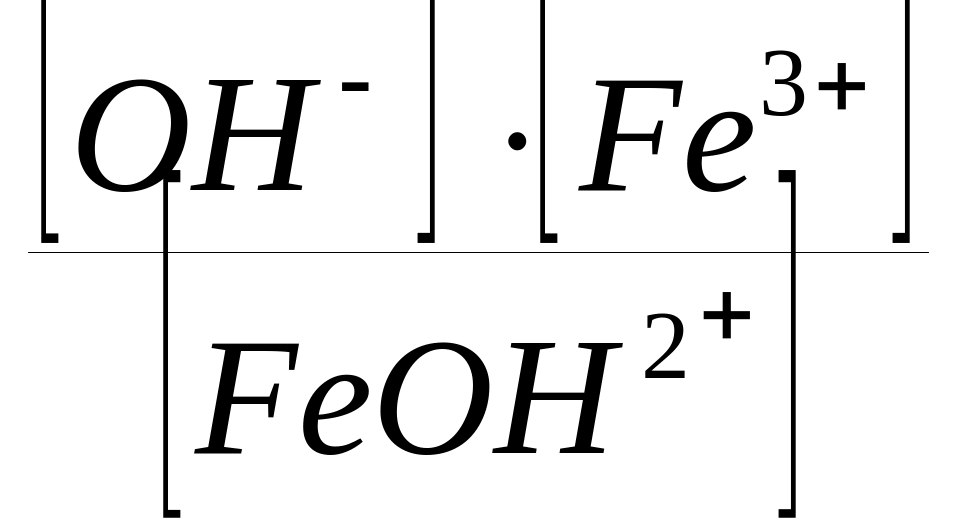 ;
;
в) первая ступень диссоциации
FeOHCl2 FeOH2+ + 2Cl;
вторая ступень диссоциации
FeОН2+ Fe3+ + OH; КДIII (Fe(OH)3) = .
