
BELKI_2_rasshirennaya_versia
.docОлигомерные белки и их способность к регуляции функций.
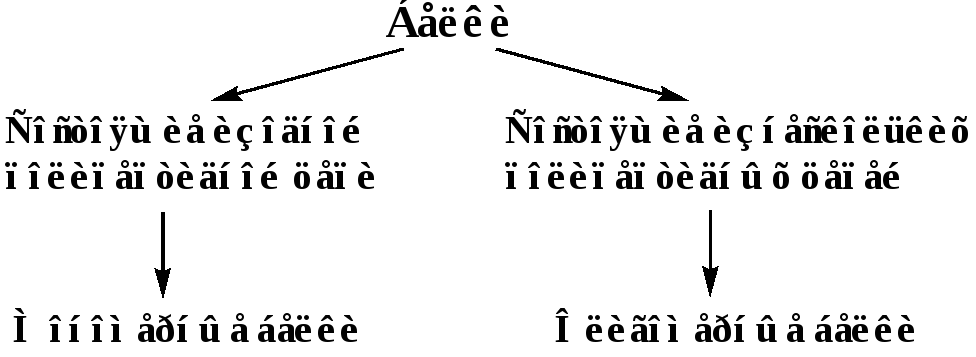
Протомер (субъединица) – это часть олигомерного белка, состоящая из одной полипептидной цепи.
Причем, каждая полипептидная цепь такого белка имеет собственную первичную, вторичную и третичную структуру и приобретает собственную конформацию.
Олигомерные белки – это белки, состоящие из нескольких протомеров.
Олигомерные белки могут содержать от 2-х до нескольких тысяч субъединиц.
Примеры: гемоглобин (4 субъединицы); аспартаттранскарбомоилаза (12 субъединиц); белок вируса табачной мозаики (2120 субъединиц).
Четвертичная структура белка – это количество, способ расположения и пространственной укладки протомеров в олигомерном белке.
Участки, с помощью которых протомеры объединяются между собой при сборке олигомерного белка, называются: контактные поверхности.
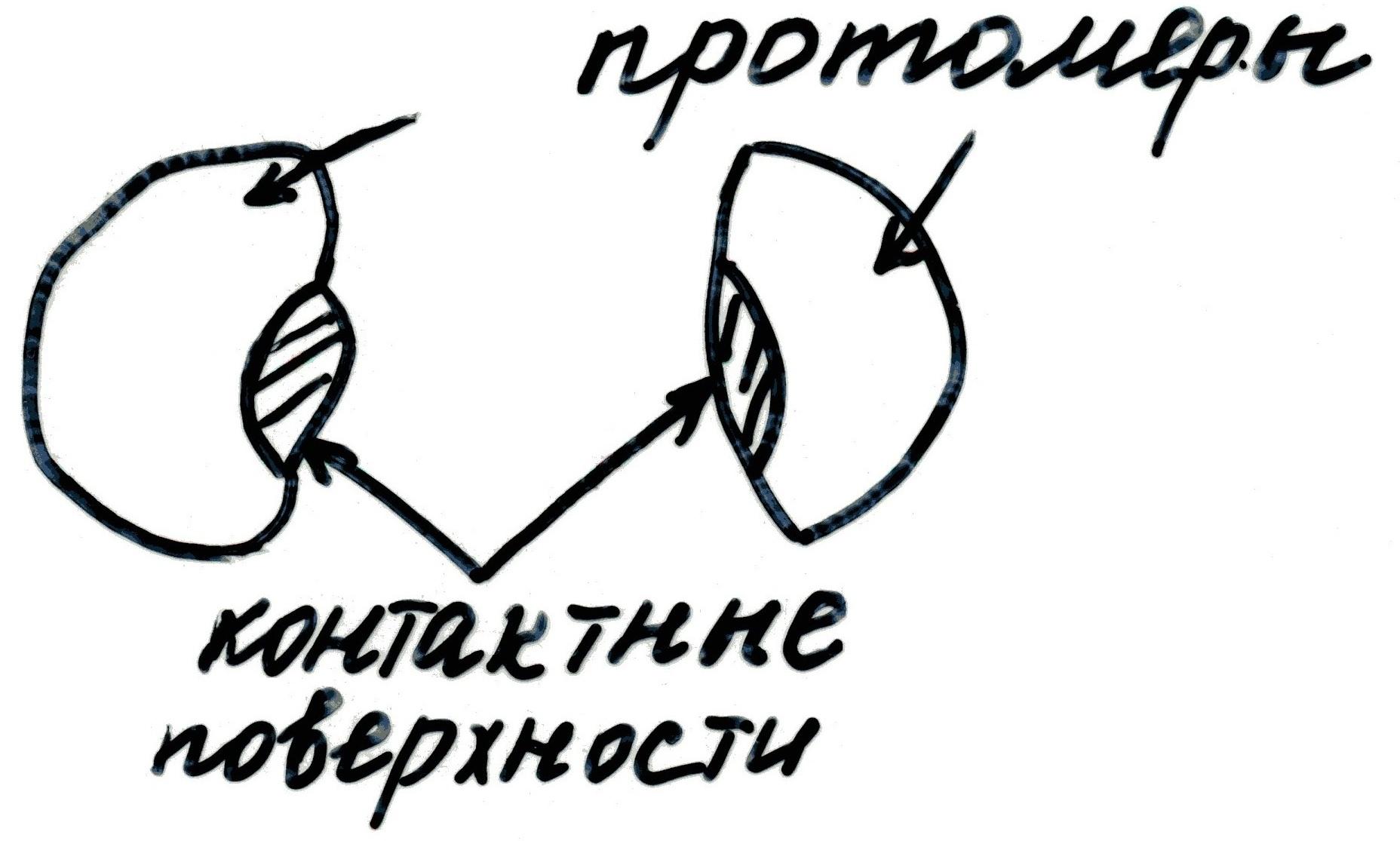
Протомеры объединяются друг с другом по принципу комплементарности их контактных поверхностей. Связи между протомерами: водородные, ионные и гидрофобные.

Способность олигомерных белков к регуляции функций
Два родственных белка – гемопротеина:
|
Миоглобин (Mb) |
Гемоглобин (Hb) |
|
Mb – белок красных мышц. Запасает O2 и отдает его только при очень интенсив- ной работе, т.к. имеет очень высокое сродство к O2.
I стр-ра: Одна полипептид. цепь – 153 аминокислоты.
II стр-ра: 8-спиралей (названия от A до H)
I
IV стр-ра: отсутствует.
|
Hb – содержится в эритроцитах. Транспортирует O2 из легких в ткани. (Из тканей в легкие переносит CO2 и H+) Количество O2, отдаваемое в ткани, может регулироваться.
I стр-ра: -цепь – 141 аминок-та -цепь – 146 аминок-т.
------------ // ------------
------------ // ------------
О |
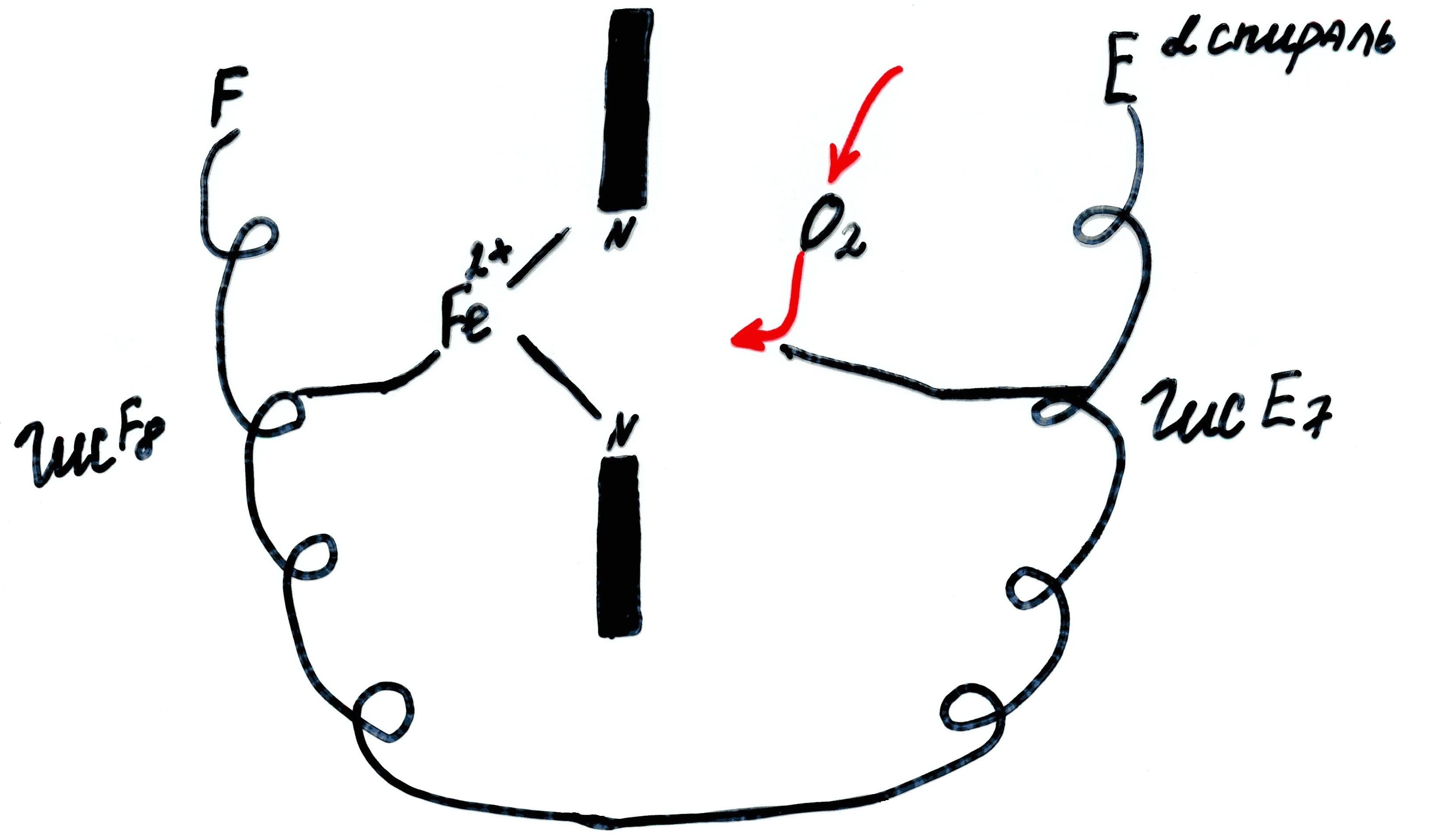
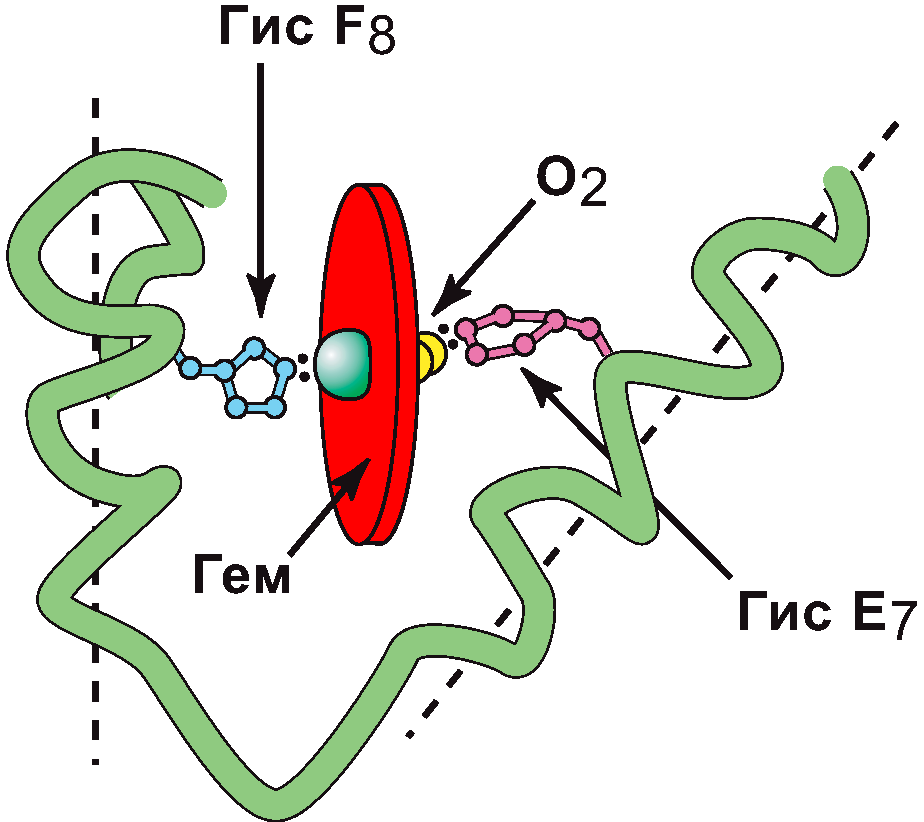
Строение активного центра Mb и Hb:
-
Активный центр Mb и Hb расположен в «кармане», образованными двумя спиралями F и E, имеющие гидрофобные радикалы аминокислот, за исключением 2 остатков гистидина F8 и E7.
-
В центре гема располагается ион Fe2+, связанный 4 связями с атомами азота пиррольных колец.
-
Fe гема связывается в активном центре ещё одной прочной связью с Гис F8 и выходит из плоскости гема.
-
O2 – гидрофобная молекула, легко проникает в активный центр и связывается с Fe гема по другую сторону его плоскости.
-
Гис E7 – создает оптимальные условия для связывания O2 и уменьшает сродство гема к CO.
Строение активного центра Mb и Hb
(схема из малинового учебника):
Кривые диссоциации O2 для Mb и Hb:
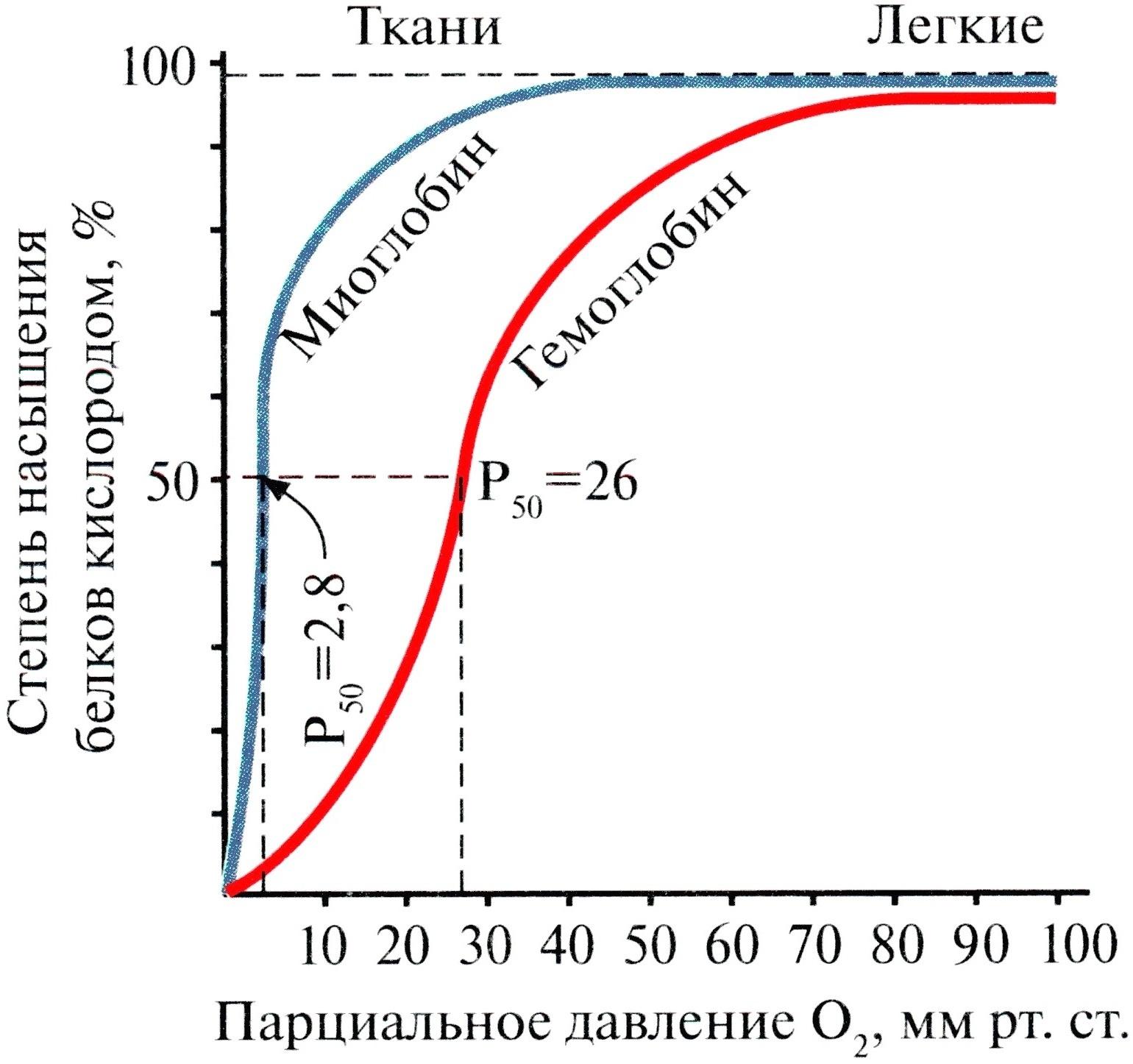
1) Mb имеет очень большое сродство к O2.
При ПД O2 – 40 мм рт. ст. в венозной крови Mb полностью насыщен O2. И даже при низком ПД O2 – (10-20 мм рт. ст.) Mb почти полностью насыщен O2. Только при тяжелой физической работе ПД O2 может снизиться до 5 мм рт. ст., и Mb способен легко отдавать O2.
2) Hb – насыщается в легких O2 на 100%, а в тканях отдает его в зависимости от ПД.
В отдыхающих мышцах ПД O2 – 40-50 мм рт. ст. При этом Hb отдает тканям ~ 20% O2.
В работающей мышце ПД O2 падает до 10 мм рт. ст. и Hb резко отдачу O2.
Вывод: отдача O2 в ткани – регулируемая функция Hb.
Это происходит благодаря кооперативным изменениям конформации протомеров.
Кооперативные взаимодействия между протомерами характерны для всех олигомерных белков.
Это проявляется в том, что изменение конформации одной из субъединиц олигомерного белка приводит к изменению конформации всех субъединиц, т.е. конформации всего белка.

В легких: присоединение 1-й молекулы O2 к протомеру Hb меняет конформацию всего олигомерного белка и облегчает присоединение следующих молекул O2 к другим протомерам.
Последняя молекула O2 присоединяется к Hb в 300 раз легче, чем первая.
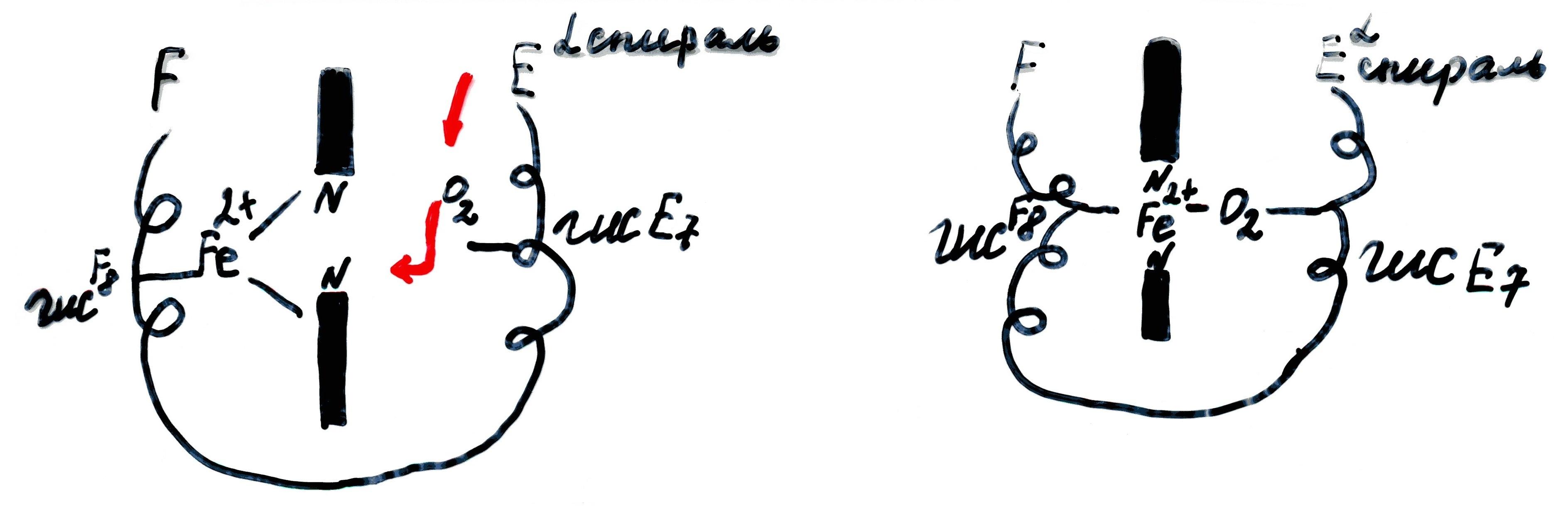
В тканях: отрыв 1-й молекулы O2 облегчает отщепление от Hb всех последующих молекул O2.
Типы гемоглобина:
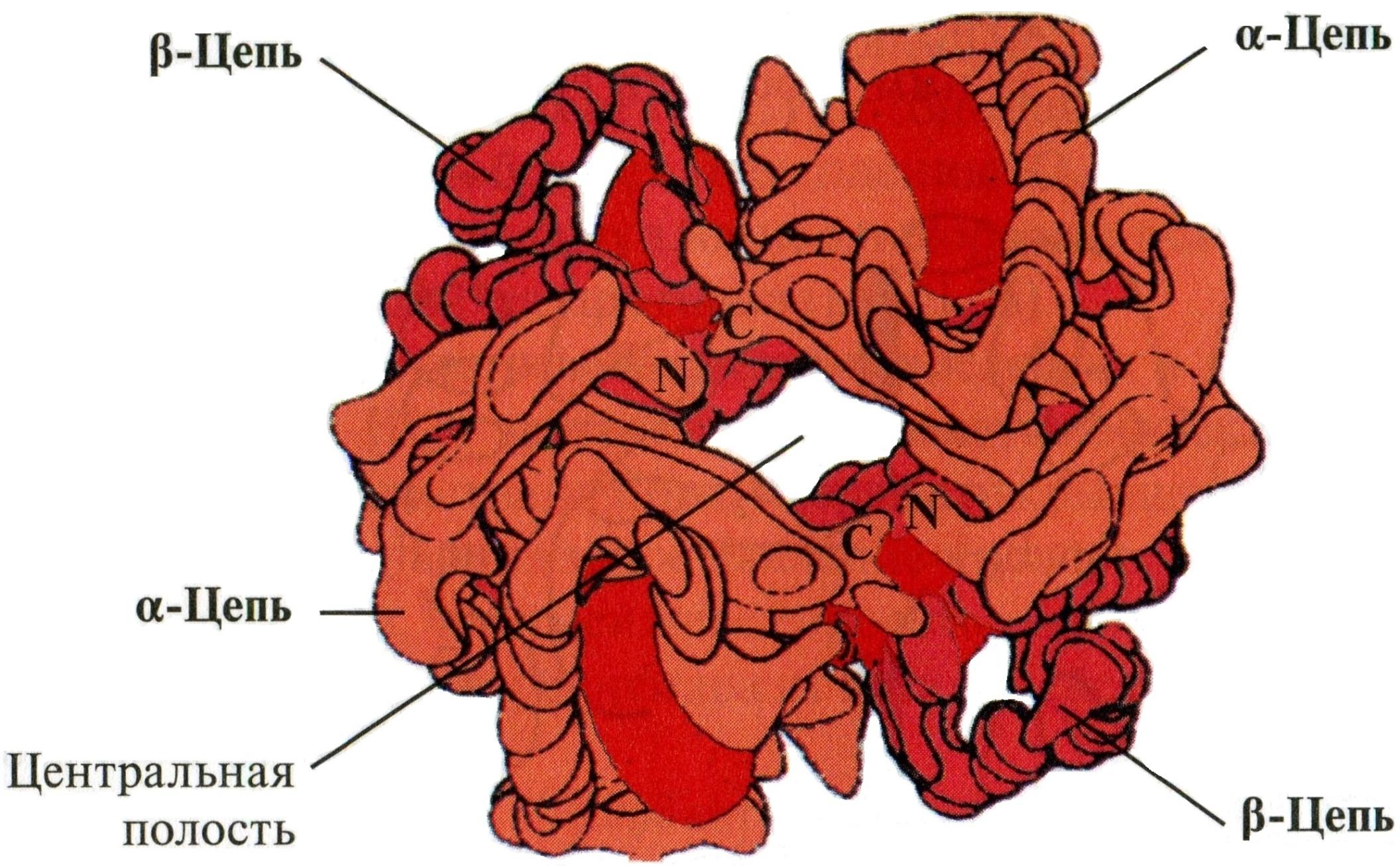
Все типы гемоглобина являются тетрамерами и содержат 2-цепи.
-
Гемоглобин A – 2- и 2-цепи. Составляет ~ 98% гемоглобина эритроцитов взрослого человека;
-
Гемоглобин A2 – 2- и 2-цепи. Составляет ~ 2% гемоглобина взрослого человека;
-
Гемоглобин эмбриональный – 2- и 2-цепи. Обнаруживается на ранних этапах развития плода;
-
Гемоглобин F – 2- и 2-цепи. Приходит на смену раннему гемоглобину плода на 6-м месяце развития;
На способность Hb отдавать O2 в тканях сильно влияет наличие регуляторов, к которым относятся H+, CO2 и 2,3-бифосфоглицерат (2,3-БФГ).
Эффект Бора
Основные функции гемоглобина:
-
транспорт O2 из легких в ткани;
-
транспорт CO2 и избытка H+ из тканей обратно в легкие.
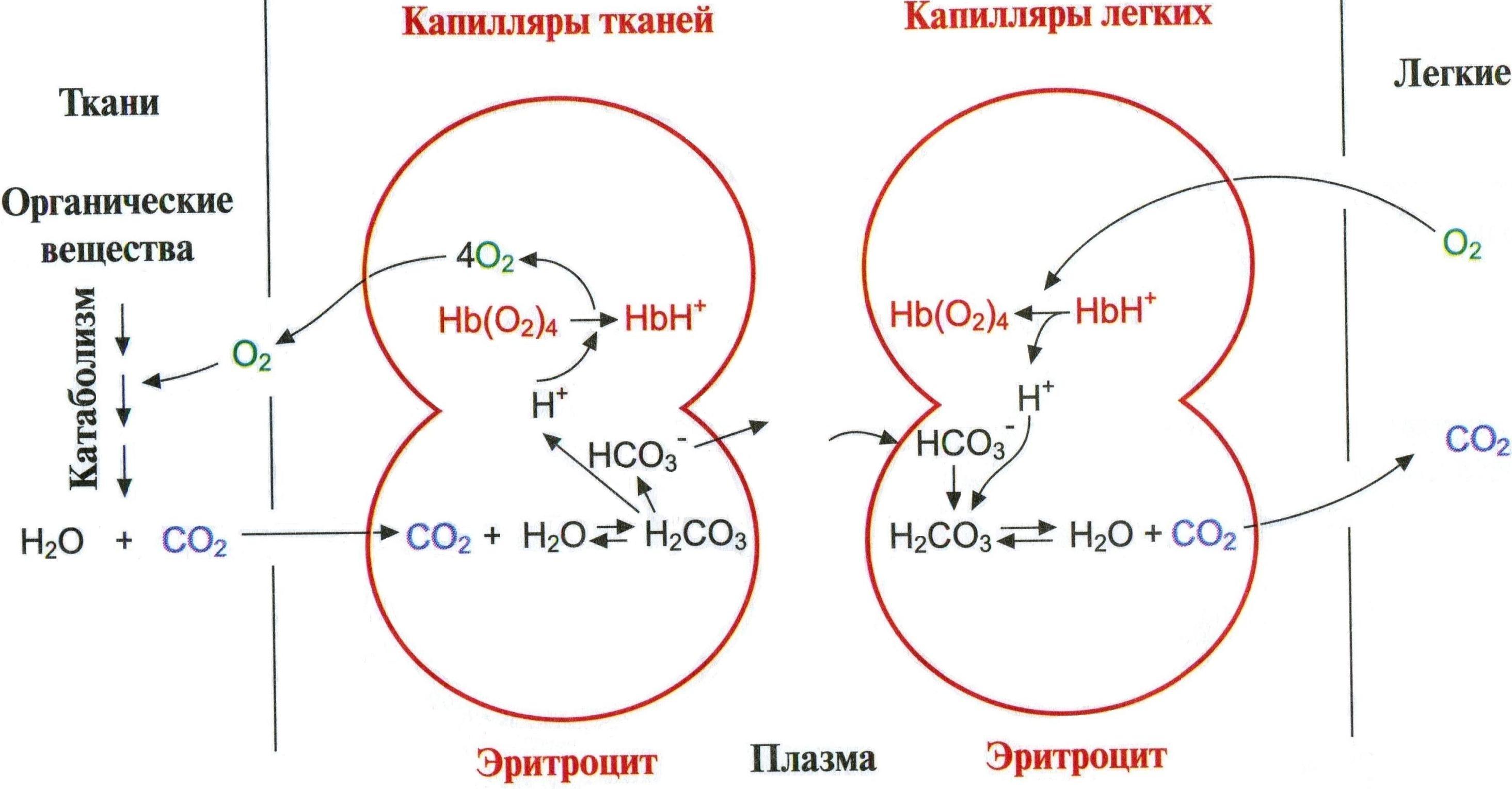
Эффект Бора – увеличение освобождения кислорода гемоглобином в зависимости от концентрации протонов.
Влияние 2,3-БФГ на сродство Hb к O2.

2,3-БФГ – вещество, которое синтезируется в эритроцитах из промежуточного продукта гликолиза – 1,3-бифосфоглицерата.
2,3-БФГ в норме присутствует в эритроцитах ~ в той же концентрации, что и Hb.
2,3-БФГ присоединяется к Hb в специальном участке (центральной полости), расположенном между 4 протомерами.
2,3-БФГ может присоединяться только к дезоксигемоглобину.

Олигомерная структура гемоглобина
(схема из малинового учебника):
В капиллярах легких, где высокое ПД O2 – Hb соединяется с O2 => происходит сужение полости между протомерами Hb, что приводит к вытеснению 2,3-БФГ из Hb.
И Hb практически не связан с 2,3-БФГ.
В капиллярах тканей, где ниже парциальное давление O2, 2,3-БФГ присоединяется к дезоксигемоглобину => его сродство к O2 => облегчается переход O2 в ткани.
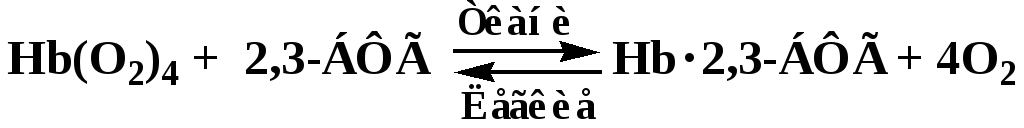
Концентрация 2,3-БФГ может увеличиваться при адаптации организма к гипоксии (высокогорье, обструктивная эмфизема легких).
Это снижает сродство Hb к O2 и увеличивает количество O2, транспортируемого в ткани.
2,3-БФГ присоединяется к Hb не в том участке, к которому присоединяется O2, а в другом.
Такой лиганд называется: аллостерический. Центр, к которому присоединяется аллостерический лиганд, называется: аллостерический центр.
Аллостерические белки:
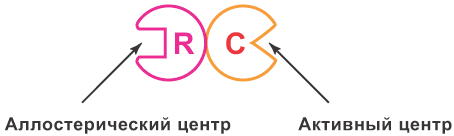
Аллостерические белки:
-
Олигомерные белки, состоящие из 2-х или более субъединиц – регуляторной и каталитической.
-
Имеют 2 пространственно разделенных центра, расположенные в разных субъединицах:
С – каталитическая субъединица.
Содержит активный центр, к которому присоединяется – главный лиганд белка.
R – регуляторная субъединица.
Содержит регуляторный (аллостерический центр), к которому присоединяется – лиганд-эффектор.
Эффекторы делятся на: активаторы (A) и ингибиторы (I).
Они влияют на сродство АЦ белка к его главному лиганду.
A – увеличивают сродство; I – уменьшают.
Физико-химические свойства белков:
-
Форма молекул;
-
Молекулярная масса;
-
Суммарный заряд;
-
Растворимость;
-
Изоэлектрическая точка
Растворимость белков зависит от суммарного заряда и общего количества полярных групп:
-
Растворимость белка тем больше, чем больше суммарный заряд.
-
Если у двух белков одинаковый суммарный заряд, то растворимость больше у того белка, у которого больше полярных групп.
Также на растворимость белков влияет pH среды, присутствие солей в растворе и др.
Изоэлектрическая точка белка (pI) – это такое значение pH, при котором суммарный заряд белка равен нулю.
В![]() изоэлектрической точке количество
положительно и отрицательно заряженных
групп белка одинаково.
изоэлектрической точке количество
положительно и отрицательно заряженных
групп белка одинаково.
Если суммарный заряд белка в нейтральной среде
т![]() о
pI
7.
о
pI
7.
Если суммарный заряд белка в нейтральной среде
т
= 0
Если суммарный заряд белка в нейтральной среде
то pI = 7.

 II
стр-ра: компактная глобула
II
стр-ра: компактная глобула лигомер:
2-цепи
и 2-цепи.
лигомер:
2-цепи
и 2-цепи.