
задачи термодинамика
.docx
2-50. Вычислите стандартную энтальпию реакции, протекающей в газовой фазе:
3СО + О3
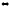 3СО2
3СО2
2-51. Вычислите стандартную энтальпию реакции
2СН3С1(г) + 3O2(г) 2СO2(г) + 2Н2О(ж) + 2НС1(г),
используя табличные значения стандартных энтальпий образования
веществ.
2-52. Вычислите стандартную энтальпию сгорания ацетона, воспользовавшись необходимыми для этого стандартными энтальпиями образования.
2-53. Вычислите стандартную энтальпию реакции, используя значения стандартных энтальпий сгорания
2С2Н5OН(ж)
 C2H5OC2H5(ж) + Н2O(ж)
C2H5OC2H5(ж) + Н2O(ж)
2-54. Вычислите стандартную энтальпию реакции, используя значения стандартных энтальпий сгорания
C2H6(г) + Н2(г) 2СН4 (г),
2-55. Вычислите стандартную энтальпию реакции, используя значения стандартных энтальпий сгорания
C2H2(г) + 2H2(г)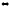 C2H6(г)
C2H6(г)
2-56. Вычислите стандартную энтальпию реакции, используя значения стандартных энтальпий сгорания
C6H5NO2(ж)
+ 3H2(г)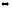 C6H5NH2(ж) +2Н2O(ж)
C6H5NH2(ж) +2Н2O(ж)
2-57. Вычислите стандартную энтальпию реакции, используя значения стандартных энтальпий сгорания
CO + 3H2
 CH4 + H2O (все газы)
CH4 + H2O (все газы)
2-58. Вычислите стандартную энтальпию реакции, используя значения стандартных энтальпий сгорания
C6H6(ж) + 3H2(г)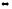 C6H12(ж)
C6H12(ж)
2-59. Вычислите стандартную энтальпию реакции, используя значения стандартных энтальпий сгорания
6СН4 + 4O2
 С2Н2 +8H2 + ЗСО + СО2
+ ЗН2O (все газы)
С2Н2 +8H2 + ЗСО + СО2
+ ЗН2O (все газы)
2-60. Вычислите стандартную энтальпию образования этанола, воспользовавшись необходимыми для этого стандартными энтальпиями сгорания.
2-61. Вычислите двумя способами (с использованием стандартных энтальпий образования и стандартных энтальпий сгорания) стандартную энтальпию гидрирования бензола (ж) до циклогексана(ж).
2-62. Вычислите двумя способами (с использованием стандартных энтальпий образования и стандартных энтальпий сгорания) стандартную энтальпию реакции каталитического окисления метана (г) до метанола (ж).
2-63. Вычислите количество теплоты, которое выделится при взрыве смеси, содержащей 5,6 л водорода и 22,4 л кислорода (объемы измерены при нормальных условиях).
2-64. Вычислите количество теплоты, которое выделится при полном окислении в организме 90 г глюкозы.
2-65. Вычислите количество теплоты, выделяющееся в реакции а) взаимодействия калия массой 3,9 г с водой; б) при окислении 1,12 л (н.у.)оксида углерода (II).
2-66. Какое количество теплоты потребуется для разложения карбоната кальция массой 2 кг?
2-67. Один сорт сметаны содержит в 100 г 15,0 г жиров, 2,9 г белка, 3,0 г углеводов; другой сорт – 25,0 г, 2,6 г и 2,7 г соответственно. Вычислите для каждого сорта сметаны массы, эквивалентные энергетической ценности 200 ккал (1 кал = 4,18 Дж).
2-68. Стандартная теплота образования CO(г) равна - 111 кДж/моль. При сгорании 1 моль СО выделяется 283 кДж теплоты. Не прибегая к другим справочным данным, вычислите стандартную энтальпию образования углекислого газа.
2-69. Вычислите стандартную энтальпию реакции :
S(тв)
+ O2(г)
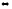 SO2(г),
используя данные:
SO2(г),
используя данные:
2S(тв)
+ 3O2(г)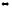 2SO3(г),
H
= -790 кДж/моль
2SO3(г),
H
= -790 кДж/моль
2SO2(г)
+ O2(г)
 2SO3(г),
H
= -196 кДж/моль
2SO3(г),
H
= -196 кДж/моль
2-70. Вычислите стандартную энтальпию реакции
4KClO3 (т) 3KClO4 (т) + KCl (т), используя значения Ho следующих реакций:
2KClO3 (т) 2KCl (т) + 3O2 (г); Ho = - 99 кДж/моль
KClO4 (т) KCl (т) + 2O2 (г); Ho = 33 кДж/моль
2-71. Стандартная энтальпия растворения сульфата меди равна -66,5 кДж/моль, стандартная энтальпия гидратации сульфата меди(П) до пентагидрата равна -78,22 кДж/моль. Вычислите стандартную теплоту растворения CuSO4∙5H2O.
2-72. Вычислите стандартную энтропию реакции
С2Н4(г)
+ Н2O(ж)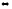 С2Н5ОН(ж)
С2Н5ОН(ж)
2-73. Вычислите стандартную энтропию реакции
2NH2CH2СООН(тв) NH2CH2СОNHCH2СООН(тв) + Н2O(ж)
2-74. Вычислите стандартные энтропии реакций хлорирования метана с образованием следующих продуктов: а) хлорметана; б) дихлорметана;
в) трихлорметана; г) тетрахлорметана; (все - в газообразном состоянии).
2-75. Вычислите, какая из четырех стадий хлорирования метана до тетрахлорметана характеризуется максимальным значением (по абсолютной величине )
а) стандартной энтальпии; б) стандартной энтропии.
2-76. Вычислите стандартную энтропию оксида бария, пользуясь только нижеприведенными значениями изменения энтропии:
BaO (т) + H2O (ж) Ba(OH)2 (т); So = - 79 Дж/(мольК)
2H2 (г) + O2 (г) 2H2O (ж); So = - 245 Дж/(мольК)
Ba (т) + H2 (г) + O2 (г) Ba(OH)2 (т); So = - 295 Дж/(мольК)
2-77. Вычислите стандартное изменение энергии Гиббса гликолиза:
C6H12O6(aq)
 2C3H6O3(aq)
2C3H6O3(aq)
2-78. Вычислите стандартное изменение энергии Гиббса каталитического окисления этанола в присутствии каталазы:
Н2O2(ж) +
С2Н5OН(ж)
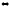 СН3СОН(г) + 2Н2O(ж)
СН3СОН(г) + 2Н2O(ж)
2-79. Вычислите стандартное изменение энергии Гиббса реакции
СН3С(О)СОО-(пируват-ион)
(ж) + Н+
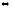 СН3С(О)Н(г) + CO2(г)
СН3С(О)Н(г) + CO2(г)
2-80. Вычислите стандартное значение энергии Гиббса образования сероуглерода CS2 (ж), используя справочные данные и значение Go реакции
CS2 (ж) + 3O2 (г) CO2 (г) + 2SO2 (г); Go = - 930 кДж/моль.
2-81. Вычислите стандартное значение энергии Гиббса гидратации -лактоглобулина при 25 С, для которого Н = -6,75 кДж/моль и S = -9,74 Дж/(мольК). Оцените вклад энтальпийного и энтропийного факторов.
2-82. Вычислите стандартное значение энергии Гиббса тепловой денатурации химотрипсиногена при pH 2 и 50 С, для которого Н = +417 кДж/моль и S = + 1,32 кДж/(мольК). Оцените вклад энтальпийного и энтропийного факторов.
2-83. Вычислите стандартное значение энергии Гиббса гидратации сывороточного альбумина при 25 С, для которого Н = -6,08 кДж/моль и S = -5,85 кДж/(мольК). Оцените вклад энтальпийного и энтропийного факторов.
2-84.Оцените роль энтропийного и энтальпийного факторов для реакции:
4НС1(г) + О2(г) 2С12(г) + 2Н2O (ж).
Возможно ли самопроизвольное протекание этой реакции? Если да, то при каких (низких, высоких, любых) температурах?
2-85. Оцените роль энтропийного и энтальпийного факторов для реакции:
Н2O2(ж) + О3(г) 2O2(г) + Н2O(ж). Возможно ли самопроизвольное протекание этой реакции? Если да, то при каких (низких, высоких, любых) температурах?
2-86. Константа равновесия реакции тепловой денатурации химотрипсиногена при pH 2 и 50 С равна 32,7. Вычислите значение стандартной энтальпии процесса, если известно, что S = +1,32 кДж/(мольК).
2-87. Константа равновесия реакции гидратации сывороточного альбумина при 25 С равна 1,19. Вычислите значение стандартной энтропии процесса, если известно, что Н = -6,08 кДж/моль.
2-88. Вычислите G° реакции гидратации яичного альбумина при 25 C, если для этого процесса H = -6,58 кДж/моль; S° = -9,5 Дж/(мольК). Оцените роль энтальпийного и энтропийного факторов.
2-89. Для некоторой реакции при 227 °С H = - 50 кДж/моль, а S = - 100 Дж/(мольК). Вычислите константу равновесия реакции при указанной температуре.
2-90. Для нижеприведенной реакции рассчитайте G при 298 К;
вычислите температуру, при которой оба направления процесса равновероятны.
2NO2(г)
 N2O4(г), Н
= -57 кДж/моль; S
= -176 кДж/(мольК).
N2O4(г), Н
= -57 кДж/моль; S
= -176 кДж/(мольК).
2-91. Рассчитайте температуру, при которой равновероятны оба направления реакции синтеза аммиака из азота и водорода.
2-92. Рассчитайте температуру, при которой равновероятны оба направления реакции каталитического окисления оксида серы(IV) кислородом до оксида серы(VI).
2-93. Сделайте заключение о практической обратимости реакции в стандартном состоянии, рассчитав константу равновесия при 310 К для гидролиза сложноэфирной связи; G = -10,48 кДж/моль.
2-94. Сделайте заключение о практической обратимости реакции в стандартном состоянии, рассчитав константу равновесия при 310 К для переноса ацетильной группы при гидролизе ацетилкофермента А, G = -34,36 кДж/моль.
2-95. Сделайте заключение о
практической обратимости реакции в
стандартном состоянии, рассчитав
константу равновесия при 310 К для реакции
АТФ + АМФ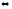 2АДФ, G
= -2,10 кДж/моль.
2АДФ, G
= -2,10 кДж/моль.
2-96. Сделайте заключение о
практической обратимости реакции в
стандартном состоянии, рассчитав
константу равновесия при 310 К для
реакции креатин + фосфат
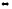 креатинфосфат + H2O ; G
= +29,33 кДж/моль.
креатинфосфат + H2O ; G
= +29,33 кДж/моль.
2-97. Сделайте заключение о практической обратимости реакции в стандартном состоянии, рассчитав константу равновесия при 310 К для дегидратации лимонной кислоты с образованием цис-аконитовой кислоты , G = +8,36 кДж/моль.
2-98. Сделайте заключение о практической обратимости реакции в стандартном состоянии, рассчитав константу равновесия при 310 К для гидратации цис-аконитовой кислоты с образованием изолимонной кислоты , G = -1,68 кДж/моль.
2-99. Константа равновесия реакции
N2O4
(г)
 2NO2 при 25 С
равна 4,64·10-3. В каком направлении
будет идти реакция при следующих
концентрациях веществ:
2NO2 при 25 С
равна 4,64·10-3. В каком направлении
будет идти реакция при следующих
концентрациях веществ:
а) с(NO2) = 0,05 моль/л; с(N2O4) = 0,2 моль/л
б) с(NO2) = 0,1 моль/л; с(N2O4) = 0,05 моль/л
2-100. Константа равновесия
реакции PCl5(г)
 PCl3(г) + Cl2(г) при 250 С
равна 2. В каком направлении идет реакция
при следующих концентрациях: с(PCl3)
= c(PCl5) = 1 моль/л; с(Cl2) = 2 моль/л?
PCl3(г) + Cl2(г) при 250 С
равна 2. В каком направлении идет реакция
при следующих концентрациях: с(PCl3)
= c(PCl5) = 1 моль/л; с(Cl2) = 2 моль/л?
2-101. Определите направление реакции Н2 + I2 = 2НI ( все газы) при 298 К при следующих концентрациях:
а) с(Н2) = с(I2) = 0,01 моль/л; c(НI) = 1,0 моль/л
б) с(Н2) = с(I2) = 0,1 моль/л; c(НI) = 0,01 моль/л
2-102. При 300 К константа равновесия реакции трансаминирования:
L-глутаминовая кислота +
пировиноградная кислота
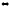
2-оксоглутаровая кислота + L-аланин
равна 1. В каком направлении будет идти реакция при следующих концентрациях; L-глутаминовая кислота и пируват по 0,00003 моль/л, 2-оксоглутаровая кислота и L-аланин по 0,005 моль/л ?
2-103. Константа равновесия реакции этерификации, протекающей между этанолом и уксусной кислотой, при 25 С равна 4. В каком направлении будет идти реакция при следующих концентрациях веществ:
а) с(вода) = с(эфир) = 2 моль/л; с (кислота) = 1 моль/л; с(спирт) = 0,05 моль/л;
б) с(вода) = с(эфир) = с(кислота) = 2 моль/л; с(спирт) = 4 моль/л;
2-104. Для реакции синтеза аммиака из простых веществ равновесные концентрации при некоторой температуре равны: аммиака 4 моль/л, азота 3 моль/л, водорода 9 моль/л. Каким будет направление процесса при концентрациях всех реагентов, равных 5 моль/л.
2-105. При температуре 800 °C равновесные концентрации оксида серы(IV), кислорода и оксида серы(VI) составили 3 ммоль/л, 3,5 ммоль/л и 50 ммоль/л соответственно. При этой же температуре смешали в объеме 2 л по 0,05 моль каждого вещества. Увеличится или уменьшится концентрация оксида серы(VI) в системе по достижении состояния равновесия?
