
Министерство здравоохранения и социального развития РФ
ГОУ ВПО Первый МГМУ им. И.М.Сеченова
кафедра общей и неорганической химии.
Реферат на тему:
p-элементы V A-группы периодической системы Д.И.Менделеева.
Выполнила: Настуева С.Х,
студентка 13 группы 1 курса
фармацевтического факультета
Москва
2011г.
-
Введение…………………………………….............3-4
-
Азот…………………………………………………………..5-25
-
Химические свойства………………….5
-
Физические свойства…………………..6
-
Соединения азота……………………….7-25
-
Применение……………………………….25
-
Фосфор……………………………………………………..26-34
-
Химические свойства………………….27
-
Физические свойства…………………..28
-
Соединения фосфора………………….29-33
-
Применение………………………………..34
-
Подгруппа мышьяка…………………………………35-52
-
Применение мышьяка, сурьма, висмут….53
-
Список использованной литературы………54
Введение.
В V A-группу периодической системы Д.И. Менделеева входят азот, фосфор, мышьяк, сурьма, висмут.
Азот N 1s2 2s2 2p3
Фосфор P 2s2 2p6 3s2 2p3
Мышьяк As 3s2 3p6 3d10 4s2 4p3
Сурьма Sb 4s2 4p6 4d10 5s2 5p3
Висмут Bi 4s2 4p6 4d10 4f14 5s2 5p6 5d10 6s2 6p3
Азот и фосфор относят к типичным элементам, а мышьяк, сурьму и висмут объединяют в подгруппу мышьяка. Основные константы p-элементов V группы приведены ниже:
Полными электронными аналогами являются As, Sb и Bi их атомы имеют одинаковую электронную конфигурацию внешнего n слоя и предыдущей (n-1)d оболочки. Однако потенциалы ионизации I5 столь велики, что простые ионы Э5+ для всех элементов главной подгруппы V-ой группы не существуют. Поэтому химические свойства Р, As, Sb и Bi определяются только строением внешнего электронного слоя. Три неспаренных электрона в основном и пять в валентно-возбуждённом состояниях позволяют этим элементам проявлять валентности III и V. Благодаря ns2-электронной паре и вакантному nd-подуровню валентность элементов может быть также IV и VI. У сурьмы и висмута в комплексных соединениях в виду больших размеров их атомов валентность может достигать VII и VIII, например, во фторидных комплексах K2[SbF7] и K3[BiF8].
Из-за отсутствия d-подуровня атом азота не может иметь возбуждённого состояния с пятью неспаренными электронами, поэтому его валентность в соединениях не превышает IV. Химические свойства азота очень сильно отличаются от свойств других элементов группы. Его малые по размеру валентные s- и p-орбитали способны образовывать гибридные sp3-, sp2- и sp-орбитали с высокой электронной плотностью. При этом, незадействованные в гибридизации р-орбитали, как и в случае атома углерода, могут участвовать в создании прочных -связей с атомами лёгких элементов (B, C, O, N), т.е. двойных и тройных связей. В ряде соединений -связи упрочняются за счёт почти полного перехода одного из s-электронов атома азота на соседний атом. Такое состояние азота с четырьмя неспаренными электронами можно обозначить как N+. Азот N+ способен образовывать четыре двухэлектронные связи по обменному механизму с атомами O, C и N, например, в НNO3, HN3, HCNO и др., где степень окисления азота формально +5. Соединения азота(+5) отличаются по химическим свойствам от аналогичных соединений фосфора и мышьяка.
Высокие значения электроотрицательности элементов (табл.1) позволяют объяснить отрицательные степени окисления в соединениях с более электроположительными элементами, и положительные степени окисления в соединениях с более электроотрицательными элементами:
N -3, -2,-1, 0, +1, +2, +3, +4, +5;
P -3, -2, 0, +1, +3, (+4), +5;
As -3, 0, +3, +5;
Sb, Bi -3, 0, +3, (+4), +5.
Устойчивость соединений в низших степенях окисления падает в группе от азота к висмуту, а устойчивость соединений в степени окисления +5 уменьшается при переходе от фосфора, как к азоту, так и к висмуту. Соединения азота(+5) и висмута(+5) сильные окислители.
|
|
7N |
15P |
33As |
51Sb |
83Bi |
|
Атомная масса |
14,01 |
30,97 |
74,92 |
121,75 |
208,98 |
|
Валентные электроны |
2s22p3 |
3s23p3 |
4s24p3 |
5s25p3 |
6s26p3 |
|
Атомный радиус: металлический, нм
ковалентный, нм |
0,071
0,070 |
0,13
0,110 |
0,148
0,118 |
0,161
0,136 |
0,182
0,146 |
|
Условный радиус
Иона Э3-, нм
Иона Э5+, нм |
0,148
0,015 |
0,186
0,035 |
0,192
0,047 |
0,208
0,062 |
0,213
0,074 |
|
Энергия ионизации Э0→Э+, эВ |
14,53 |
10,484 |
9,81 |
8,639 |
7,287 |
|
Содержание в земной коре, % (мол. доли) |
0,25 |
0,05 |
1,5*10-4 |
5*10-6 |
1,7*10-6 |
|
Природные изотопы |
14N (99,64%) 15N (0,36%) |
31P (100%) |
75As (100%) |
121Sb (57,3%) 123Sb (42,7%) |
209Bi (100%) |
Азот
Азот (1s2 2s2 2p3)-типичный неметаллический элемент, по электроотрицательности (3,0) уступает лишь фтору и кислороду. Степени окисления в соединениях -3, -1, +1, +3, +5, а также -2, +2 и +4.
Природный азот состоит из двух устойчивых изотопов: 14N (99,635%) и 15N (0, 365%).
Содержание азота на Земле составляет 0,03% (мол. доли). Основная масса его входит в состав атмосферы [78% (об. доли)] в виде простого вещества. Из минералов промышленное значение имеют чилийская NaNO3 и индийская KNO3 селитры. Азот входит в состав белковых тел всех растительных и животных организмов, обнаружен в газовых туманностях и солнечной атмосфере, на Уране и Нептуне и др.
Простое вещество азот (диазот) N2, бесцветный газ (tкип=195,80С, tпл.=2100С), без запаха и вкуса, малорастворимый в воде (23 мл в 1 л холодной воды). Молекула азота двухатомная энергетическая диаграмма молекулярных орбиталей представлена на рис.1.
Как видно из рис. 1, кратность связи в молекуле N2 равна . Энтальпия тройной связи составляет 940,5 кДж/моль. Это одна из самых прочных молекул. Жидкий и твёрдый азот также построен из молекул N2, связанных силами Ван-дер-Ваальса.
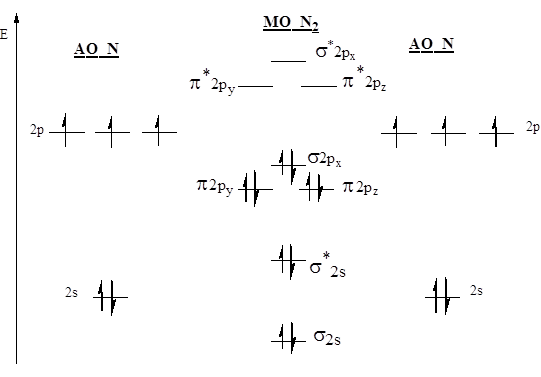
Рис.1 Энергетическая диаграмма молекулярных орбиталей молекулы N2.
Наличие вакантных -разрыхляющих орбиталей определяет -акцепторную способность азота, проявляющуюся в образовании комплексных соединений, например, [Ru(N2)(NH3)5]2+ , [Ru2(-N2)(NH3)10]4+. В этих комплексах молекула N2 является лигандом. Неподелённая пара электронов азота образует донорно-акцепторную -связь, а заполненные d-орбитали иона металла участвуют в образовании -дативной связи с вовлечением -разрыхляющих орбиталей молекулы азота. Таким образом, кратность связи металла с N2 может быть равной 2 и даже 3.
Прочность и неполярность молекулы N2, близость энтальпии ионизации молекулы (1402 кДж/моль) к энтальпии ионизации аргона объясняют её химическую инертность по отношению к многим веществам. В обычных условиях азот используют для создания инертной атмосферы вместо более дорогих благородных газов. Азот проявляет очень слабые восстановительные и окислительные свойства (энергия сродства к электрону 3,6 эВ). При комнатной температуре он реагирует только с литием. В случае инициирования реакций нагреванием, электрическим разрядом или ионизирующими излучениями, а также в присутствии катализаторов, азот взаимодействует с сильными окислителями и восстановителями:
N2 + O2 2NO (в электрическом разряде),
N2 + 6Li 2Li3N (при обычной температуре),
N2 + 2Ti 2TiN (при t=12000С),
N2 + 3H2 2NH3 (при 4005000С, катализатор).
В промышленности азот получают фракционной перегонкой жидкого воздуха, а в лаборатории термическим разложением нитрита аммония или нагреванием смеси насыщенных растворов нитрита натрия и хлорида аммония:
NH4NO2 N2 + 2H2O,
NaNO2 + NH4Cl N2 + NaCl + 2H2O.
Особо чистый азот получают разложением азида натрия при t=2750C:
2NaN3 2Na + 3N2.
Азот используется главным образом для получения аммиака, а также в качестве инертного газа в системах, где отсутствуют сильные восстановители или растворы комплексов переходных металлов. Жидкий азот широко используется для создания низких температур 1950С, при обезвреживании взрывных устройств и для тушения особых категорий пожаров.
Соединения азота (-III). При высоких температурах азот окисляет многие металлы и неметаллы, образуя н и т р и д ы:
3Mg + N2 = Mg3N2; 2B + N2 = 2BN; 3H2 + N2 = 2H3N
Свойства нитридов более или менее закономерно изменяются по периодам и группам периодической системы. Например, в малых периодах наблюдается переход от основных нитридов к кислотным:
Na3N, Mg3N2 AlN Si3N4, P3N5, S4N4, Cl3N
основные амфотерный кислотные
Нитриды s-элементов I и II групп, например Li3N и Mg3N2, - кристаллические вещества. Химически они довольно активны. Например, легко разлагаются водой, образуя щелочь и аммиак:
Li3N + 3HOH = 3LiOH + H3N
основный
Нитриды галогенов – эндотермические соединения. В свободном состоянии выделен лишь жидкий Cl3N (ΔHof = 229 кДж/моль), легко разлагающийся со взрывом. По химической природе это кислотное соединение:
Cl3N + 3H2O = 3 HClO + H3N
Нитриды BN, AlN и Si3N4, Mo2N – твердые полимерные вещества с высокими температурами плавления (2000-3000O С); они либо диэлектрики, либо полупроводники.
Но самыми основными соединениями азота, в которых он проявляет отрицательные степени окисления, являются
-3 -2 -1
аммиак (NH3), гидразин (N2H4), гидроксиламин (NH2OH)
и их многочисленные неорганические и органические производные.
В указанных соединениях атомные орбитали атома азота, с учётом электронной пары на 2s-орбитали, находятся в sp3-гибридном состоянии, что определяет геометрическое строение молекул, их полярность и донорные свойства:
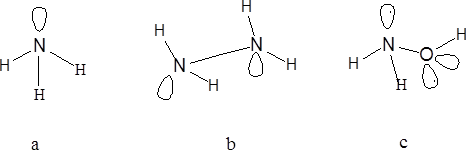
Рис.2 Геометрическая форма молекул: a – аммиак, b – гидразин, с – гидроксиламин.
Пирамидальная молекула аммиака (рис.2а) обладает высокой полярностью (-=1,46 D). Несвязывающая электронная пара и полярность связи N-H обуславливают образование между молекулами водородных связей. Поэтому, в виду малой молекулярной массы (17 а.е.м.), аммиак при обычных условиях - газ, но он имеет сравнительно высокие температуры плавления (-77,750С) и кипения (-33,350С), а также легко сжижается. Аммиак имеет характерный резкий запах.
Строение молекулы гидразина (рис.2b) сходно со строением молекулы пероксида водорода. По аналогии с H2O2, N2H4 называют пернитридом. За счёт вращения NH2-групп вокруг связи N-N возможно существование конформационных изомеров. Однако высокое значение дипольного момента (=1,85 D) для молекулы N2H4 свидетельствует в пользу цис-формы (рис.2b). Между сильно полярными молекулами возникают прочные водородные связи. В обычных условиях гидразин - бесцветная маслянистая жидкость (tпл.=1,50С, tкип.=113,50С), с запахом, напоминающим запах аммиака. При нагреве может взрываться, так как имеет положительную энтальпию образования (+55 кДж/моль).
Гидроксиламин можно рассматривать как продукт замещения атома водорода в молекуле аммиака на ОН-группу. Из-за наличия в молекулах атома кислорода между ними возникают водородные связи ещё более прочные, чем в аммиаке и гидразине, поэтому NH2OH при обычных условиях белое кристаллическое вещество (tпл.=330С, tкип.=580С при 22 мм рт. ст.). Гидроксиламин очень гигроскопичен, при нагревании взрывается.
Аммиак, гидразин и гидроксиламин очень хорошо растворимы в воде 700 л NH3 растворяются в 1л воды при 200С, а N2H4 и NH2OH смешиваются с водой неограниченно. Столь высокая растворимость объясняется образованием водородных связей между молекулами веществ и молекулами воды, вплоть до образования гидратов. За счёт неподелённых электронных пар на атомах азота NH3, N2H4 и NH2OH проявляют основные свойства, причём гидразин является двукислотным основанием:
NH3 + H2O NH3H2O OH + NH4+ (аммоний) Kb=1,8105,
N2H4 + H2O N2H4H2O OH + N2H5+ (гидразиний(+1)) Kb1=8,5107,
N2H5+ + H2O OH + N2H62+ (гидразиний(+2)) Kb2=8,91016,
NH2OH + H2O NH2OHH2O OH + NH3OH+ (гидроксиламиний) Kb=7109.
Гидразин можно рассматривать как производное аммиака, в котором атом водорода замещён на группу NH2. Поскольку электроотрицательность этой группы выше, чем у водорода, основные свойства гидразина по сравнению с аммиаком ниже. У гидроксиламина основные свойства ниже, чем у гидразина, так как электроотрицательность группы ОН больше, чем группы NH2.
Аммиак, гидразин и гидроксиламин реагируют с кислотами, образуя соли:
NH3 + HCl NH4Cl (хлорид аммония),
N2H4 + HCl N2H5Cl (хлорид гидразиния(+1)),
N2H4 + 2HCl [N2H6]Cl2 (хлорид гидразиния(+2)),
NH2OH + HCl [NH3OH]Cl (хлорид гидроксиламиния).
Почти все соли растворимы в воде, а ионы NH4+, N2H5+, NH3OH+ подвергаются гидролизу, создавая, кислую среду:
NH4+ + H2O NH3 + H3O+,
N2H5+ + H2O N2H4 + H3O+,
[NH3OH]+ + H2O NH2OH + H3O+.
Неподелённые электронные пары на атомах азота в аммиаке, гидразине и гидроксиламине объясняют их лигандные свойства при образовании комплексных соединений: [Ag(NH3)2]+, [Pt(NH3)2Cl2], [Rh2(-N2H4)2(CN)5], [Pt(NH2OH)4]2+. Следует отметить, что гидразин, имея два донорных атома азота, часто выступает в роли мостикового лиганда. Гидроксиламин, хотя и имеет неподелённые пары на атоме кислорода, является монодентантным лигандом за счёт донорного атома азота. Гидроксиламиновые и, особенно гидразиновые комплексы, склонны к внутримолекулярным окислительно-восстановительным превращениям. Лиганд восстанавливает центральный атом, как правило, до металла.
При координации к ионам металлов у молекул NH3, N2H4 и NH2OH ослабевают основные свойства и усиливаются кислотные, например, амминокомплекс платины(+4) при взаимодействии со щелочами превращается в амидокомплекс:
[Pt(NH3)5Cl]Cl3 + NaOH [Pt(NH3)4(NH2)Cl]Cl2 + NaCl + H2O.
При вхождении молекулы аммиака в комплекс её электронная пара вовлекается в химическую связь с ионом металла, и NH3 теряет основные свойства. Проявление же кислотных свойств является следствием кулоновского отталкивания протонов молекулы NH3 от положительно заряженного иона металла.
Жидкий аммиак и гидразин являются сильно ионизирующими растворителями. Собственная ионизация этих растворителей меньше, чем в случае воды:
NH3 + NH3 NH4+(s) + NH2–(s) Кs =10–33,
N2H4 + N2H4 N2H5+(s) + N2H3–(s) Кs =210–25,
H2O + H2O H3O+(р) + OH–(р) Кs Kw =1,810–16.
При этом в жидком аммиаке производные иона NH4+, например, NH4Cl, ведут себя как сильные кислоты, а производные иона NH2–, например, NaNH2 – как сильные основания. Аммонооснования и аммонокислоты в жидком аммиаке вступают в реакцию нейтрализации:
NH4Cl + NaNH2 2NH3 + NaCl.
Жидкий аммиак – сильный акцептор протонов, поэтому многие слабые кислоты диссоциируют в нём нацело, например, уксусная кислота. В жидком аммиаке протекают реакции аналогичные гидролизу (аммонолиз):
SnCl4 + 8NH3 (жидк) Sn(NH2)4 + 4NH4Cl,
SO2Cl2 + 4NH3 (жидк) SO2(NH2)2 + 2NH4Cl,
для сравнения:
SnCl4 + 4H2O Sn(OH)4 + 4HCl,
SO2Cl2 + 2H2O (HO)2SO2 + 2HCl.
Активные металлы реагируют с жидким аммиаком так же, как и с водой:
2Na + 2NH3 (жидк) Н2 + 2NaNH2 (амид натрия),
Zn + 2NH4Cl + 2NH3 (жидк) Н2 + [Zn(NH3)4]Cl2,
для сравнения:
Аммиак, гидразин и гидроксиламин проявляют восстановительные свойства и окисляются чаще всего до азота:
4NH3 + 3O2 2N2 + 6H2O,
N2H4 жид + O2 N2 + 2H2O жид.+ 622 кДж/моль.
Большое количество теплоты, выделяющееся при горении гидразина и его органических производных, позволяет использовать эти соединения как компоненты ракетного топлива. В присутствии металлической платины аммиак горит с образованием монооксида азота:
4NH3 + 5O2 4NO + 6H2O.
Гидроксиламин и его соли также используют в качестве эффективных восстановителей:
2NH2OH + I2 + 2KOH N2 + 2KI + 4H2O,
но они способны и окислять Fe(II) до Fe(III), восстанавливаясь до NH3 или NH4+:
2[NH3OH]Cl + 4FeSO4 + 2H2SO4 2Fe2(SO4)3 + 2NH4Cl + 2H2O.
Безводные гидразин и гидроксиламин при нагревании диспропорционируют с образованием аммиака и диазота:
3N2H4 N2 + 4NH3, 3NH2OH N2 + NH3 + 3H2O.
Аммиак при высоких температурах также разлагается на азот и водород, однако этот процесс является реакцией внутримолекулярного окисления-восстановления:
2NH3 N2 + 3H2.
Соли аммония термически неустойчивы. Соли кислот-неокислителей при нагревании обратимо разлагаются на аммиак и кислоту (или ангидрид кислоты и воду):
NH4Cl NH3 + HCl, (NH4)2CO3 2NH3 + CO2 + H2O.
Соли кислот-окислителей претерпевают внутримолекулярное окисление-восстановление и разлагаются необратимо:
2(NH4)2CrO4 Cr2O3 + N2 + 2NH3 + 5H2O,
2NH4ClO3 Cl2 + O2 + N2 + 4H2O.
