Лекция 5
.docxЛекция №5
РЕАЛЬНЫЕ ГАЗЫ
Основные понятия
Различные фазы вещества представляют собой различные агрегатные состояния (газообразное, жидкое, кристаллическое) и их аллотропические разновидности.
Характерная особенность фаз наличие границ, отделяющих данную фазу от соприкасающихся с ней других фаз. При определенных условиях различные агрегатные состояния чистого вещества и различные его аллотропические модификации могут сосуществовать друг с другом в равновесии, образуя единую термодинамическую систему.
Эта система является гетерогенной, а отдельные ее гомогенные части представляют собой фазы. При этом каждая из фаз является однородной системой с одинаковыми физическими свойствами во всех ее частях. Система, состоящая из двух или более фаз, называется многофазной.
В многофазной системе вещество может переходить из одной фазы в другую через границу раздела фаз. Переход вещества из одной фазы в другую называется фазовым переходом. Фазовый переход при заданном давлении происходит при определенной температуре, то есть р=f(Т), и сопровождается поглощением или выделением теплоты, которая называется теплотой фазового перехода.
Переход вещества из твердого состояния в жидкое называется плавлением, обратный процесс затвердеванием (или кристаллизацией), переход из твердого в газообразное сублимацией (или возгонкой), обратный процесс десублимацией; переход из жидкого состояния в газообразное парообразованием, из газообразного в жидкое – конденсацией.
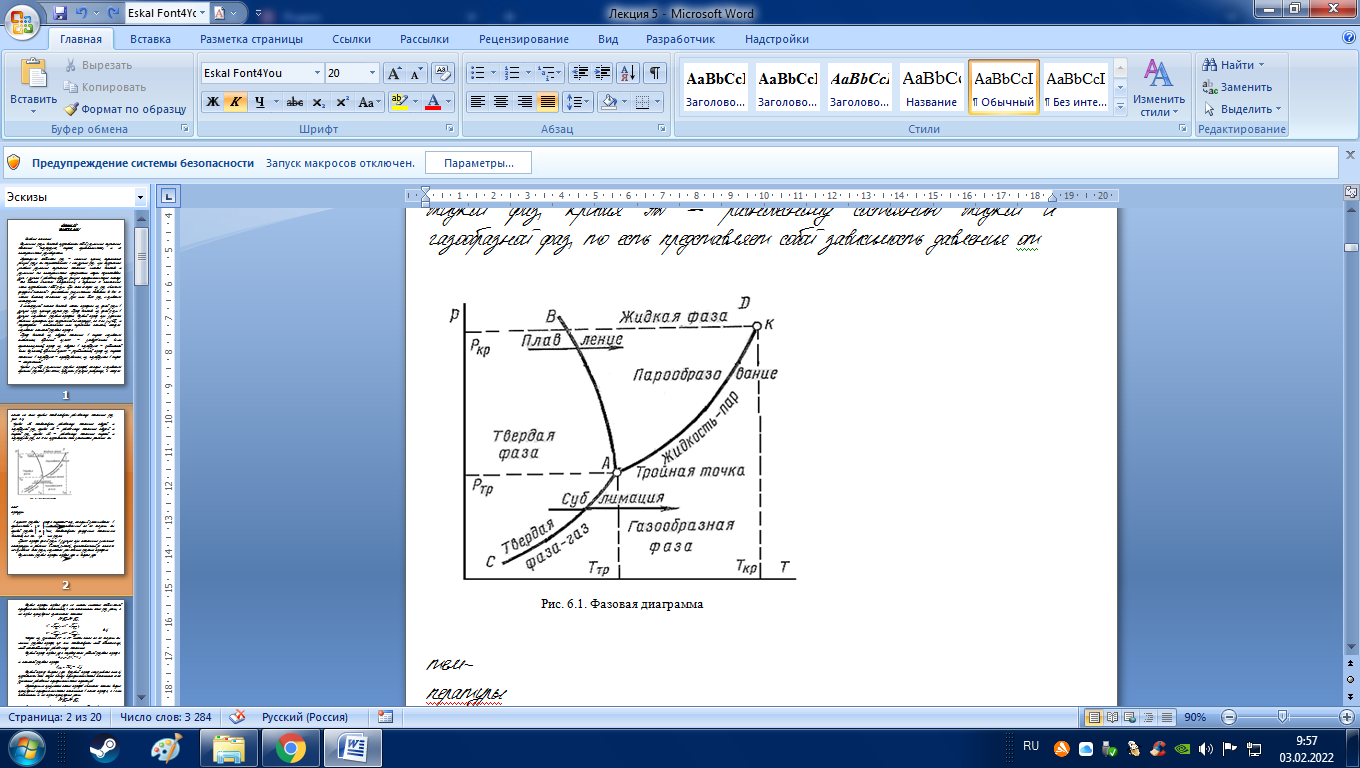
Кривые р=f(Т) различных фазовых переходов, которые называются кривыми фазового равновесия, образуют фазовую диаграмму, а каждая точка на этих кривых соответствует равновесному состоянию фаз (рис. 6.1).
Кривая АС соответствует равновесному состоянию твердой и газообразной фаз, кривая АВ – равновесному состоянию твердой и жидкой фаз, кривая АД – равновесному состоянию жидкой и газообразной фаз, то есть представляет собой зависимость давления от
Температуры
|
в процессе фазового перехода жидкость–пар, который заканчивается в критической точке К. Точки, расположенные по обе стороны от кривой фазового равновесия, соответствуют однородным состояниям вещества, то есть отдельным фазам.
|
Процесс перехода одной фазы в другую при постоянных значениях температуры и давления (T=const, p=const), осуществляемый до полного исчезновения этой фазы, называется равновесным фазовым переходом.
Различают фазовые переходы первого рода и второго рода.
Фазовые переходы первого рода не имеют никаких особенностей термодинамического потенциала, в ней потенциалы обеих фаз равны, а их первые производные изменяются скачком: F(1)(p,T)=F (2)(p,T),
 (6.1)
(6.1)
Каждая из функций F(1) и F(2) имеет смысл по обе стороны от линии фазового перехода, где они соответствуют либо абсолютному, либо метастабильному равновесному состоянию.
Фазовый переход первого рода сопровождается работой фазового перехода
L1-
2=
p(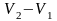 )
и теплотой фазового перехода Q1-2
=
T(S2
–
S1).
)
и теплотой фазового перехода Q1-2
=
T(S2
–
S1).
Фазовый переход второго рода (фазовый переход непрерывного типа) представляет собой особую точку термодинамического потенциала как функцию равновесных термодинамических параметров.
Характерным признаком таких переходов являются скачки вторых производных термодинамического потенциала в точке перехода, а сами потенциалы и их первые производные равны F(1)(p,T)=F(2)(p,T),
Для таких фазовых переходов теплота и работа равны нулю.
Как видно из формулы (6.1), при фазовом переходе первого рода, к числу которых относится фазовый переход жидкостьпар, удельные объемы жидкости и пара различны. Но на кривой фазового равновесия жидкостьпар есть конечная точка, в которой удельные объемы и энтропии обеих фаз становятся одинаковыми (равными). Эта точка называется критической точкой, а фазовые переходы в этой точке относятся к фазовым переходам второго рода.
 (6.2)
(6.2)
Рассмотрим подробнее фазовый переход жидкость–пар на примере воды и водяного пара, так как водяной пар широко используется во многих областях промышленного производства. Вода и водяной пар применяются как рабочее тело в паровых машинах, паровых турбинах, атомных установках, как теплоноситель в различных теплообменных аппаратах.
Процесс перехода вещества из жидкого состояния в газообразное называется парообразованием. Парообразование, которое происходит со свободной поверхности жидкости при любой температуре, называется испарением. Парообразование, происходящее в основном в объеме самой жидкости за счет испарения ее внутрь пузырьков пара, называется кипением.
Если парообразование происходит в закрытом сосуде, то может наступить такое состояние, когда количество молекул, вылетающих из жидкости, будет равно количеству молекул, возвращающихся обратно в жидкость. В этом состоянии в сосуде над жидкостью будет находиться максимально возможное при данных условиях количество молекул. Пар в этом состоянии будет иметь максимальную плотность и называться насыщенным.
Насыщенный пар, в котором отсутствуют мелкодисперсные частицы жидкой фазы, называется сухим насыщенным, а насыщенный пар, в котором содержатся взвешенные мелкодисперсные частицы жидкости влажным насыщенным.
Массовая доля сухого насыщенного пара во влажном паре, называется степенью сухости x:
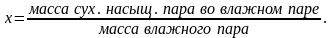
Если сухому насыщенному пару сообщить некоторое количество теплоты при p = const, температура его повысится, и пар станет перегретым. Перегретый пар не является насыщенным, так как удельный объем его больше, чем у сухого насыщенного пара, а плотность меньше.
Для выполнения теплотехнических расчетов, связанных с применением жидкостей и паров в энергетических и промышленных установках, необходимо располагать данными по их термодинамическим параметрам. Такие данные могут быть получены с помощью уравнения состояния соответствующего вещества. Для большинства веществ, применяемых в настоящее время в технике, получены достаточно точные уравнения состояния, но они настолько сложны, что пользоваться ими в повседневных расчетах практически невозможно. Поэтому в расчетной практике используются не сами уравнения, а составленные по ним таблицы термодинамических параметров жидкостей и паров.
Однако аналитические расчеты с помощью табличных данных усложняются, если термодинамический процесс сопровождается фазовым переходом, так как параметры рабочего тела в различных его фазах выражаются разными формулами.
В связи с этим широко применяется графический метод расчета с помощью диаграмм воды и водяного пара.
Процесс парообразования
Рассмотрим процесс парообразования в pv-диаграмме (рис. 6.2). Допустим, начальное состояние 1 кг воды определяется температурой t = 0 оС и давлением р (точка 1 в диаграмме). Подведем теплоту и начнем нагревать воду при постоянном давлении р. Сначала вода нагревается до температуры кипения (температура насыщения) tн (точка 2), при которой начинается процесс парообразования. Затем при постоянных температуре и давлении вода будет кипеть и превращаться в пар (линия 2-3). В точке 3 последняя капля воды выкипает, и пар становится сухим, насыщенным. После этого температура пара начнет повышаться, и пар становится перегретым (линия 3-4).
Повысим
давление до p
>p
и повторим процесс подвода теплоты при
p
= const. Точка 1,
определяющая положение 1 кг воды при
этом давлении и температуре 0оС,
располагается почти на одной вертикали
с точкой 1,
так как вода практически не сжимается.
Точка 2
(начало парообразования) сместится и
займет положение правее точки 2,
а точка 3
(конец парообразования)
левее точки 3.
Линия 2-3
короче линии 2-3.
При давлении
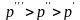 линия
линия
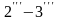 станет еще короче.
станет еще короче.
Таким образом, с повышением давления точки 2 и 3 сближаются и при критическом давлении pкр, которому соответствует критическая температура tкр, сходятся в общей точке К, называемую критической точкой. Как отмечалось ранее, это конечная точка фазового перехода жидкость–пар, который начинается в тройной точке А. В тройной точке сосуществуют три фазы: твердая, жидкая и газообразная.
Выше критической точки вещество в двухфазном состоянии находиться не может. Никаким давлением нельзя перевести газ в жидкое состояние при температурах выше критической.
В диаграмме линия А-1-1-1 соответствует состояниям воды при t = 0оС и различных давлениях.
Рис. 6.2. Процесс парообразования в pv -диаграмме |
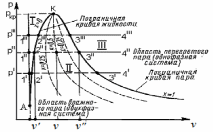
I − область между линиями жидкости (воды) при t = 0 оС и нижней пограничной кривой; соответствует состояниям жидкости (воды) при температурах от 0оС до tн и различных давлениях.
II – область между нижней и верхней пограничными кривыми, представляет собой двухфазную область, где сосуществуют сухой насыщенный пар и кипящая жидкость.
III – область правее верхней пограничной кривой соответствует состоянию перегретого пара.
Ts-диаграмма воды и водяного пара
Примем за начало отсчета калорических параметров (u, h, s) 0оС (273,16 К) и любое давление p. Следовательно, начальному состоянию воды при T = 273,16 К и давлении p на Ts-диаграмме соответствует точка 1 (рис. 6.3).
|
Если подвести к 1 кг воды, находящейся в этом состоянии, теплоту q при p=const, энтропия воды будет увеличиваться, так как
В области жидкого состояния при невысоких давлениях можно считать сp=const, тогда, интегрируя последнее уравнение в пределах от 273,16 К до Тн |
(Тн − температура насыщения при давлении p), получим
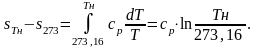
Таким образом, изобара воды представляет собой экспоненциальную кривую 1-2. В точке 2 вода закипает и начинается фазовый переход (парообразование) при постоянном давлении и постоянной температуре (прямая 2-3). В точке 3 выкипает вся жидкость, пар становится сухим, насыщенным и начинается перегрев пара. В области перегретого пара изобара 2-3 переходит в кривую 3-4, приближаясь постепенно, по мере
удаления от точки 3, к логарифмической зависимости (там, где зависимость теплоемкости перегретого пара ср от температуры становится незначительной).
Состоянию воды при давлении p >p и температуре t = 0 оС соответствует точка 1, совпадающая с точкой 1. Начало кипения – точка 2 (выше и правее точки 2), конец парообразования точка 3 (выше и левее точки 3). Таким образом, с повышением давления так же, как и в pv-диаграмме, точки 2 и 3 сближаются и при критическом давлении ркр, которому соответствует критическая температура Tкр, сливаются в критическую точку К.
Изобара 1-К, соответствующая критическому давлению, практически сливается с нижней пограничной кривой (х = 0), которая начинается в тройной точке 1. Нижняя пограничная кривая образуется точками, соответствующими началу парообразования при различных давлениях. Точки, соответствующие концу парообразования, образуют верхнюю пограничную кривую К-L;. 1-L – изобара тройной точки (p 0,6112 кПа). В области влажного пара х1, х2….хn – линии постоянной степени сухости.
Пограничные кривые делят диаграмму на три части: влево от кривой 1-К располагается область жидкости, между кривыми 1-К и К-L – область влажного пара, вправо от кривой К-L и вверх от точки К – область перегретого пара. Часть диаграммы, расположенная ниже линии 1-L, соответствует различным состояниям смеси лед + пар. Верхняя пограничная кривая не заканчивается в точке L, а продолжается вниз, отделяя область перегретого пара от области двухфазного состояния лед + насыщенный пар.
Площадь,
заключенная между изобарой воды 123
и осью абсцисс, представляет удельное
количество теплоты, сообщенной воде в
данном процессе, которое определяется
из выражения
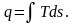 (6.3)
(6.3)
Так,
например, площадь фигуры 012s0
изображает количество теплоты, сообщенной
воде для нагревания ее от 0°С до температуры
кипения tн.
Площадь прямоугольника s23ss
−
количество теплоты, сообщенной 1 кг
кипящей жидкости для превращения ее в
сухой насыщенный пар, которая называется
удельной теплотой парообразования r.
Из диаграммы видно, что
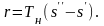
(здесь и далее индексы «’» и «”» относятся к кипящей жидкости и сухому пару, соответственно). Такой же результат получается из выражения (6.3) после интегрирования при T = const, q = Tн (s s). Если состояние перегретого пара характеризуется точкой 4, то сообщенная сухому насыщенному пару теплота в процессе 34 изображается площадью фигуры s345s.
Удельная теплота парообразования состоит из работы расширения 1, которая называется внешней теплотой парообразования, и работы преодоления сил межмолекулярного притяжения 2, которая называется внутренней теплотой парообразования: r = 1 + 2,
где
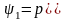 .
.
На практике Ts-диаграмма широко используется при исследовании термодинамических процессов и циклов, так как позволяет видеть изменение температуры рабочего тела и определять количество теплоты, участвующей в процессе, а, следовательно, и работу цикла, которая изображается площадью самого цикла. l = q1 – q2
Некоторым неудобством является то, что при определении количества теплоты и работы необходимо измерять соответствующие площади.
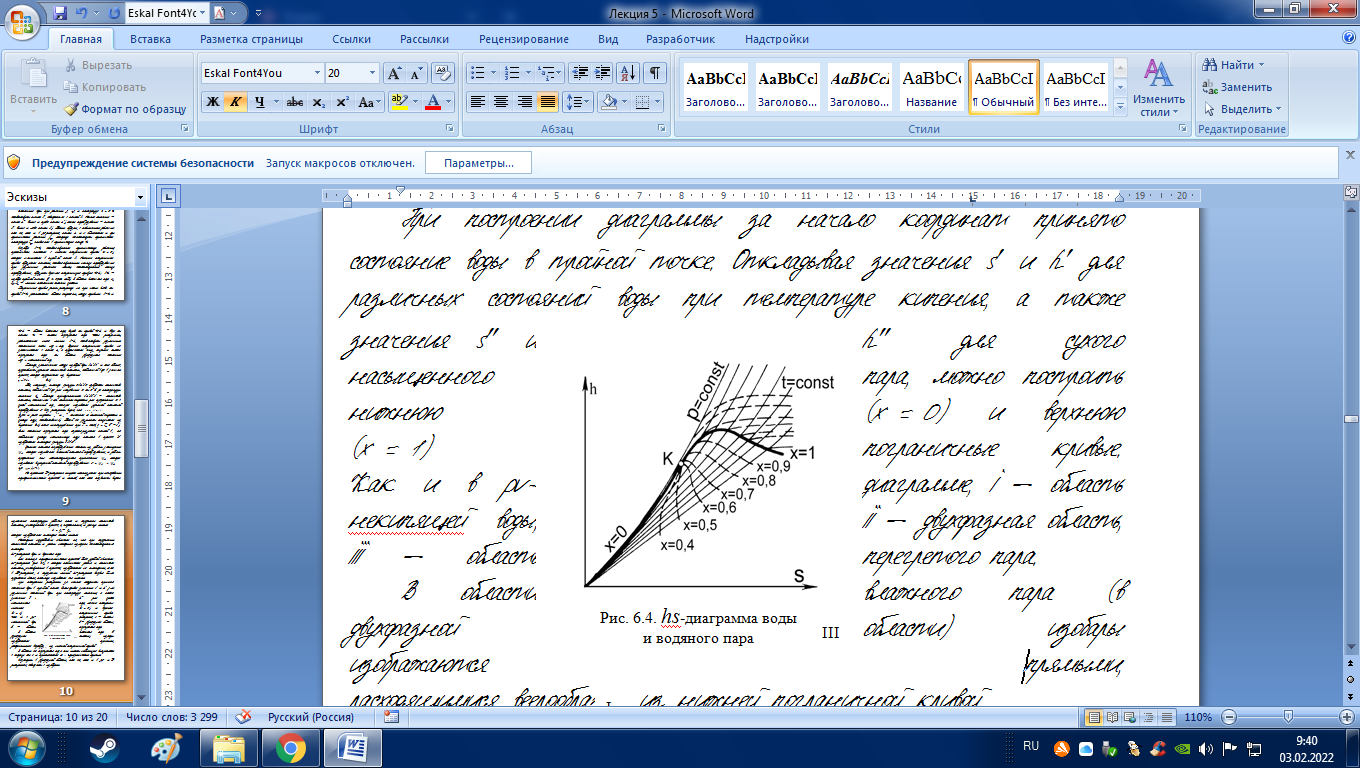
hs-диаграмма воды и водяного пара
Для анализа термодинамических процессов более удобной является hs-диаграмма (рис. 6.4), в которой техническая работа и количество теплоты, участвующие в процессах, изображаются не площадями, как в Тs-диаграмме, а отрезками линий. hs-диаграмма впервые была предложена Молье, поэтому называется его именем.
|
При построении диаграммы за начало координат принято состояние воды в тройной точке. Откладывая значения s и h для различных состояний воды при температуре кипения, а также значения s и h для сухого насыщенного пара, можно построить нижнюю (х = 0) и верхнюю (х = 1) пограничные кривые. Как и в pv-диаграмме, I – область некипящей воды, II – двухфазная область, III – область перегретого пара.
|
III
I
В области влажного пара (в двухфазной области) изобары изображаются прямыми, расходящимися веерообразно из нижней пограничной кривой.
I
II
II
В области же перегретого пара они имеют небольшую выпуклость в сторону оси s и приближаются к логарифмическим кривым.Изотермы в двухфазной области, так же, как и в pv- и Ts-диаграммах, совпадают с изобарами.
В области перегретого пара при небольших давлениях они имеют почти горизонтальное направление (перегретый пар по своим свойствам приближается к идеальному газу), а в области высоких давлений и при приближении к линии насыщения, то есть к верхней пограничной кривой, свойства перегретого пара значительно отклоняются от свойств идеального газа, и изотермы искривляются. Изохоры в диаграмме располагаются чуть круче изобар.
Критическая точка в hs-диаграмме находится не на вершине пограничных кривых, как в pv- и Ts-диаграммах, а смещена вниз и влево, так как энтальпия в критической точке численно меньше, чем энтальпия сухого насыщенного пара при давлениях ниже критического.
В области влажного пара наносятся линии постоянной степени сухости, а во всей диаграмме – сетка, соответствующая линиям s = const и h = const.
Для практического применения обычно строят только верхнюю часть диаграммы – наиболее употребительную при расчетах. Это дает возможность изображать ее в более крупном масштабе. По этой диаграмме можно определить p, v, t, s, h, x рабочего тела в любом его состоянии.
6.1. Основные термодинамические процессы изменения состояния водяного пара
Основными термодинамическими процессами изменения состояния водяного пара являются изохорный, изобарный, изотермический и адиабатный. Анализ процессов можно выполнить, пользуясь таблицами или диаграммами воды водяного пара.
В настоящее время созданы таблицы параметров кипящей воды и сухого насыщенного пара в зависимости от температуры, а также от давления. Кроме того, имеются таблицы параметров v, h, s перегретого пара в зависимости от температуры и давления.
Значения давлений и температур в этих таблицах даются с определенным интервалом. Промежуточные значения параметров определяется путем линейной интерполяции.
Метод расчета с помощью диаграмм состоит в том, что по известным параметрам в диаграмме фиксируется начальное состояние рабочего тела, затем по линии процесса и известному параметру в конце процесса определяется конечное состояние и все нужные для расчета параметры. По этим параметрам вычисляются изменение внутренней энергии, количество теплоты и работы в заданном процессе.
Ниже в pv- и hs-диаграммах представлены перечисленные термодинамические процессы и приведены формулы для расчета ∆u, q и l в этих процессах.
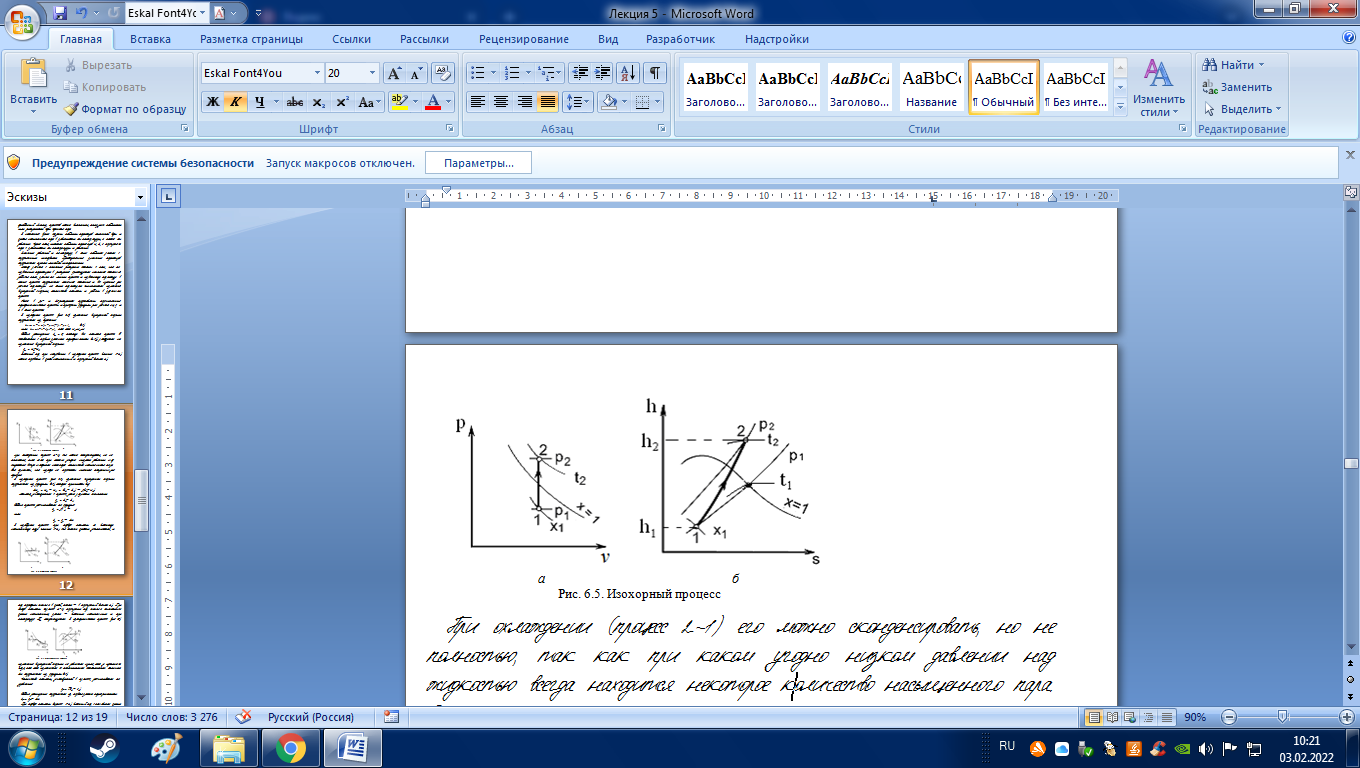
В
изохорном процессе (рис. 6.5) изменение
внутренней энергии определяется из
выражения
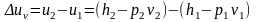 , (6.4)
, (6.4)
или
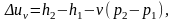 так как v1=v2=v.
так как v1=v2=v.
Работа расширения lv = 0, поэтому вся теплота процесса (в соответствии с первым законом термодинамики (2.4)) расходуется на изменение внутренней энергии: qv = u2u1.
|
Влажный пар при нагревании в изохорном процессе (линия 1-2) можно перевести в сухой насыщенный и перегретый (точка 2).
|
При охлаждении (процесс 2-1) его можно сконденсировать, но не полностью, так как при каком угодно низком давлении над жидкостью всегда находится некоторое количество насыщенного пара. Это означает, что изохора не пересекает нижнюю пограничную кривую.
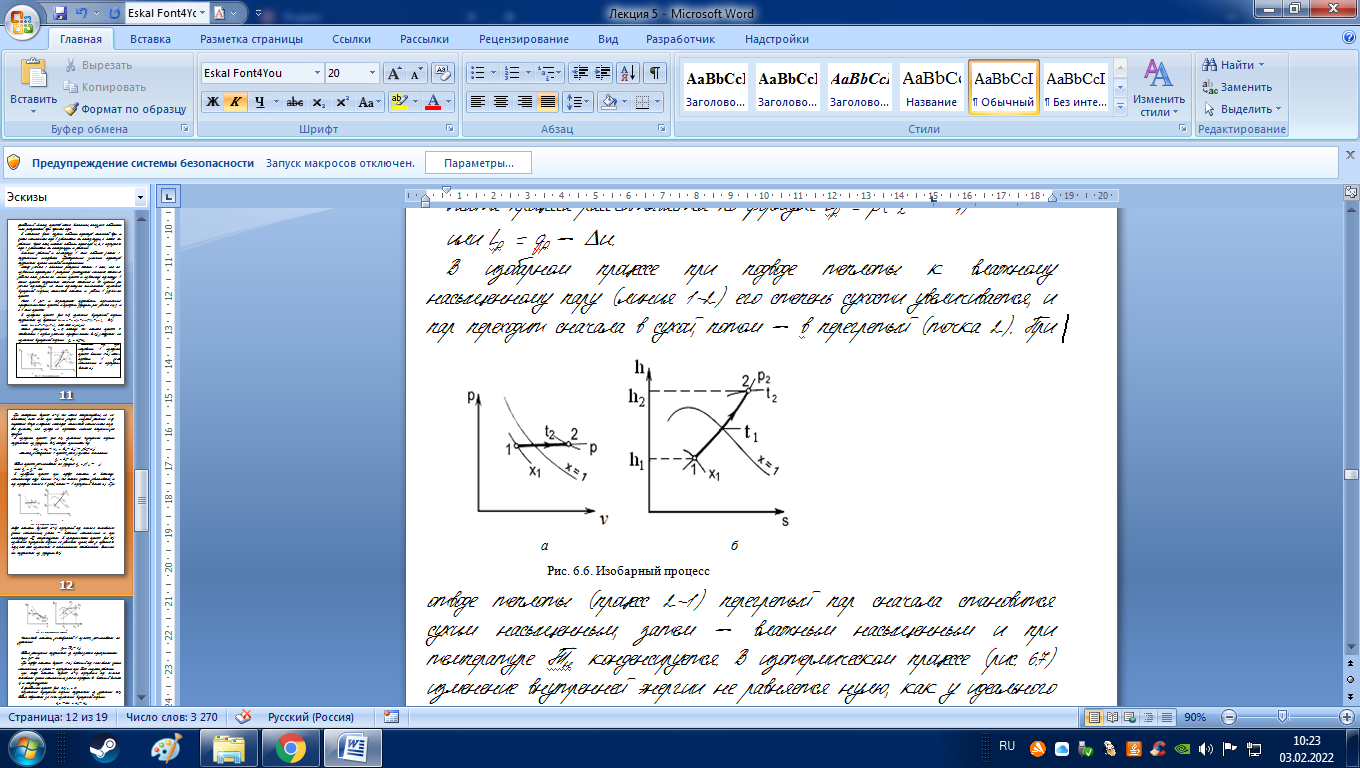
В изобарном процессе (рис. 6.6) изменение внутренней энергии определяется из формулы (6.4), которая принимает вид
up = u2 u1 = (h2 h1) – p(v2 v1).
Теплота, участвующая в процессе, равна разности энтальпий:
qp = h2 h1
Работа процесса рассчитывается по формуле lp = p(υ2 – υ1)
или lp = qp – u.
|
В изобарном процессе при подводе теплоты к влажному насыщенному пару (линия 1-2) его степень сухости увеличивается, и пар переходит сначала в сухой, потом – в перегретый (точка 2). |
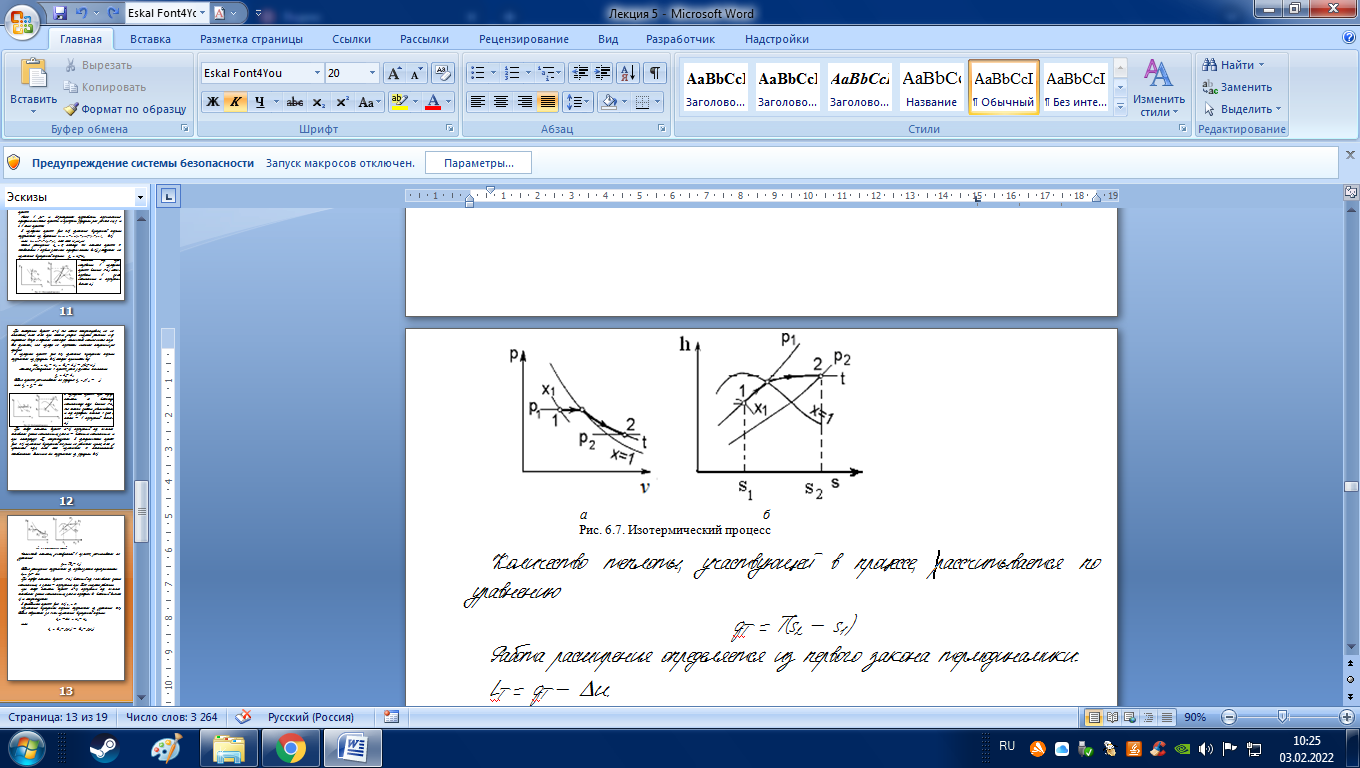
При отводе теплоты (процесс 2-1) перегретый пар сначала становится сухим насыщенным, затем – влажным насыщенным и при температуре Тн конденсируется. В изотермическом процессе (рис. 6.7) изменение внутренней энергии не равняется нулю, как у идеального газа, так как изменяется ее потенциальная составляющая. Величина u определяется из формулы (6.4).
Количество теплоты, участвующей в процессе, рассчитывается по уравнению qT = T(s2 s1)
Работа расширения определяется из первого закона термодинамики:
lT = qT u.
|
При подводе теплоты (процесс 1-2) влажный пар становится сухим насыщенным, а затем перегретым при более низком давлении.
|
При отводе теплоты (процесс 2-1) перегретый пар сначала становится сухим насыщенным, затем переходит во влажный (точка 1) и конденсируется.
В
адиабатном процессе (рис. 6.8)
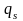 = 0.
= 0.
Изменение внутренней энергии определяется из уравнения (6.4). Работа совершается за счет изменения внутренней энергии:
ls= –u = u1 u2, или ls = (h1 p1v1) – (h2 p2v2).
|
При адиабатном расширении (процесс 1-2) давление и температура пара уменьшаются, и перегретый пар становится сначала сухим насыщенным, а затем влажным (точка 2 в диаграмме). |
Параметры состояния воды и водяного пара
Удельный
объем воды при температуре 0оС
и различных давлениях близок к vо 0,001
м3/кг
и мало изменяется с увеличением давления
( жидкость практически несжимаема),
удельные энтальпия и энтропия жидкой
фазы в тройной точке принимаются равными
нулю, то есть для воды при давлении 0,611
кПа и температуре Т = 273,16 К (t = 0,01
0С):
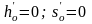 .
.
Удельная внутренняя энергия воды в тройной точке
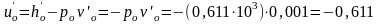 Дж/кг
Дж/кг
– величина очень маленькая, поэтому можно считать, что при t = 0oС uo 0.
Параметры кипящей жидкости. Удельный объем определяется одним параметром, температурой насыщения или давлением насыщения:
v′ = f(Tн) или v′= f(pн).
Из выражения dh = сp dt
после
интегрирования в интервале температур
от 0оС
до tн
получим удельную энтальпию

Удельная внутренняя энергия определяется из общей формулы (2.29):
u =h pнv.
Из
выражения
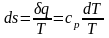
после
интегрирования в интервале температур
от 0оС
до tн
получим удельную энтропию
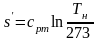 .
.


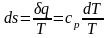 .
.