
Fizicheskaya_termodinamika
.pdf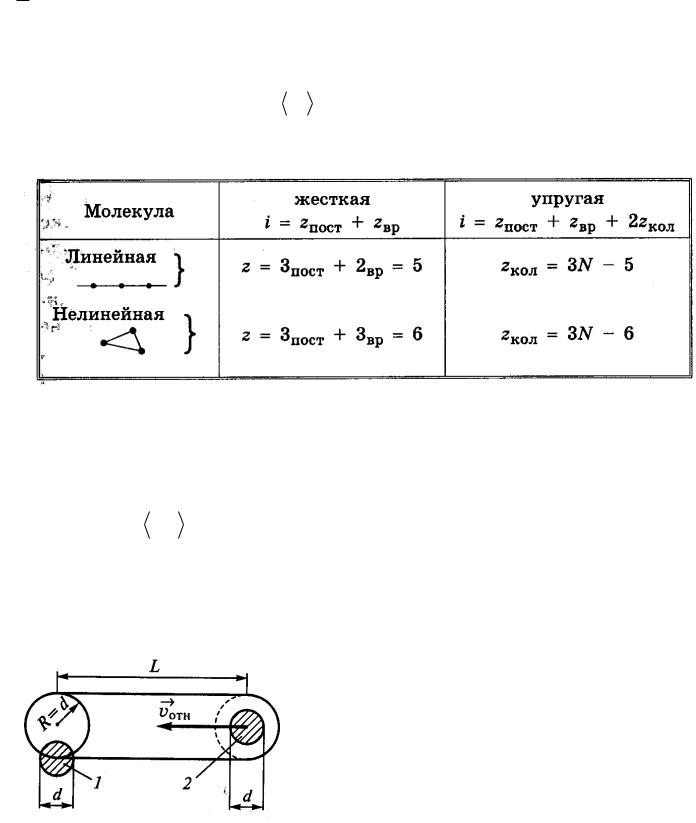
11
Если молекула упругая, то возможны колебания атомов и необходима ещё одна степень свободы (расстояние между атомами) – колебательная степень свободы.
Так как средняя энергия поступательного движения молекулы равна |
3 |
kT , |
|
2 |
|||
|
|
то получается, что на каждую степень свободы в среднем приходится энергия
1
2 kT . На колебательную степень свободы должны приходиться в среднем по две
половинки kT – одна в виде кинетической и одна в виде потенциальной. Для полной средней энергии молекулы имеем:
0 |
|
i |
k T , где |
|
2 |
||||
|
|
|
i =zпост + zвр +2zкол .
Число i совпадает с числом степеней свободы только для жёстких молекул. Молекулы идеального газа не взаимодействуют между собой. Поэтому
внутреннюю энергию некоторого количества идеального газа можно найти как сумму средних энергий всех молекул газа:
U N E |
N |
|
|
i |
k T |
i |
R T |
i |
|
m |
R T |
i |
pV |
|
A |
|
|
|
|
|
. |
||||||||
0 |
|
2 |
2 |
|
2 M |
2 |
|
|||||||
|
|
|
|
|
|
|||||||||
Длиной свободного пробега молекулы газа λ называют среднее расстояние, которое пролетает молекула между очередными её столкновениями с другими молекулами газа.
Для оценки λ будем считать, что молекулы идеального газа представляют собой твёрдые шары диаметром d , которые взаимодействуют между собой только путём упругих соударений при непосредственном соприкосновении. При рассмотрении взаимодействия двух молекул систему
12
отсчёта свяжем с центром молекулы 1. В этой системе отсчёта молекула 2
движется со скоростью ОТН и проходит расстояние L c момента предыдущего
столкновения с молекулой 1. Молекула 2 не испытает ни одного столкновения с другими молекулами, если не будет ни одного их центра внутри цилиндра с площадью основания πR2 = πd2 и длиной L.
Таким образом, на одну молекулу газа в среднем приходится объём
|
|
|
V d 2 L |
. |
|
|
|
|
|
|
||||||
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|||
Так как концентрацию п молекул газа можно представить в виде |
|
|
|
|||||||||||||
1 |
1 |
|
|
|
|
1 |
|
|
|
|
|
|||||
п |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
V0 |
|
d 2 L |
, |
то |
L |
|
. |
|
|
|
||||||
|
d 2п |
|
|
|
||||||||||||
Если в лабораторной системе отсчёта средняя скорость молекул равна |
|
, |
||||||||||||||
а средняя относительная скорость молекулы |
2 в системе отсчёта, связанной с |
|||||||||||||||
молекулой 1 равна ОТН |
, то длина свободного пробега |
λ и расстояние |
L |
|||||||||||||
будут связаны соотношением |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
L . |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
ОТН |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
Если |
υ1 |
и υ2 – скорости молекул 1 и |
2, а |
|||||||||
|
|
|
|
φ – угол между направлениями векторов этих |
||||||||||||
|
|
|
|
скоростей то |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
2 |
2 |
2 2 |
cos |
. |
|
|||||||
|
|
|
|
|
|
ОТН |
|
1 |
2 |
1 2 |
|
|
||||
Так как скорости молекул могут иметь любые произвольные направления, а их средние значения в равновесном газе одинаковые, то усреднение последнего
соотношения по всем возможным углам φ даёт
 ОТН2
ОТН2 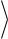
 12
12 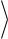
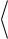 22
22 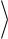
 2 2
2 2 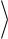 .
.
Считая, что средние квадраты скоростей молекул пропорциональны квадратам их средних скоростей, получаем
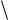 ОТН
ОТН 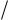
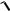
 2
2 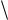
 .
.
Выражение для длины свободного пробега принимает вид
|
|
1 |
|
|
1 |
|
||
|
|
|
|
|
|
|||
|
|
|
|
|
n , где |
|||
2 d 2n |
2 |
|||||||
13
d 2 – эффективное сечение взаимодействия.
Средняя частота соударений молекулы газа с другими молекулами
|
|
|
|
|
|
f |
|
2 n . |
|||
|
|||||
|
|||||
|
|
|
|
||
Экспериментальное подтверждение молекулярно-кинетической теории

14
Лекция 12
Теплоёмкость идеального газа
Теплоёмкостью макросистемы (тела или некоторого количества газа)
называют количество тепла, которое нужно сообщить макросистеме, чтобы
повысить её температуру на один кельвин:
СМ Q . dT
Молярной теплоёмкостью называют количество тепла, которое необходимо сообщить одному молю вещества, чтобы повысить его температуру на один кельвин:
СQ , С Дж/моль.К.
dT
Всправочных таблицах обычно указывают удельную теплоёмкость с, Дж/кг.К
с = С/М , где
М – молярная масса.
Теплоёмкость также как и Q зависит от процесса и является функцией
процесса.
Для анализа различных процессов в газах удобно пользоваться молярной теплоёмкостью. Особое значение имеют молярные теплоёмкости для двух процессов: при постоянном объёме СV и при постоянном давлении Ср .
При постоянном объёме dV = 0. Следовательно δА = р.dV = 0 и имеем
|
|
1 |
|
U |
||
СV |
|
|
|
|
||
|
||||||
|
|
|
T V . |
|||
Так как теплоёмкость в широком интервале температур практически не меняется, то получаем
dU CV dT U CV T .
|
|
|
|
dU |
i |
R dT |
|
|
Ранее было показано, что |
2 |
, поэтому можно считать, что |
||||||
|
|
|||||||
|
|
|
|
|
|
|
||
|
С |
i |
|
R |
|
|
|
|
для идеального газа |
|
|
|
|
||||
V |
2 |
|
|
|
|
|
||
|
|
|
|
|
|
|
||
15
Молярная теплоёмкость произвольного процессa
С |
dU A |
C |
p |
|
dV |
|
|
dT |
|
dT . |
|||||
|
V |
|
|||||
Если процесс изобарический (p = const), то из уравнения состояния следует, что р(dV/dT) = ν.R , и соответствующая молярная теплоёмкость
|
|
С р |
СV |
R |
(соотношение Майера). |
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
С р |
|
|
Важной характеристикой |
|
газов |
|
является |
отношение |
|
|
, которое |
|||||||||||||
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
СV |
|
|
обозначают буквой γ и называют постоянной адиабаты. |
|
|
|
|
|
|
|
||||||||||||||
|
|
|
Ср |
1 |
R |
|
|
|
|
C |
R |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
С |
C |
|
|
1 . |
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
V |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V |
|
|
|
V |
|
|
|
|
|
|
|
|
|
|
|
|
|
Для изменения внутренней энергии ν молей идеального газа получаем: |
|||||||||||||||||||||
dU |
R dT |
|
d p V |
|
|
|
U |
R T |
|
p V |
|
||||||||||
|
1 |
1 |
|
|
|
|
|
|
|
1 |
|
1 |
. |
||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||
Адиабатический процесс
Адиабатическим называют процесс, который проходит без теплообмена с окружающей средой. Для идеального газа получаем:
|
|
|
|
|
|
pV |
|
|
|
|
|
|
|
|
|
|
|
Q d |
p dV |
0 |
|
|
|||
|
|
|
|
|
1 |
, |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
d p V 1 p dV 0 , |
|
||||||
dp V p dV p dV p dV 0 |
|
|
V dp p dV 0 , |
|||||||||
|
dp |
|
dV |
0 |
|
d ln p d lnV d ln pV 0 |
|
|||||
|
|
|
. |
|||||||||
|
p |
|
V |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|||
После интегрирования получаем уравнение адиабаты в переменных р , V
или уравнение Пуассона:
p V const
В переменных Т, V для уравнения адиабаты получаем (используя p.V =
ν.R.T):
T V 1 const .
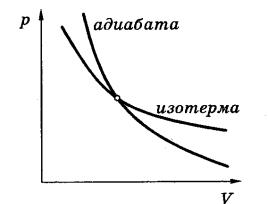
16
Адиабата в координатах р , V идёт круче изотермы (рV = const)
Политропический процесс
Политропическими называют процессы, уравнение которых в переменных р , V имеет вид
p V п const , где
п – произвольное число, как положительное, так и отрицательное, а также равное нулю.
Например, политропическими являются изохорический (V = const, п ), изобарический (р = const, п = 0), изотермический (рV = const, п = 1) и адиабатический (п = γ) процессы.
Теплоёмкость всех политропических процессов остаётся постоянной:
Сп const .
Для получения выражения для Сп воспользуемся уравнением политропы в переменных Т, V:
T V п 1 const .
Продифференцируем это уравнение: |
|
|
|
|
|||||
dT V п 1 T n 1 V n 2 |
dV 0 или |
||||||||
|
dV |
|
1 V |
|
|
R |
|||
|
|
|
|
|
|
|
|
||
|
|
n 1 T |
|
p(n 1) . |
|||||
|
dT |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
17 |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
С C |
|
p |
|
dV |
|
|
Подставляя это выражение в формулу для теплоёмкости |
|
dT , |
||||||||||||||||||||
|
V |
|
|
|||||||||||||||||||
получаем: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Сп СV |
|
|
R |
|
|
|
|
|
n |
Cn Cp |
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
n 1 |
C |
C . |
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n |
V |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CV |
|
R |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Используя формулу |
|
, получаем ещё одно выражение: |
|
|
|
|
|
|||||||||||||||
1 |
|
|
|
|
|
|||||||||||||||||
|
|
|
|
Сп |
|
|
R |
|
|
R |
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
1 |
n 1 . |
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Видно, что если |
п = γ, |
то |
|
|
|
Сп = 0 |
как и должно быть из определения |
|||||||||||||||
адиабатического процесса. При |
п = 1 получаем |
Сп , как и должно быть при |
||||||||||||||||||||
изотермическом процессе. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Работа газа при политропических процессах
Работу газа при любом процессе можно вычислять и при помощи первого начала термодинамики:
АQ U Cn T CV T
(Cn CV ) T (Cn CV ) (T2 T1 )
|
С |
|
С |
R |
|
|
С |
|
С |
R |
|
Из формулы |
|
n 1 |
получаем |
|
n 1 . Тогда работа |
||||||
|
п |
V |
|
п |
V |
||||||
газа в политропическом процессе: |
|
|
|
|
|
|
|||||
А |
R (T1 T2 ) |
|
p1V1 p2V2 |
|
|
|
||||
|
|
|
|
. |
|
|
||||
|
|
n 1 |
|
n 1 |
|
|
||||
|
|
|
|
|
|
|||||
В изотермическом процессе вычислять работу по этой формуле не удобно |
||||||||||
так как в этом случае |
п 1, T1 T2 и |
А = 0/0. Поэтому в изотермическом |
||||||||
процессе |
|
|
|
|
|
|
|
|
|
|
V |
|
V |
|
|
|
|
|
|||
А 2 |
pdV 2 |
RT |
dV RT ln |
V2 |
|
|||||
|
|
|||||||||
|
|
|
V |
|
|
|
V . |
|||
V |
|
V1 |
|
|
1 |
|
||||
1 |
|
|
|
|
|
|
|
|
|
|
18
Газ Ван-дер-Ваальса
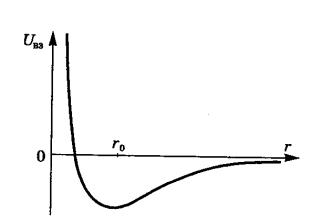
С ростом давления уравнение состояния идеального газа требует корректировки при описании поведения реальных газов. При р = 1000 атм (108 Па) произведение р.V становится вдвое больше, чем предписывает модель идеального газа для конкретной температуры (газ не «сжимается»).
Причин для такого отклонения две:
1) собственный размер молекул, уменьшающий объём, доступный для движения молекул (при нормальных условиях он составляет ~ 0,07% объёма сосуда с газом, а при 100 атм уже 70%);
2) сложный характер взаимодействия между молекулами.
На рисунке приведена типичная кривая зависимости потенциальной энергии взаимодействия UВЗ молекул от расстояния между их центрами.
На малых расстояниях (r < ro) молекулы отталкиваются, на больших (r > ro) притягиваются.
Для описания реального (неидеального) газа пользуются уравнением Ван-
дер-Ваальса:
|
|
|
|
|
a |
2 |
|
|
|
|
|
|
|
р |
|
|
|
||
|
|
|
|
|
|
|
|||
|
|
|
|
|
V |
2 |
|
, где |
|
|
|
|
|
|
|
|
|
|
|
a и b – постоянные Ван-дер-Ваальса (для разных газов они имеют свои |
|||||||||
значения). |
|
|
|
|
|
|
|
|
|
|
|
a 2 |
|
|
|
|
|
|
|
Поправка |
|
|
обусловлена силами притяжения между молекулами. Она |
||||||
|
V 2 |
||||||||
имеет размерность давления, и её иногда называют внутренним давлением. |
|||||||||
Поправка |
b v |
связана с собственным объёмом молекул. |
|||||||

19
Внутренняя энергия газа Ван-дер-Ваальса
Внутренняя энергия ванн-дер-ваальсовского газа
U C T |
a 2 |
|
i |
R T |
a |
2 |
|
|
|
|
. |
||||
V |
V |
|
2 |
|
V |
||
|
|
|
|
|
|||
C T |
|
i |
R T |
|
|
|
|
|
суммарная |
кинетическая энергия молекул в Ц- |
|||
V |
|
2 |
|
|||
|
|
|
|
|
||
системе, связанной с сосудом; |
|
|
||||
UВЗ |
a 2 |
|
|
|
|
|
|
|
|
– суммарная энергия |
взаимодействия молекул (собственная |
||
|
|
|
||||
V
потенциальная энергия).
Если газ расширяется в пустоту без теплообмена с окружающими телами, то
А0, Q 0 , и согласно первому началу термодинамики в этом процессе U =
=const. Получается, что с ростом объёма температура реального газа уменьшается (в отличие от идеального газа).
Лекция 13
Тепловые и холодильные машины
Тепловые машины (двигатели внутреннего сгорания, реактивные двигатели, газовые турбины и др.) предназначены для получения полезной работы за счёт теплоты, выделяемой вследствие сгорания топлива, ядерных превращений, нагрева солнечными лучами или по другим причинам. Ниже приведена условная схема тепловой машины (а) и её термодинамический цикл (б).
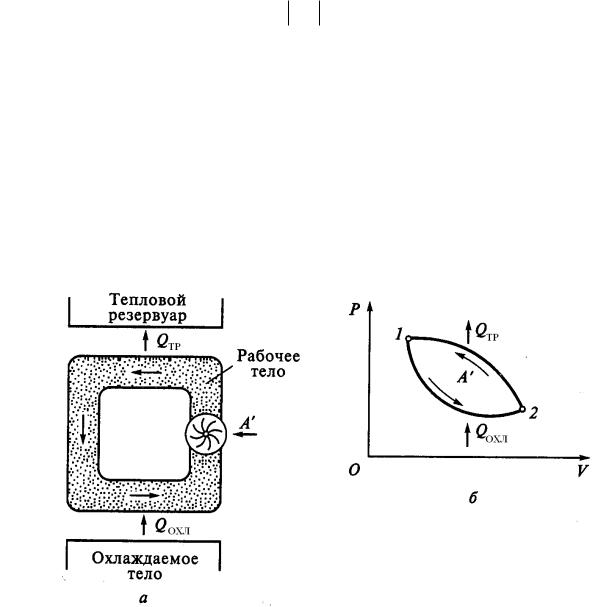
20
Вкачестве холодильника часто выступает окружающая среда. В космических энергоустановках окружающая среда отсутствует и необходим специальный холодильник-излучатель.
Наличие холодильника и передача ему части полученной от нагревателя теплоты является обязательным, так как иначе работа тепловой машины
невозможна. Вычисляемая по первому началу термодинамики величина QX является отрицательной т.к. это количество теплоты поступает не к рабочему телу, а от него к холодильнику.
Всоответствии с первым началом внутренняя энергия за цикл (круговой процесс) не изменяется. Совершённая рабочим телом механическая работа равна разности подведённой и отведённой теплоты:
АQH QX QH QX .
Тепловой коэффициент полезного действия (КПД) цикла любой тепловой машины можно рассчитать как отношение полезной работы к количеству теплоты, переданной рабочему телу от нагревателя:
|
А |
|
QH |
|
QX |
|
1 |
|
QX |
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|||
QH |
QH |
|
|
. |
|||||||
|
|
|
|
|
|||||||
|
|
|
|
|
QH |
||||||
Термодинамический цикл, осуществляемый в обратном направлении . может быть использован для работы холодильной машины.
В холодильной машине внешние тела совершают работу А’ над рабочим телом и происходит отвод теплоты QОХЛ от охлаждаемого тела и передача теплоты QТР (величина отрицательная) тепловому резервуару, в качестве которого обычно выступает окружающая среда.
