
- •(Морфология микробов)
- •16.Рост и размножение бактерий. Фазы размножения.
- •17.Способы получения энергии бактериями (дыхание, брожение).
- •18.Типы и механизмы питания бактерий.
- •29. Дисбиозы. Дисбактериоз
- •30.Действие физических и химических факторов на микроорганизмы. Понятие о стерилизации, дезинфекции, асептике и антисептике.
- •31. Строение генома бактерий. Понятие о генотипе и фенотипе. Виды изменчивости.
- •32.Механизмы передачи генетического материала у бактерий.
- •35.Генетика вирусов.
- •48.Интерфероны, природа. Способы получения и применения.
- •49.Понятие об иммунитете. Виды иммунитета.
48.Интерфероны, природа. Способы получения и применения.
Система интерферона (ИФН) — важнейший фактор неспецифической резистентности организма человека. функции: антивирусная ,противоопухолевая, иммуномодулирующая ,радиопротективная.
Интерфероны — гликопротеины, вырабатываемые клетками в ответ на вирусную инфекцию и другие стимулы. Блокируют репродукцию вируса в других клетках и участвуют во взаимодействии клеток иммунной системы.
Различают три ИФН:
1. альфа-ИФН синтезируют лейкоциты периферической крови (ранее был известен как лейкоцитарный ИФН); (подавление синтеза вирусных белков) связываясь со здоровыми клетками, защищает их от вирусов.
2. бета-ИФН синтезируют фибробласты (ранее был известен как фибробластный ИФН); (антивирусный эффект)
3.гамма-ИФН — продукт стимулированных Т-лимфоцитов, NK-клеток(естественные киллеры) и (возможно) макрофагов (ранее был известен как иммунный ИФН). Стимулирует активность Т- и В-лимфоцитов, моноци¬тов/макрофагов и нейтрофилов. Индуцирует апоптоз активированных макрофагов, кератиноцитов, гепатоцитов, клеток костного мозга, эндотелиоцитов и подавляет апоптоз периферических моноцитов и герпес-инфицированных нейронов.
Интерферон взаимодействует с интактными, ещё неинфицированными клетками, препятствуя реализации репродуктивного цикла вирусов за счёт активации клеточных ферментов (протеинкиназ).
Применение интерферона. Действие интерферона тем эффективнее, чем раньше он начинает синтезироваться или поступать в организм извне. Поэтому его используют с профилактической целью при многих вирусных инфекциях, например гриппе, а также с лечебной целью при хронических вирусных инфекциях, таких как парентеральные гепатиты (В, С,D), герпес, рассеянный склероз и др. Интерферон дает положительные результаты при лечении злокачественных опухолей и заболеваний, связанных с иммунодефицитами.
Получение интерферона. Получают интерферон двумя способами: а) путем инфицирования лейкоцитов или лимфоцитов крови человека безопасным вирусом, в результате чего инфицированные клетки синтезируют интерферон, который затем выделяют и конструируют из него препараты интерферона; б) генно-инженерным способом — путем выращивания в производственных условиях рекомбинантных штаммов бактерий, способных продуцировать интерферон. Обычно используют рекомбинантные штаммы псевдомонад, кишечной палочки со встроенными в их ДНК генами интерферона. Интерферон, полученный генно-инженерным способом, носит название рекомбинантного. В нашей стране рекомбинантный интерферон получил официальное название «Реаферон». Производство этого препарата во многом эффективнее и дешевле, чем лейкоцитарного.
Рекомбинантный интерферон нашел широкое применение в медицине как профилактическое и лечебное средство при вирусных инфекциях, новообразованиях и при иммунодефицитах.
49.Понятие об иммунитете. Виды иммунитета.
Иммунитет - способ защиты организма от живых тел и веществ, несущих на себе признаки чужеродной информации Различают два основных вида иммунитета — наследственный и приобретенный.
Наследственный (врожденный, видовой) иммунитет присущ определенному виду животных или человеку и передается из поколения в поколение. Приобретенный иммунитет развивается вследствие перенесенной инфекции (естественно приобретенный иммунитет) или в результате иммунизации (искусственно приобретенный иммунитет(не передается по наследству).
Существует активно и пассивно приобретенный иммунитет. Активно приобретенный иммунитет возникает вследствие перенесенного заболевания (естественно) или в результате вакцинации (искусственно) и сохраняется относительно долго(корь,коклюш,оспа).Пассивно приобретенный иммунитет может возникать естественно, когда антитела от матери передаются через плаценту, и новорожденный в течение 6— 7 мес невосприимчив к некоторым инфекционным заболеваниям, например, к кори. Искусственный пассивно приобретенный иммунитет создается при введении иммунной сыворотки или иммуноглобулина и сохраняется непродолжительно (3—4 нед).
Различают антибактериальный, антитоксический, противовирусный и трансплантационный иммунитет. При антибактериальном иммунитете защитные силы организма направлены против бактерий, на подавление их размножения. Антитоксический иммунитет характеризуется нейтрализацией антителами-антитоксинами микробных экзотоксинов, противовирусный—обусловлен нейтрализующим действием противовирусных антител на вирионы.
Приобретенный иммунитет может быть стерильным и нестерильным. Стерильный иммунитет характеризуется полным освобождением организма от возбудителя заболевания. Нестерильный, или инфекционный, иммунитет обусловлен наличием в организме микроба возбудителя.(наличие в организме человека туберкулезного очага обусловливает невосприимчивость к новому заражению микобактериями туберкулеза.)
Местный иммунитет - обуславливает защиту кожи и слизистых оболочек от патогенных воздействий. Основные эффекторные механизмы местного иммунитета – секреторные АТ (относятся к IgA) и фагоциты.
Иммунитет, создаваемый анатомическими, физиологическими, клеточными и молекулярными факторами, которые являются естественными составляющими элементами организма, иначе называют конституционным. Такие факторы защищают организм от разных экзогенных и эндогенных агрессий, они передаются наследственно, их защитные функции лишены избирательности и они не способны сохранять память от первичного контакта с чужеродностью.
Структура и функции иммунной системы.
Главным элементом иммунной системы являются лимфоидные клетки. Общее число лимфоцитов у человека составляет 1012 клеток. Вторым важным элементом иммунной системы являются макрофаги. Кроме этих клеток, в защитных реакциях организма участвуют гранулоциты. Лимфоидные клетки и макрофаги объединены понятием иммунокомпетентные клетки.
В иммунной системе выделяют Т-звено и В-звено или Т-систему иммунитета и В-систему иммунитета. Основными клетками Т-системы иммунитета являются Т-лимфоциты, основными клетками В-системы иммунитета В-лимфоциты.
Органы иммунной системы разделяют на центральные и периферические:
к центральным относят:
•красный костный мозг - продукция иммунокомпетентных клеток из стволовой полипотентной; все лимфоидные клетки имеют на своей поверхности гликопротеиновые маркеры - т. н. кластеры дифференцировки - CD (cluster of differentiation); стволовая клетка - предшественница клеток лимфоидного и миелоидного рядов имеет маркер CD34+.
•вилочковая железа (thymus) - место созревания и дифференцировки Т- лимфоцитов (их общий маркер - CD3+), затем заселяющих периферические органы иммунитета; в тимусе происходит селекция Т- лимфоцитов, имеющих рецепторы к собственным тканям;
к периферическим органам относят: (осуществляются размножение и дифференцировка антиген-реактивных клеток)
•селезенку (в ней происходит продукция лимфоцитов в ответ на антигенный стимул, обеспечивает отбор функционально неактивных эритроцитов и лейкоцитов, кровяных пластинок, служит депо крови.)
•лимфатические узлы и образования(система синусов (каналов), по которым лимфа протекает от приносящих лимфатических сосудов к выносящим лимфатическим сосудам. В синусах лимфа очищается от болезнетворных и токсических веществ и обогащается лимфоцитами.)
•миндалины, в которых есть т.н. Т- и В- зоны, в которых созревают соответственно Т- и В- лимфоциты.
Иммунокомпетентные клетки. Т- и В-лимфоциты, макрофаги.
В крови человека на долю Т-лимфоцитов приходится около 70% всех лимфоцитов, на долю В-лимфоцитов – около 20%.
Т-лимфоциты выполняют следующие функции:
являются основными эффекторами клеточного иммунитета;
являются регуляторами воспаления, иммунных реакций и кроветворения;
участвуют в процессах репаративной и физиологической регенерации различных тканей.
Среди Т-лимфоцитов различают две субпопуляции клеток – CD4+-клeтки и СD8+-клетки.
По функциональным характеристикам в популяции Т-лимфоцитов выделяют
Т-хелперы гуморального иммунитета,
Т-хелперы клеточного иммунитета,
Т-супрессоры,
Т-цитотоксические клетки.
Т-лимфоциты
CD3.В организме Т-лимфоциты обеспечивают клеточные формы иммунного ответа (гиперчувствительность замедленного типа, трансплантационный иммунитет, противоопухолевый иммунитет и т.д.), определяют силу и продолжительность иммунной реакции. Их созреванием, дифференцировкой и активностью управляют цитокины.
Т-хелперы выполняют регуляторную функцию. CD4.Распознают антиген в комплексе с молекулой МНС2,стимулируют диф.В-клеток и цитотоксических Т-лифоциты, активируют макрофаги
T-киллеры.В рецепции принимают участие молекула CD3, комплексирующая с TCR , и ко-рецепторные молекулы CD8, тропные к МНС I класса.
Т-киллер анализирует клетки собственного организма в поисках измененной, т.е. отличной от собственной, структуры комплекса антиген-МНС I класса. Мутантные клетки, клетки, пораженные вирусом, или клетки аллогенного трансплантата несут на своей поверхности такие признаки генетической чужеродности. Поэтому они являются мишенью Т-киллера.
Т-киллер устраняет клетки-мишени путем антителонезависимой клеточно-опосредованной цитотоксичности, для чего синтезирует ряд токсических субстанций: перфорин, гранзимы и гранулизин.
Т-киллеры обеспечивают в организме антителонезависимую клеточно-опосредованную цитотоксичность, формирование Т-клеточной иммунологической памяти и гиперчувствительности замедленного типа. Кроме того, активированный Т-киллер синтезирует гамма-ИФН и ФНО (фактор некроза опухолей), стимулирующие иммунное воспаление
гамма-дельта T-клетки (Т – клеточные рецепторы)
Они практически полностью локализуются в эпидермисе и слизистой желудочно-кишечного тракта, его активный центр непосредственно связывается с эпитопом антигена.Клетки ориентированы на распознавание некоторых широко распространенных микробных антигенов (липопротеинов, белков теплового шока, бактериальных суперантигенов и др.). Клетки принимают участие в удалении патогенов на ранних этапах противоинфекционной защиты.Они синтезируют цитокины, активирующие местный иммунитет и локальную воспалительную реакцию, в том числе усиливают образование Т2-хелперов. Кроме того, гамма-дельта-клетки продуцируют ИЛ-7 и контролируют тем самым численность собственной популяции.
Т-супрессоры - ингибируют активность иммунокомпетентных клеток
В-лимфоциты – это преимущественно эффекторные иммунокомпетентные клетки.Выделяют две субпопуляции В-лимфоцитов: «обычные» В-клетки, не имеющие маркера CD5, и CD5+ В1-лимфоциты. Зрелые В-лимфоциты и их потомки- плазматические клетки (плазмоциты) являются антителопродуцентами. Их основным продуктом являются иммуноглобулины. Кроме того, В-лимфоциты являются профессиональными АПК (антигенпрезентующая клетка). Они участвуют в формировании гуморального иммунитета, В-клеточной иммунологической памяти и гиперчувствительности немедленного типа. Дифференцировка и созревание В-лимфоцитов происходят сначала в костном мозге, а затем в периферических органах иммунной системы, куда они отселяются на стадии предшественников. Потомками В-лимфоцитов являются клетки иммунологической памяти и плазматические клетки. Основные морфологические признаки последних – обширная цитоплазма, развитый эндоплазматический ретикулум и аппарат Гольджи с большим количеством рибосом. Активно синтезирующий плазмоцит живет недолго, не более 2-3 суток.
Иммуноглобулины, структура и функции.
Антитела ( Ат ) — эффекторные молекулы гуморального иммунитета. Синтез антител запускают Аг, поступающие в организм извне (при инфекциях, вакцинации, действии ксенобиотиков) или образующиеся эндогенно. Антитела существуют в миллионах разновидностей, и каждая молекула имеет уникальный участок связывания Аг-детерминанты. В большинстве случаев антитела представлены сывороточными гликопротеинами, мигрирующими в составе медленной фракции гамма-глобулинов при электрофорезе белков сыворотки крови. Поэтому для обозначения сывороточной фракции AT иногда применяют термин «гамма-глобулины».
Антитела также называют «иммуноглобулины».
Структурная единица AT — мономер — молекула цилиндрической формы, состоящая из двух идентичных тяжёлых Н-цепей [от англ. heavy, тяжёлый] и двух идентичных лёгких L-цепей [от англ. light лёгкий]. Тяжёлые и лёгкие цепи Ig состоят из аминокислотных остатков и соединены дисульфидными (-S-S-) связями. В цепях различают вариабельную область, или V-область [от англ. various, разный], и константную область, или С-область [Fc-фрагмент]. V-область у разных AT варьирует. V-области L- и Н-цепей образуют Аг-связывающий центр (активный центр AT, паратоп), или Fab-фрагмент.
В месте соединения Fab- и Fc-фрагментов расположена шарнирная область, позволяющая Аг-связывающим фрагментам разворачиваться для более тесного контакта с Аг.
Область молекулы антител (Fab) определяет антигенную специфичность, а Fc осуществляет эффекторные функции.
Константные участки лёгких цепей бывают двух типов — каппа (к) и ламбда; константные участи тяжёлых цепей представлены пятью основными формами — мю (р), гамма (у), дельта (8), альфа (а) и эпсилон (е). Каждая из них ассоциирована с отдельным классом Ig. Выделяют 5 классов AT: IgA, IgD, IgE, IgG и IgM .
Молекулы IgG, IgD и IgE представлены мономерами, IgM — пентамерами; молекулы IgA в сыворотке крови — мономеры, а в экскретируемых жидкостях (слёзная жидкость, слюна, секреты слизистых оболочек) — димеры.
IgM синтезируются при первичном попадании Аг в организм. Пик образования приходится на 4-5-е сутки с последующим снижением титра. Наличие IgM к Аг конкретного возбудителя указывает на острый инфекционный процесс.
Молекула IgM — пентамер; пять субъединиц соединены J-цепью [от англ. joining, связывающий], в результате чего молекула IgM приобретает 10 Аг-связывающих участков.
Молекулы IgM опсонизируют, агглютинируют, преципитируют и лизируют содержащие Аг структуры, а также активируют систему комплемента по классическому пути (для комплементзависимого лизиса бактерии достаточно одной молекулы IgM).
Иммуноглобулин G ( IgG ) — основной класс AT (до 75% всех Ig), защищающий организм от бактерий, вирусов и токсинов. После первичного контакта с Аг синтез IgM обычно сменяется образованием IgG.
Максимальные титры IgG при первичном ответе наблюдают на 6-8-е сутки. Обнаружение высоких титров IgG к Аг конкретного возбудителя указывает на то, что конкретное заболевание перенесено недавно. В особо больших количествах IgG синтезируется при вторичном ответе.
IgG представлены 4 подклассами: IgG1, IgG2, IgG3 и IgG4. IgG непосредственно участвуют в реакциях иммунного цитолиза, реакциях нейтрализации, а также усиливают фагоцитоз, действуя как опсонины и связывая рецепторы Fc-фрагмента в мембране фагоцитирующих клеток (в результате этого фагоциты эффективнее поглощают и лизируют микроорганизмы).
Только IgG способны проникать через плаценту, что обеспечивает формирование у плода пассивного иммунитета.
Иммуноглобулины А ( IgA ) циркулируют в сыворотке крови (составляет 15-20% от всех Ig), а также секретируются на поверхность эпителия. Присутствуют в слюне, слёзной жидкости, молоке и на поверхности слизистых оболочек.
AT класса IgА усиливают защитные свойства слизистых оболочек пищеварительного тракта, дыхательных, половых и мочевыделительных путей. В сыворотке крови IgA циркулируют в виде двухвалентных мономеров; в секретируемых жидкостях преобладают четырёхвалентные димеры, содержащие одну J-цепь и дополнительную полипептидную молекулу (синтезируемый эпителиальными клетками секреторный компонент).
Молекулы IgA участвуют в реакциях нейтрализации и агглютинации возбудителей. Кроме того, после образования комплекса Аг-АТ они участвуют в активации комплемента по альтернативному пути.
Иммуноглобулин Е ( IgE ) специфически взаимодействуют с тучными клетками и базофильными лейкоцитами, содержащими многочисленные гранулы с БАВ. Их выделение из клетки (дегрануляция) вызывает резкое расширение просвета венул и увеличение проницаемости их стенки. Подобную картину можно наблюдать при аллергических реакциях (например, бронхиальной астме, аллергическом рините, крапивнице).
Защитные свойства IgE направлены преимущественно против гельминтов (нематод). Синтез IgE увеличивается при паразитарных инвазиях, IgE-моноклональной миеломе, а также первичных иммунодефицитах (атаксия-телеангиэктазия, синдромы Вискотта-Олдрича, Незелбфа, Ди Джорджи).
Иммуноглобулин D ( IgD ). Биологическая роль этой разновидности AT не установлена. IgD обнаруживают на поверхности развивающихся В-лимфоцитов; в сыворотке крови здоровых лиц присутствует в очень низкой концентрации. Содержание IgD достигает максимума к 10 годам жизни; некоторое увеличение титров отмечают при беременности, у больных бронхиальной астмой, системной красной волчанкой и лиц с иммунодефицитами.
Основные функции антител ( АТ )
Антитела ( АТ ) через Ar-связываюшие центры взаимодействуют с различными Аг. Тем самым AT предотвращают инфицирование или элиминируют возбудителя либо блокируют развитие патологических реакций, активируя при этом все системы специфической защиты.
Опсонизация (иммунный фагоцитоз).
Антитоксический эффект. Антитела ( АТ ) могут связывать и, тем самым, инактивировать бактериальные токсины.
Активация комплемента. Антитела ( АТ ) (IgM и IgG) после связывания с Аг (микроорганизм, опухолевая клетка и др.) активируют систему комплемента, что приводит к уничтожению этой клетки путём перфорации её клеточной стенки, усиления хемотаксиса, хемокинеза и иммунного фагоцитоза.
Нейтрализация. Взаимодействуя с рецепторами клетки, связывающими бактерии или вирусы, AT могут препятствовать адгезии и проникновению микроорганизмов в клетки организма-хозяина.
Циркулирующие иммунные комплексы. Антитела ( АТ ) связывают растворимые Аг и образуют циркулирующие комплексы, с помощью которых Аг выводится из организма, преимущественно с мочой и желчью.
Антителозависимая цитотоксичность. Опсонизируя Аг, антитела ( АТ ) стимулируют их разрушение цитотоксическими клетками. (макрофаги и гранулоциты (например, нейтрофилы).
Классы иммуноглобулинов, их характеристика.
Антигены: определение, основные свойства. Антигены бактериальной клетки.
Антиген – это биополимер органической природы, генетически чужеродный для макроорганизма, который при попадании в последний распознаётся его иммунной системой и вызывает иммунные реакции, направленные на его устранение.
Антигены обладают рядом характерных свойств: антигенностью, специфичностью и иммуногенностью.
У антигенов есть 2 главных свойства:
иммуногенность — способность вызывать реакцию (ответ) иммунной системы.
антигенность — способность избирательно взаимодействовать со специфичными антителами или антиген-распознающими рецепторами лимфоцитов.
Степень иммуногенности зависит от ряда факторов, которые можно объединить в три группы: К первой группе факторов отнесены природа, химический состав, молекулярный вес, структура и некоторые другие характеристики.
Иммуногенность в значительной степени зависит от природы антигена. Важна также оптическая изомерия аминокислот, составляющих молекулу белка. Большое значение имеет размер и молекулярная масса антигена. На степень иммуногенности также оказывает влияние пространственная структура антигена. Оказалась также существенной стерическая стабильность молекулы антигена. Еще одним важным условием иммуногенности является растворимость антигена.
Вторая группа факторов связана с динамикой поступления антигена в организм и его выведения. Так, хорошо известна зависимость иммуногенности антигена от способа его введения. На иммунный ответ влияет количество поступающего антигена: чем его больше, тем более выражен иммунный ответ.
Третья группа объединяет факторы, определяющие зависимость иммуногенности от состояния макроорганизма. В этой связи на первый план выступают наследственные факторы.
Антигенная специфичность и антигенное строение бактерий.
Антигенными свойствами обладают жгутики, капсула, клеточная стенка, цитоплазматическая мембрана, рибосомы и другие компоненты цитоплазмы, токсины, ферменты.
Основными видами бактериальных антигенов являются:
- соматические или О- антигены (у грамотрицательных бактерий специфичность определяется дезоксисахарами полисахаридов ЛПС);
- жгутиковые или Н- антигены (белковые);
- поверхностные или капсульные К- антигены.
Выделяют протективные антигены, обеспечивающие защиту (протекцию) против соответствующих инфекций, что используется для создания вакцин.
По специфичности микробные антигены делятся на:
перекрестно-реагирующие (гетероантигены) - это антигены общие с антигенами тканей и органов человека. Они имеются у многих микроорганизмов и рассматриваются как важный фактор вирулентности и пусковой механизм развития аутоиммунных процессов;
группоспецифические - общие у микроорганизмов одного рода или семейства;
видоспецифические - общие у разных штаммов одного вида микроорганизмов;
вариантспецифические (типоспецифические) - встречаются у отдельных штаммов внутри вида микроорганизмов. По наличию тех или иных вариантспецифических антигенов микроорганизмы внутри вида делят на варианты по антигенному строению - серовары.
По локализации антигены бактерий делятся на:
целлюлярные (связанные с клеткой),
экстрацеллюлярные (не связанные с клеткой).
Антителообразование: первичный и вторичный ответ.
Если организм впервые встречается с Аг, то развивается первичный иммунный ответ, а при повторном контакте — вторичный ответ
Первичный иммунный ответ
латентный период продолжительностью 3~5 сут. В это время происходит распознавание Аг и образование клонов плазматических клеток.
Затем наступает логарифмическая фаза, соответствующая поступлению антител ( АТ ) в кровь; её продолжительность — 7-15 сут. Постепенно титры антител ( АТ ) достигают пика и
наступает стационарная фаза, продолжительностью 15-30 сут.
Её сменяет фаза снижения титров AT, длящаяся 1-6 мес.
В основу пролиферации клеток-продуцентов AT заложен принцип селекции. В динамике антителообразования титры высокоаффинных AT постепенно нарастают: после иммунизации аффинность AT к Аг постоянно увеличивается. Первоначально образуются IgM, но постепенно их образование уменьшается и начинает преобладать синтез IgG. Так как переключение синтезов от IgM к IgG не меняет идиотипа AT (то есть его специфичность по отношению к конкретному Аг), то оно не связано с клональной селекцией. Особенности первичного ответа — низкая скорость антитело -образования и появление сравнительно невысоких титров AT.
Вторичный иммунный ответ
После антигенной стимуляции часть В- и Т-лимфоцитов циркулирует в виде клеток памяти. Особенность вторичного иммунного ответа — высокая скорость антителообразования, появление максимальных титров антител (АТ) и длительное (иногда многолетнее) их циркулирование.
Основные характеристики вторичного имунного ответа:
• образование антител ( АТ ) индуцируется значительно меньшими дозами Аг;
• индуктивная фаза сокращается до 5-6 ч;
• среди антител ( АТ ) доминируют IgG с большой аффинностью, пик их образования наступает раньше (3-5 сут);
• Антитела ( АТ ) образуются в более высоких титрах и циркулируют в организме длительное время.
Иммунологическая память. Иммунологическая толерантность.
Иммунологическая память. При повторной встрече с антигеном организм формирует более активную и быструю иммунную реакцию — вторичный иммунный ответ. Этот феномен получил название иммунологической памяти.
Иммунологическая память имеет высокую специфичность к конкретному антигену, распространяется как на гуморальное, так и клеточное звено иммунитета и обусловлена В- и Т-лимфоцитами. Она образуется практически всегда и сохраняется годами и даже десятилетиями. Благодаря ней наш организм надежно защищен от повторных антигенных интервенций.
На сегодняшний день рассматривают два наиболее вероятных механизма формирования иммунологической памяти. Один из них предполагает длительное сохранение антигена в организме. Этому имеется множество примеров: инкапсулированный возбудитель туберкулеза, персистирующие вирусы кори, полиомиелита, ветряной оспы и некоторые другие патогены длительное время, иногда всю жизнь, сохраняются в организме, поддерживая в напряжении иммунную систему. Вероятно также наличие долгоживущих дендритных АПК, способных длительно сохранять и презентировать антиген.
Другой механизм предусматривает, что в процессе развития в организме продуктивного иммунного ответа часть антигенореактивных Т- или В-лимфоцитов дифференцируется в малые покоящиеся клетки, или клетки иммунологической памяти. Эти клетки отличаются высокой специфичностью к конкретной антигенной детерминанте и большой продолжительностью жизни (до 10 лет и более). Они активно рециркулируют в организме, распределяясь в тканях и органах, но постоянно возвращаются в места своего происхождения за счет хоминговых рецепторов. Это обеспечивает постоянную готовность иммунной системы реагировать на повторный контакт с антигеном по вторичному типу.
Феномен иммунологической памяти широко используется в практике вакцинации людей для создания напряженного иммунитета и поддержания его длительное время на защитном уровне. Осуществляют это 2—3-кратными прививками при первичной вакцинации и периодическими повторными введениями вакцинного препарата — ревакцинациями.
Однако феномен иммунологической памяти имеет и отрицательные стороны. Например, повторная попытка трансплантировать уже однажды отторгнутую ткань вызывает быструю и бурную реакцию — криз отторжения.
Иммунологическая толерантность — явление, противоположное иммунному ответу и иммунологической памяти. Проявляется она отсутствием специфического продуктивного иммунного ответа организма на антиген в связи с неспособностью его распознавания.
В отличие от иммуносупрессии иммунологическая толерантность предполагает изначальную ареактивность иммунокомпетентных клеток к определенному антигену.
Иммунологическую толерантность вызывают антигены, которые получили название толерогены. Ими могут быть практически все вещества, однако наибольшей толерогенностью обладают полисахариды.
Иммунологическая толерантность бывает врожденной и приобретенной. Примером врожденной толерантности является отсутствие реакции иммунной системы на свои собственные антигены. Приобретенную толерантность можно создать, вводя в организм вещества, подавляющие иммунитет (иммунодепрессанты), или же путем введения антигена в эмбриональном периоде или в первые дни после рождения индивидуума. Приобретенная толерантность может быть активной и пассивной. Активная толерантность создается путем введения в организм толерогена, который формирует специфическую толерантность. Пассивную толерантность можно вызвать веществами, тормозящими биосинтетическую или пролиферативную активность иммунокомпетентных клеток (антилимфоцитарная сыворотка, цитостатики и пр.).
Иммунологическая толерантность отличается специфичностью — она направлена к строго определенным антигенам. По степени распространенности различают поливалентную и расщепленную толерантность. Поливалентная толерантность возникает одновременно на все антигенные детерминанты, входящие в состав конкретного антигена. Для расщепленной, или моновалентной, толерантности характерна избирательная невосприимчивость каких-то отдельных антигенных детерминант.
Степень проявления иммунологической толерантности существенно зависит от ряда свойств макроорганизма и толерогена.
Важное значение в индукции иммунологической толерантности имеют доза антигена и продолжительность его воздействия. Различают высокодозовую и низкодозовую толерантность. Высокодозовую толерантность вызывают введением больших количеств высококонцентрированного антигена. Низкодозовая толерантность, наоборот, вызывается очень малым количеством вы-сокогомогенного молекулярного антигена.
Механизмы толерантности многообразны и до конца не расшифрованы. Известно, что ее основу составляют нормальные процессы регуляции иммунной системы. Выделяют три наиболее вероятные причины развития иммунологической толерантности:
1. Элиминация из организма антигенспецифических клонов лимфоцитов.
2. Блокада биологической активности им-мунокомпетентных клеток.
3. Быстрая нейтрализация антигена антителами.
Феномен иммунологической толерантности имеет большое практическое значение. Он используется для решения многих важных проблем медицины, таких как пересадка органов и тканей, подавление аутоиммунных реакций, лечение аллергий и других патологических состояний, связанных с агрессивным поведением иммунной системы.
Теории иммунитета.
Теория иммунитета Мечникова - теория, согласно которой решающая роль в антибактериальном иммунитете принадлежит фагоцитозу.
Сначала И.И.Мечников как зоолог экспериментально изучал морских беспозвоночных фауны Черного моря в Одессе и обратил внимание на то, что определенные клетки (целомоциты) этих животных поглощают инородные субстанции (твердые частицы и бактерий), проникшие во внутреннюю среду. Затем он увидел аналогию между этим явлением и поглощением белыми клетками крови позвоночных животных микробных телец. Эти процессы наблюдали и до И.И.Мечникова другие микроскописты. Но только И.И.Мечников осознал, что это явление не есть процесс питания данной единичной клетки, а есть защитный процесс в интересах целого организма. И.И.Мечников первым рассматривал воспаление как защитное, а не разрушительное явление. Против теории И.И.Мечникова в начале XX в. были большинство патологов, так как они наблюдали фагоцитоз в очагах воспаления, т.е. в больных местах, и считали лейкоциты (гной) болезнетворными, а не защитными клетками. Более того, некоторые полагали, что фагоциты — разносчики бактерий по организму, ответственные за диссеминацию инфекций. Но идеи И.И.Мечникова устояли; ученый назвал действующие таким образом защитные клетки "пожирающими клетками". Его молодые французские коллеги предложили использовать греческие корни того же значения. И.И.Мечников принял этот вариант, и появился термин "фагоцит". Эти работы и теория Мечникова чрезвычайно понравились Л.Пастеру, и он пригласил Илью Ильича работать в свой институт в Париже.
Теория иммунитета Эрлиха — одна из первых теорий антителообразования, согласно которой у клеток имеются антигенспецифические рецепторы, высвобождающиеся в качестве антител под действием антигена.
В статье Пауля Эрлиха противомикробные вещества крови автор назвал термином "антитело", так как бактерий в то время называли термином "korper" — микроскопические тельца. Но П.Эрлиха "посетило" глубокое теоретическое прозрение. Несмотря на то, что факты того времени свидетельствовали, что в крови неконтактировавшего с конкретным микробом животного или человека не определяются антитела против данного микроба, П.Эрлих каким-то образом осознал, что и до контакта с конкретным микробом в организме уже есть антитела в виде, который он назвал "боковыми цепями". Как мы теперь знаем, это именно так, и "боковые цепи" Эрлиха — это подробно изученные в наше время рецепторы лимфоцитов для антигенов. Позже этот же образ мыслей П.Эрлих "применил" к фармакологии: в своей теории химиотерапии он предполагал предсуществование в организме рецепторов для лекарственных веществ. В 1908 г. П.Эрлиху вручили Нобелевскую премию за гуморальную теорию иммунитета.
Также есть ещё некоторые теории.
Теория иммунитета Безредки - теория, объясняющая защиту организма от ряда инфекционных болезней возникновением специфической местной невосприимчивости клеток к возбудителям.
Инструктивные теории иммунитета — общее название теорий антителообразования, согласно которым ведущая роль в иммунном ответе отводится антигену, прямо участвующему в качестве матрицы при формировании специфической конфигурации антидетерминанты либо выступающему в качестве фактора, направленно изменяющего биосинтез иммуноглобулинов плазматическими клетками.
Особенности противовирусного, противоопухолевого, трансплантационного иммунитета.
Противовирусный иммунитет. Основой противовирусного иммунитета является клеточный иммунитет. Клетки-мишени, инфицированные вирусом, уничтожаются цитотоксическими лимфоцитами, а также NK-клетками и фагоцитами, взаимодействующими с Fc-фрагментами антител, прикрепленных к вирусспецифическим белкам инфицированной клетки. Противовирусные антитела способны нейтрализовать только внеклеточно расположенные вирусы, как и факторы неспецифического иммунитета — сывороточные противовирусные ингибиторы. Такие вирусы, окруженные и блокированные белками организма, поглощаются фагоцитами или выводятся с мочой, потом и др. (так называемый «выделительный иммунитет»). Интерфероны усиливают противовирусную резистентность, индуцируя в клетках синтез ферментов, подавляющих образование нуклеиновых кислот и белков вирусов. Кроме этого, интерфероны оказывают иммуномодулирующее действие, усиливают в клетках экспрессию антигенов главного комплекса гистосовместимости (МНС). Противовирусная защита слизистых оболочек обусловлена секреторными IgA, которые, взаимодействуя с вирусами, препятствуют их адгезии на эпителиоцитах.
Противоопухолевый иммунитет основан на Th1-зависимом клеточном иммунном ответе, активирующем цитотоксические Т-лимфоциты, макрофаги и NK-клетки. Роль гуморального (антительного) иммунного ответа невелика, поскольку антитела, соединяясь с антигенными детерминантами на опухолевых клетках, экранируют их от цитопатогенного действиях иммунных лимфоцитов. Опухолевый антиген распознается антигенпрезентирующими клетками (дендритными клетками и макрофагами) и непосредственно или через Т-хелперы (Th1) представляется цитотоксическим Т-лимфоцитам, разрушающим опухолевую клетку-мишень.
Кроме специфического противоопухолевого иммунитета, иммунный надзор за нормальным составом тканей реализуется за счет неспецифических факторов. Неспецифические факторы, повреждающие опухолевые клетки: 1) NK-клетки, система мононуклеарных клеток, противоопухолевая активность которых усиливается под воздействием интерлейкина-2 (ИЛ-2) и α-, β-интерферонов; 2) ЛАК-клетки (мононуклеарные клетки и NK-клетки, активированные ИЛ-2); 3) цитокины (α - и β -интерфероны, ФНО- α и ИЛ-2).
Трансплантационным иммунитетом называют иммунную реакцию макроорганизма, направленную против пересаженной в него чужеродной ткани (трансплантата). Знание механизмов трансплантационного иммунитета необходимо для решения одной из важнейших проблем современной медицины — пересадки органов и тканей. Многолетний опыт показал, что успех операции по пересадке чужеродных органов и тканей в подавляющем большинстве случаев зависит от иммунологической совместимости тканей донора и реципиента.
Иммунная реакция на чужеродные клетки и ткани обусловлена тем, что в их составе содержатся генетически чужеродные для организма антигены. Эти антигены, получившие название трансплантационных или антигенов гистосовместимости, наиболее полно представлены на ЦПМ клеток.
Реакция отторжения не возникает в случае полной совместимости донора и реципиента по антигенам гистосовместимости — такое возможно лишь для однояйцовых близнецов. Выраженность реакции отторжения во многом зависит от степени чужеродности, объема трансплантируемого материала и состояния иммунореактивности реципиента.
При контакте с чужеродными трансплантационными антигенами организм реагирует факторами клеточного и гуморального звеньев иммунитета. Основным фактором клеточного трансплантационного иммунитета являются Т-киллеры. Эти клетки после сенсибилизации антигенами донора мигрируют в ткани трансплантата и оказывают на них антителонезависимую клеточно-опосредованную цитотоксичность.
Специфические антитела, которые образуются на чужеродные антигены (гемагглютинины, гемолизины, лейкотоксины, цитотоксины), имеют важное значение в формировании трансплантационного иммунитета. Они запускают антителоопосредованный цитолиз трансплантата (комплемент-опосредованный и антителозависимая клеточно-опосредованная цитотоксичность).
Возможен адоптивный перенос трансплантационного иммунитета с помощью активированных лимфоцитов или со специфической антисывороткой от сенсибилизированной особи интактному макроорганизму.
Механизм иммунного отторжения пересаженных клеток и тканей имеет две фазы. В первой фазе вокруг трансплантата и сосудов наблюдается скопление иммунокомпетентных клеток (лимфоидная инфильтрация), в том числе Т-киллеров. Во второй фазе происходит деструкция клеток трансплантата Т-киллерами, активируются макрофагальное звено, естественные киллеры, специфический антителогенез. Возникает иммунное воспаление, тромбоз кровеносных сосудов, нарушается питание трансплантата и происходит его гибель. Разрушенные ткани утилизируются фагоцитами.
В процессе реакции отторжения формируется клон Т- и В-клеток иммунной памяти. Повторная попытка пересадки тех же органов и тканей вызывает вторичный иммунный ответ, который протекает очень бурно и быстро заканчивается отторжением трансплантата.
С клинической точки зрения выделяют острое, сверхострое и отсроченное отторжение трансплантата. Различаются они по времени реализации реакции и отдельным механизмам.
Понятие о клинической иммунологии. Иммунный статус человека и факторы, влияющие на него.
Клиническая иммунология - это клиническая и лабораторная дисциплина, занимающаяся изучением вопросов диагностики и лечения больных с различными заболеваниями и патологическими состояниями, в основе которых лежат иммунологические механизмы, а также состояниями, в терапии и профилактике которых иммунопрепараты играют ведущую роль.
Иммунный статус — это структурное и функциональное состояние иммунной системы индивидуума, определяемое комплексом клинических и лабораторных иммунологических показателей.
Таким образом, иммунный статус характеризует анатомо-функциональное состояние иммунной системы, т. е. ее способность к иммунному ответу на определенный антиген в данный момент времени.
На иммунный статус оказывают влияние следующие факторы:
• климато-географические; • социальные; • экологические (физические, химические и биологические); • «медицинские» (влияние лекарственных веществ, оперативные вмешательства, стресс и т. д.).
Среди климато-географических факторов на иммунный статус оказывают влияние температура, влажность, солнечная радиация, длина светового дня и др. Например, фагоцитарная реакция и кожные аллергические пробы менее выражены у жителей северных регионов, чем у южан. Вирус Эпштейна—Барр у людей белой расы вызывает инфекционное заболевание — мононуклеоз, у лиц негроидной расы — онкопатологию (лимфома Беркитта), а у лиц желтой расы — совсем другую онкопатологию (назофарингеальная карцинома), причем только у мужчин. Жители Африки менее подвержены заболеванию дифтерией, чем европейское население.
К социальным факторам, оказывающим влияние на иммунный статус, относятся питание, жилищно-бытовые условия, профессиональные вредности и т. п. Важное значение имеет сбалансированное и рациональное питание, поскольку с пищей в организм поступают вещества, необходимые для синтеза иммуноглобулинов, для построения иммунекомпетентных клеток и их функционирования. Особенно важно, чтобы в рационе присутствовали незаменимые аминокислоть и витамины, особенно А и С.
Значительное влияние на иммунный статус организма оказывают жилищно-бытовые условия. Проживание в плохих жилищных условиях ведет к снижению общей физиологической реактивности, соответственно иммунореактивности, что нередко сопровождается повышением уровня инфекционной заболеваемости.
Большое влияние на иммунный статус оказывают профессиональные вредности, поскольку человек проводит на работе значительную часть своей жизни. К производственным факторам, которые могут оказывать неблагоприятное воздействие на организм и снижать иммунореактивность, относят ионизирующую радиацию, химические вещества, микробы и продукты их жизнедеятельности, температуру, шум, вибрацию и т. д. Источники радиации получили в настоящее время очень широкое распространение в различных отраслях промышленности (энергетика, горнохимическая, аэрокосмическая и др.).
Неблагоприятное влияние на иммунный статус оказывают соли тяжелых металлов, ароматические, алкилирующие соединения и другие химические вещества, в том числе моющие средства, дезинфектанты, пестициды, ядохимикаты, широко применяемые в практике. Таким профессиональным вредностям подвержены работники химических, нефтехимических, металлургических производств и др.
Неблагоприятное влияние на иммунный статус организма оказывают микробы и продукты их жизнедеятельности (чаще всего белки и их комплексы) у работников биотехнологических производств, связанных с производством антибиотиков, вакцин, ферментов, гормонов, кормового белка и др.
Такие факторы, как низкая или высокая температура, шум, вибрация, недостаточная освещенность, могут снижать иммунореактивность, оказывая опосредованное действие на иммунную систему через нервную и эндокринную системы, которые находятся в тесной взаимосвязи с иммунной системой.
Глобальное действие на иммунный статус человека оказывают экологические факторы, в первую очередь, загрязнение окружающей среды радиоактивными веществами (отработанным топливом из ядерных реакторов, утечка радионуклидов из реакторов при авариях), широкое применение пестицидов в сельском хозяйстве, выбросами химических предприятий и автотранспорта, биотехнологических производств.
На иммунный статус оказывают влияние различные диагностические и лечебные медицинские манипуляции, лекарственная терапия, стресс. Необоснованное и частое применение рентгенографии, радиоизотопного сканирования может влиять на иммунную систему. Иммунореактивность изменяется после травм и хирургических операций. Многие лекарственные препараты, в том числе антибиотики, способны оказывать побочное иммунодепрессивное действие, особенно при длительном приеме. Стресс приводит к нарушениям в работе Т-системы иммунитета, действуя, в первую очередь, через ЦНС.
Оценка иммунного статуса: основные показатели и методы их определения.
Несмотря на вариабельность иммунологических показателей в норме, иммунный статус можно определить путем постановки комплекса лабораторных тестов, включающих оценку состояния факторов неспецифической резистентности, гуморального (В-система) и клеточного (Т-система) иммунитета.
Оценка иммунного статуса проводится в клинике при трансплантации органов и тканей, аутоиммунных заболеваниях, аллергиях, для выявления иммунологической недостаточности при различных инфекционных и соматических заболеваниях, для контроля эффективности лечения болезней, связанных с нарушениями иммунной системы. В зависимости от возможностей лаборатории оценка иммунного статуса чаше всего базируется на определении комплекса следующих показателей:
1) общего клинического обследования;
2) состояния факторов естественной резистентности;
3) гуморального иммунитета;
4) клеточного иммунитета;
5) дополнительных тестов.
При общем клиническом обследовании учитывают жалобы пациента, анамнез, клинические симптомы, результаты общего анализа крови (включая абсолютное число лимфоцитов), данные биохимического исследования.
Гуморальный иммунитет определяют по уровню иммуноглобулинов классов G, M, A, D, Е в сыворотке крови, количеству специфических антител, катаболизму иммуноглобулинов, гиперчувствительности немедленного типа, показателю В-лимфоцитов в периферической крови, бласттрансформации В-лимфоцитов под действием В-клеточных митогенов и другим тестам.
Состояние клеточного иммунитета оценивают по количеству Т-лимфоцитов, а также субпопуляций Т-лимфоцитов в периферической крови, бласттрансформации Т-лимфоцитов под действием Т-клеточных митогенов, определению гормонов тимуса, уровню секретируемых цитокинов, а также постановкой кожных проб с аллергенами, контактной сенсибилизацией динитрохлорбензолом. Для постановки кожных аллергических проб используются антигены, к которым в норме должна быть сенсибилизация, например проба Манту с туберкулином. Способность организма к индукции первичного иммунного ответа может дать контактная сенсибилизация динитрохлорбензолом.
В качестве дополнительных тестов для оценки иммунного статуса можно использовать такие тесты, как определение бактерицидное™ сыворотки крови, титрование СЗ-, С4-компонентов комплемента, определение содержания С-реактивного белка в сыворотке крови, определение ревматоидных факторов и других аутоантител.
Таким образом, оценка иммунного статуса проводится на основании постановки большого числа лабораторных тестов, позволяющих оценить состояние как гуморального и клеточного звеньев иммунной системы, так и факторов неспецифической резистентности. Все тесты разделены на две группы: тесты 1-го и 2-го уровня. Тесты 1-го уровня могут быть выполнены в любой клинической иммунологической лаборатории первичного звена здравоохранения, они используются для первичного выявления лиц с явно выраженной иммунопатологией. Для более точной диагностики используются тесты 2-го уровня.
ДВА УРОВНЯ МЕТОДОВ ИССЛЕДОВАНИЯ ИММУННОГО СТАТУСА
ПЕРВЫЙ УРОВЕНЬ
Определение:
1) абсолютного и относительного числа лимфоцитов;
2) абсолютного и относительного числа Т- и В-лимфоцитов;
3) фагоцитарной активности лейкоцитов;
4) Уровня содержания IgA, IgM, IgG.
ВТОРОЙ УРОВЕНЬ
Определение:
1) количества Т- и В-лимфоцитов, Т-хелперных, Т-супрессорных/ цитотоксические лимфоциты;
2) пролиферативной активности лимфоцитов;
3) функциональной активности естественных киллеров;
4) комплемента;
5) Торможения миграции лейкоцитов
Расстройства иммунной системы: первичные и вторичные иммунодефициты.
Иммунодефициты — это нарушения нормального иммунного статуса, обусловленные дефектом одного или нескольких механизмов иммунного ответа.
Различают первичные, или врожденные (генетические), и вторичные, или приобретенные, иммунодефициты.
Первичные, или врожденные, иммунодефициты.
В качестве первичных иммунодефицитов выделяют такие состояния, при которых нарушение иммунных гуморальных и клеточных механизмов связано с генетическим блоком, т. е. генетически обусловлено неспособностью организма реализовывать то или иное звено иммунологической реактивности. Расстройства иммунной системы могут затрагивать как основные специфические звенья в функционировании иммунной системы, так и факторы, определяющие неспецифическую резистентность. Возможны комбинированные и селективные варианты иммунных расстройств. В зависимости от уровня и характера нарушений различают гуморальные, клеточные и комбинированные иммунодефициты.
Врожденные иммунодефицитные синдромы и заболевания представляют собой довольно редкое явление. Причинами врожденных иммунодефицитов могут быть удвоение хромосом, точечные мутации, дефект ферментов обмена нуклеиновых кислот, генетически обусловленные нарушения мембран, повреждения генома в эмбриональном периоде и др. Как правило, первичные иммунодефицита проявляются на ранних этапах постнатального периода и наследуются по аутосомно-рецессивному типу. Проявляться первичные иммунодефициты могут в виде недостаточности фагоцитоза, системы комплемента, гуморального иммунитета (В-системы), клеточного иммунитета (Т-системы) или же в виде комбинированной иммунологической недостаточности.
Вторичные, или приобретенные, иммунодефициты
Вторичные иммунодефициты в отличие от первичных развиваются у лиц с нормально функционировавшей от рождения иммунной системой. Они формируются под воздействием окружающей среды на уровне фенотипа и обусловлены нарушением функции иммунной системы в результате различных заболеваний или неблагоприятных воздействий на организм. При вторичных иммунодефицитах могут поражаться Т- и В-системы иммунитета, факторы неспецифической резистентности, возможны также их сочетания. Вторичные иммунодефицита встречаются значительно чаще, чем первичные. Вторичные иммунодефицита, как правило, преходящи и поддаются иммунокоррекции, т. е. восстановлению нормальной деятельности иммунной системы.
Вторичные иммунодефицита могут быть: после перенесенных инфекций (особенно вирусных) и инвазий (протозойные и гельминтозы); при ожоговой болезни; при уремии; при опухолях; при нарушении обмена веществ и истощении; при дисбиозах; при тяжелых травмах, обширных хирургических операциях, особенно выполняемых под общим наркозом; при облучении, действии химических веществ; при старении, а также медикаментозные, связанные с приемом лекарств.
По времени возникновения выделяют антенатальные (например, ненаследственные формы синдрома ДиДжорджи), перинатальные (например, нейтропения новорожденного, вызванная изосенсибилизацией матери к антигенам нейтрофилов плода) и постнатальные вторичные иммунодефицита.
По клиническому течению выделяют компенсированную, субкомпенсированную и декомпенсированную формы вторичных иммуноде-фицитов. Компенсированная форма сопровождается повышенной восприимчивостью организма к инфекционным агентам, вызывающим оппортунистические инфекции. Субкомпенсированная форма характеризуется склонностью к хронизации инфекционных процессов. Декомпенсированная форма проявляется в виде генерализованных инфекций, вызванных условно-патогенными микробами (УПМ) и злокачественными новообразованиями.
Известно разделение вторичных иммунодефицитов на:
Физиологические, новорожденные, пубертатного периода, беременности и лактации, старения, биоритмичности, экологические, сезонные, эндогенные интоксикации, радиационные, СВЧ, патологические, постинфекционные, стрессовые, регуляторно-метаболические, медикаментозные, онкологические.
Иммунодефициты, как первичные, так и особенно вторичные, широко распространены среди людей. Они являются причиной проявления многих болезней и патологических состояний, поэтому требуют профилактики и лечения с помощью иммунотропных препаратов.
Аутоиммунные процессы.
Иммунная система способна реагировать на огромное число разнообразных агентов, и поскольку репертуар специфичностей B- и T-клеток формируется случайным образом, он неизбежно включает множество молекул, специфичных к компонентам собственного организма. Для предупреждения аутореактивности действуют необходимые механизмы аутотолерантности, позволяющие различать "свои" и "несвои" антигенные детерминанты. Однако, как и в любой системе, при работе механизмов аутотолерантности существует риск нарушений. Известен целый ряд аутоиммунных заболеваний, обусловленных избыточным образованием аутоантител и аутореактивных T-клеток (антител и Т-клеток, способных взаимодействовать с собственными антигенами и разрушать клетки и ткани, обладающие этими антигенами).
Возникший аутоиммунный процесс - явление в значительной степени хроническое, приводящее в долговременному повреждению тканей. Связано это в первую очередь с тем, что аутоиммунная реакция постоянно поддерживается тканевыми антигенами.
Механизм аутоиммунного разрушения клеток и тканей не отличим от того, который действует в условиях нормы при адаптивном иммунитете и включает как специфические антитела различных классов , так и субпопуляции Т-клеток , способных реагировать на собственные антигены.
К числу известных факторов, обеспечивающих запуск запрещенных клонов в реакционный ответ, относятся, безусловно, генетические факторы. Существует определенная коррелятивная связь между определенными гаплотипами HLA и относительным риском аутоиммунного поражения; но вероятнее, что при любом из таких заболеваний имеют значение несколько генетических факторов. Кроме того, провоцирующими сигналами для инициации иммунного ответа к собственным антигенам могут служить перекрестнореагирующие микробные антигены, нарушения в цитокиновой сети регуляции и факторы внешней среды.
В большинстве случаев при заболеваниях, сопровождающихся продукцией аутоантител, именно аутоантитела являются причиной патологического процесса. Но иногда аутоантитела образуются вследствие повреждения тканей, вызванного тем или иным патологическим состоянием (например, при инфаркте миокарда ). Однако простая травма , приводящая к высвобождению аутоантигенов, редко индуцирует образование аутоантител.
В некоторых случаях аутоантитела реагируют с компонентами одного органа, и поэтому развивающийся патологический процесс носит сугубо локальный характер. Напротив, при таких заболеваниях, как системная красная волчанка (СКВ) , сыворотка реагирует с компонентами многих, если не всех, тканей организма.
Нередко у одного человека может быть сразу несколько аутоиммунных заболеваний.
Различают аутоиммунные реакции и аутоиммунные заболевания, в основе которых лежит взаимодействие компонентов иммунной системы с собственными здоровыми клетками и тканями. Аутоиммунные реакции наблюдаются в норме у здоровых лиц, а также при патологии. В первом случае они протекают непрерывно, и их действие сводится к удалению отмирающих, стареющих, больных, модифицированных какими-либо воздействиями клеток. Они являются начальным компонентом развертывания иммунного ответа на различные антигены. Эти реакции полезны для организма и не перерастают в болезнь.
Аутоиммунные болезни, или аутоаллергия, встречаются реже. В основе этих патологических состояний лежат аутоиммунные реакции с забарьерными перекрестно реагирующими антигенами, образование «запретных» клонов иммунокомпетентных клеток, реагирующих с собственными нормальными тканями, генетически запрограммированная слабость иммунного ответа на конкретный антиген, недостаточность Т-супрессоров, блокада рецепторов лимфоцитов и другие причины. Они могут быть также следствием приема лекарственных препаратов.
Аутоиммунные заболевания бывают органоспецифическими, неорганоспецифическими и смешанными.
К органоспецифическим относят болезни, при которых аутоантитела реагируют с компонентами одного органа, и поэтому развивающийся патологический процесс носит сугубо локальный характер. Чаще всего это забарьерные антигены, врожденная толерантность к которым отсутствует, например, в случае тиреоидита Хашимото, первичной микседемы, тиреотоксикоза, пернициозной анемии и др.
Органами-мишенями при органоспецифических заболеваниях часто оказываются щитовидная железа, надпочечники, желудок и поджелудочная железа. Семейные аутоиммунные заболевания чаще всего относятся именно к таким заболеваниям.
К органонеспецифическим заболеваниям относятся патологические процессы, при которых аутоантитела реагируют, как указывалось, со структурными элементами клеток и тканей данного или даже другого организма, имеющего перекрестные антигенные структуры, примером которых могут служить антинуклеарные антитела при системной красной волчанке, ревматоидном артрите.
При органонеспецифических болезнях, в том числе ревматологических, обычно возникают поражения кожи, почек, суставов и мышц.
Смешанные болезни включают оба вышеперечисленных механизма.
Довольно часто можно обнаружить нормальные аутоантитела, не вызывающие видимых симптомов заболевания. Они встречаются у совершенно здоровых людей, например, ревматоидный и антинуклеарные факторы. Довольно трудно бывает доказать, что видимая клиническая картина заболевания представляет собой следствие аутоиммунного процесса. Обнаружение антител к аутоантигенам еще не позволяет сделать вывод о причинно-следственной связи заболевания с аутоиммунными реакциями. Для подтверждения этого необходимо: выявить иммунный ответ на аутоантиген, имеющий отношение к заболеванию; идентифицировать его; пассивно перенести заболевание и спровоцировать болезнь соответствующим антигеном в эксперименте на животных.
Классическим примером аутоиммунного заболевания считается аутоиммунный тиреоидит Хашимото. Это незаметно начинающееся, диффузное увеличение щитовидной железы, которое сопровождается снижением ее функции. Женщин заболевание поражает чаще, чем мужчин. Практически во всех случаях аутоиммунного тиреоидита обнаруживаются высокие титры антител к антигенам щитовидной железы, прежде всего к тиреоглобулину и микросомальному антигену. Антитела определяют в РПГА или реакции иммунофлюоресценции (РИФ). Часто обнаруживаются также антинуклеарные антитела. Патогенез тиреоидита Хашимото до конца не выяснен. Несмотря на то, что аутоантитела к антигенам щитовидной железы относятся к классу IgG и могут проходить через плаценту, у детей, родившихся от больных матерей, не обнаруживаются заметные симптомы заболевания. При тиреоидите Хашимото появляются лимфоциты, сенсибилизированные к тиреоглобулину и микросомному антигену, поэтому можно считать, что в основе заболевания лежат главным образом иммунные реакции, опосредованные клетками.
Системная красная волчанка – заболевание кожи и соединительной ткани внутренних органов, в основе которого лежит васкулит, обусловленный иммунными комплексами. Клинические симптомы зависят от того, какая система органов поражена, и отличаются исключительным разнообразием. На передний план выступают патологические изменения кожи, суставов и почек. Возможно увеличение селезенки и лимфатических узлов, а также симптомы со стороны ЖКТ и нервной системы. В крови отмечается лейкопения. Иммунологическим критерием заболевания служат аутоантитела IgG к нативной двухцепочечной ДНК, которые находят почти во всех случаях. Можно обнаружить также антитела к другим ядерным и органоспецифическим антигенам в зависимости от локализации поражений. Часто наблюдаются иммуногемолитические осложнения. Концентрация компонентов комплемента С3 и С4 в сыворотке снижена, уровень IgG повышен. Видимо, вследствие вирусной инфекции или дисрегуляции В-клеток при красной волчанке образуются аутоантитела к ДНК, которые, реагируя с соответствующим антигеном ядер, образуют растворимые иммунные комплексы, связывающие комплемент. Эти комплексы и служат причиной васкулита и нефропатии, характерных для красной волчанки. При этом заболевании выявляется частичная недостаточность клеточного иммунитета в сочетании с избыточной активностью гуморального.
Ревматоидный артрит – это общее хроническое воспалительное заболевание с преимущественным поражением суставов. Оно протекает с повторными обострениями и ремиссиями или постоянно прогрессирует, приводя к тугоподвижности суставов, прежде всего кистей и стоп. При ревматоидном артрите происходит отложение активирующих комплемент иммунных комплексов в сосудах и в синовиальной оболочке суставов. Помимо суставов, в процесс вовлекаются сердце, почки, легкие, ткани глаза и другие органы. Типичным иммунодиагностическим признаком болезни считается обнаружение в сыворотке ревматоидных факторов, которые представляют собой аутоантитела преимущественно IgM к собственным IgG. Ревматоидные факторы характерны не только для ревматоидного артрита, они встречаются и при других коллагенозах и даже при отсутствии явных патологических симптомов, особенно в старости. При ревматоидном артрите выявляются и другие аутоантитела, например, антиколлагеновые или антинуклеарные.
(РЕАКЦИИ ИММУНИТЕТА)
Реакция агглютинации. Компоненты, механизм, способы постановки. Применение.
В этих реакциях принимают участие антигены в виде частиц (микробные клетки, эритроциты и другие корпускулярные антигены), которые склеиваются антителами и выпадают в осадок.
Для постановки реакции агглютинации (РА) необходимы три компонента: 1) антиген (агглютиноген);
2) антитело (агглютинин)
3) электролит (изотонический раствор натрия хлорида).
Ориентировочная реакция агглютинации (РА)
Ориентировочная, или пластинчатая, РА ставится на предметном стекле при комнатной температуре. Для этого пастеровской пипеткой на стекло наносят раздельно каплю сыворотки в разведении 1:10 - 1:20 и контрольную каплю изотонического раствора натрия хлорида. В ту и другую бактериологической петлей вносят колонии или суточную культуру бактерий (каплю диагностикума) и тщательно перемешивают их. Реакции учитывают через несколько минут визуально, иногда с помощью лупы (х5). При положительной РА в капле с сывороткой отмечают появление крупных и мелких хлопьев, при отрицательной - сыворотка остается равномерно мутной.

Рис. 2. Ориентировочная реакция агглютинации.
Развернутая реакция агглютинации с целью выявления титра специфических антител у больного.
Развернутая РА для серодиагностики ставится в сыворотке больных. Ее разводят и изотоническом растворе натрия хлорида от 1:50 - 1:100 до 1:800 или 1: 1600. Так как в более низких титрах сыворотки могут находиться нормальные агглютинины, имеющиеся у здоровых людей или больных с другим диагнозом (диагностический титр). В качестве антигена в этой реакции используют диагностикумы - заведомо известные взвеси, как правило, убитых бактерий.
В агглютинационные пробирки предварительно разливают по 1 мл изотонического раствора натрия хлорида. В первую из них доливают 1 мл сыворотки, разведенной 1:100, и, смешав ее, 1 мл переносят во вторую, из второй - в третью и т.д. В полученные двухкратные разведения сывороток (от 1:100 до 1:1600 и более) вносят по 1-2 капли взвеси бактерий, содержащей 3 млрд микробных тел в 1 мл. Пробирки встряхивают и помещают в термостат при 37°С на 2 часа, затем сутки выдерживают при комнатной температуре.
Учет реакции развернутой агглютинации производят, оценивая последовательно каждую пробирку, начиная с контрольных, при осторожном встряхивании. В контрольных пробирках агглютинации не должно быть. Интенсивность реакции агглютинации отмечают следующими знаками: ++++ - полная агглютинация (хлопья агглютината в абсолютной прозрачной жидкости); +++ - неполная агглютинация (хлопья в слабоопалесцирующей жидкости); ++ - частичная агглютинация (хлопья четко различимы, жидкость слегка мутная); + - слабая, сомнительная агглютинация - жидкость очень мутная, хлопья в ней плохо различимы; — - отсутствие агглютинации (жидкость равномерно мутная).
За титр сыворотки принимают последнее ее разведение, в котором интенсивность агглютинации оценивается не менее чем два плюса (++)

Рис. 7. Развернутая реакция агглютинации.

Реакция пассивной гемагглютинации. Компоненты. Применение.
Реакция непрямой (пассивной) гемагглютинации (РНГА, РПГА) основана на использовании эритроцитов (или латекса) с адсорбированными на их поверхности антигенами или антителами, взаимодействие которых с соответствующими антителами или антигенами сыворотки крови больных вызывает склеивание и выпадение эритроцитов на дно пробирки или ячейки в виде фестончатого осадка.
Компоненты. Для постановки РНГА могут быть использованы эритроциты барана, лошади, кролика, курицы, мыши, человека и другие, которые заготавливают впрок, обрабатывая формалином или глютаральдегидом. Адсорбционная емкость эритроцитов увеличивается при обработке их растворами танина или хлорида хрома.
Антигенами в РНГА могут служить полисахаридные АГ микроорганизмов, экстракты бактериальных вакцин, АГ вирусов и риккетсий, а также другие вещества.
Эритроциты, сенсибилизированные АГ, называются эритроцитарными диагностикумами. Для приготовления эритроцитарного диагностикума чаще всего используют эритроциты барана, обладающие высокой адсорбирующей активностью.
Применение. РНГА применяют для диагностики инфекционных болезней, определения гонадотропного гормона в моче при установлении беременности, для выявления повышенной чувствительности к лекарственным препаратам, гормонам и в некоторых других случаях.
Механизм. Реакция непрямой гемагглютинации (РНГА) отличается значительно более высокой чувствительностью и специфичностью, чем реакция агглютинации. Ее используют для идентификации возбудителя по его антигенной структуре или для индикации и идентификации бактериальных продуктов — токсинов в исследуемом патологическом материале. Соответственно используют стандартные (коммерческие) эритроцитарные антительные диагностикумы, полученные путем адсорбции специфических антител на поверхности танизированных (обработанных танином) эритроцитов. В лунках пластмассовых пластин готовят последовательные разведения исследуемого материала. Затем в каждую лунку вносят одинаковый объем 3 % суспензии нагруженных антителами эритроцитов. При необходимости реакцию ставят параллельно в нескольких рядах лунок с эритроцитами, нагруженными антителами разной групповой специфичности.
Через 2 ч инкубации при 37 °С учитывают результаты, оценивая внешний вид осадка эритроцитов (без встряхивания): при отрицательной реакции появляется осадок в виде компактного.диска или кольца на дне лунки, при положительной реакции — характерный кружевной осадок эритроцитов, тонкая пленка с неровными краями.

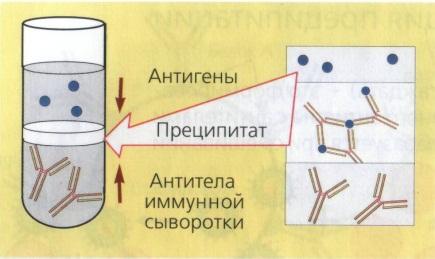
Реакция преципитации. Механизм. Компоненты. Способы постановки. Применение.
Реакция преципитации (РП) - это формирование и осаждение комплекса растворимого молекулярного антигена с антителами в виде помутнения, называемого преципитатом. Он образуется при смешивании антигенов и антител в эквивалентных количествах; избыток одного из них снижает уровень образования иммунного комплекса.
РП ставят в пробирках (реакция кольцепреципитации), в гелях, питательных средах и др. Широкое распространение получили разновидности РП в полужидком геле агара или агарозы: двойная иммунодиффузия по Оухтерлони, радиальная иммунодиффузия, иммуноэлектрофорез и др.
Механизм. Проводится с прозрачными коллоидными растворимыми антигенами, экстрагированными из патологического материала, объектов внешней среды или чистых культур бактерий. В реакции используют прозрачные диагностические преципитирующие сыворотки с высокими титрами антител. За титр преципитирующей сыворотки принимают то наибольшее разведение антигена, которое при взаимодействии с иммунной сывороткой вызывает образование видимого преципитата — помутнение.
Реакция кольцепреципитации ставится в узких пробирках (диаметр 0,5 см), в которые вносят по 0,2—0,3 мл преципити-рующей сыворотки. Затем пастеровской пипеткой медленно наслаивают 0,1—0,2 мл раствора антигена. Пробирки осторожно переводят в'вертикальное положение. Учет реакции производят через 1—2 мин. В случае положительной реакции на границе между сывороткой и исследуемым антигеном появляется преципитат в виде белого кольца. В контрольных пробирках преципитат не образуется.
Реакция связывания комплемента. Механизм. Компоненты. Применение.
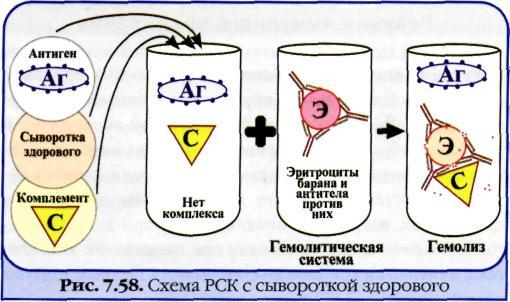
Реакция связывания комплемента (РСК) заключается в том, что при соответствии друг другу антигены и антитела образуют иммунный комплекс, к которому через Fc-фрагмент антител присоединяется комплемент (С), т. е. происходит связывание комплемента комплексом антиген—антитело. Если же комплекс антиген—антитело не образуется, то комплемент остается свободным.
Специфическое взаимодействие АГ и AT сопровождается адсорбцией (связыванием) комплемента. Поскольку процесс связывания комплемента не проявляется визуально, Ж. Борде и О.Жангу предложили использовать в качестве индикатора гемолитическую систему (эритроциты барана + гемолитическая сыворотка), которая показывает, фиксирован ли комплемент комплексом АГ-АТ. Если АГ и AT соответствуют друг другу, т. е. образовался иммунный комплекс, то комплемент связывается этим комплексом и гемолиза не происходит. Если AT не соответствует АГ, то комплекс не образуется и комплемент, оставаясь свободным, соединяется со второй системой и вызывает гемолиз.
Компоненты. Реакция связывания комплемента (РСК) относится к сложным серологическим реакциям. Для ее проведения необходимы 5 ингредиентов, а именно: АГ, AT и комплемент (первая система), эритроциты барана и гемолитическая сыворотка (вторая система).
Антигеном для РСК могут быть культуры различных убитых микроорганизмов, их лизаты, компоненты бактерий, патологически измененных и нормальных органов, тканевых липидов, вирусы и вирусосодержащие материалы.
В качестве комплемента используют свежую или сухую сыворотку морской свинки.
Механизм. РСК проводят в две фазы: 1-я фаза — инкубация смеси, содержащей три компонента антиген + антитело + комплемент; 2-я фаза (индикаторная) — выявление в смеси свободного комплемента путем добавления к ней гемолитической системы, состоящей из эритроцитов барана, и гемолитической сыворотки, содержащей антитела к ним. В 1-й фазе реакции при образовании комплекса антиген—антитело происходит связывание им комплемента, и тогда во 2-й фазе гемолиз сенсибилизированных антителами эритроцитов не произойдет; реакция положительная. Если антиген и антитело не соответствуют друг другу (в исследуемом образце нет антигена или антитела), комплемент остается свободным и во 2-й фазе присоединится к комплексу эритроцит — ан-тиэритроцитарное антитело, вызывая гемолиз; реакция отрицательная.
Применение. РСК применяют для диагностики многих инфекционных болезней, в частности сифилиса (реакция Вассермана).

Реакция нейтрализации токсина антитоксином. Механизм. Способы постановки, применение.
В основе этой реакции лежит способность специфической антитоксической сыворотки нейтрализовать экзотоксин.
Антитела иммунной сыворотки способны нейтрализовать повреждающее действие микробов или их токсинов на чувствительные клетки и ткани, что связано с блокадой микробных антигенов антителами, т. е. их нейтрализацией.
Реакцию нейтрализации (РН) проводят путем введения смеси антиген—антитело животным или в чувствительные тест-объекты (культуру клеток, эмбрионы). При отсутствии у животных и тест-объектов повреждающего действия микроорганизмов или их антигенов, токсинов говорят о нейтрализующем действии иммунной сыворотки и, следовательно, о специфичности взаимодействия комплекса антиген—антитело.
Для проведения реакции исследуемый материал, в котором предполагается наличие экзотоксина, смешивают с антитоксической сывороткой, выдерживают в термостате и вводят животным (морским свинкам, мышам). Контрольным животным вводят фильтрат исследуемого материала, не обработанный сывороткой. В том случае, если произойдет нейтрализация экзотоксина антитоксической сывороткой, животные опытной группы останутся живыми. Контрольные животные погибнут в результате действия экзотоксина.

Реакция иммунофлюоресценции. Механизм, компоненты, применение.
Иммунофлюоресцентный метод (РИФ, реакция иммунофлюоресценции, реакция Кунса) - метод выявления специфических Аг с помощью Ат, конъюгированных с флюорохромом. Обладает высокой чувствительностью и специфичностью.
Применяется для экспресс-диагностики инфекционных заболеваний (идентификация возбудителя в исследуемом материале), а также для определения Ат и поверхностных рецепторов и маркеров лейкоцитов (иммунофенотипирование) и др. клеток.
Обнаружение бактериальных и вирусных антигенов в инфекционных материалах, тканях животных и культурах клеток при помощи флюоресцирующих антител (сывороток) получило широкое применение в диагностической практике. Приготовление флюоресцирующих сывороток основано на способности некоторых флюорохромов (например, изотиоцианата флюоресцеина) вступать в химическую связь с сывороточными белками, не нарушая их иммунологической специфичности.
Различают три разновидности метода: прямой, непрямой, с комплементом. Прямой метод РИФ основан на том, что антигены тканей или микробы, обработанные иммунными сыворотками с антителами, меченными флюорохромами, способны светиться в УФ-лучах люминесцентного микроскопа. Бактерии в мазке, обработанные такой люминесцирующей сывороткой, светятся по периферии клетки в виде каймы зеленого цвета. Непрямой метод РИФ заключается в выявлении комплекса антиген - антитело с помощью антиглобулиновой (против антитела) сыворотки, меченной флюорохромом. Для этого мазки из взвеси микробов обрабатывают антителами антимикробной кроличьей диагностической сыворотки. Затем антитела, не связавшиеся антигенами микробов, отмывают, а оставшиеся на микробах антитела выявляют, обрабатывая мазок антиглобулиновой (антикроличьей) сывороткой, меченной флюорохромами. В результате образуется комплекс микроб + антимикробные кроличьи антитела + антикроличьи антитела, меченные флюорохромом. Этот комплекс наблюдают в люминесцентном микроскопе, как и при прямом методе.
Механизм. На предметном стекле готовят мазок из исследуемого материала, фиксируют на пламени и обрабатывают иммунной кроличьей сывороткой, содержащей антитела против антигенов возбудителя. Для образования комплекса антиген — антитело препарат помещают во влажную камеру и инкубируют при 37 °С в течение 15 мин, после чего тщательно промывают изотоническим раствором хлорида натрия для удаления не связавшихся с антигеном антител. Затем на препарат наносят флюоресцирующую антиглобулиновую сыворотку против глобулинов кролика, выдерживают в течение 15 мин при 37 °С, а затем препарат тщательно промывают изотоническим раствором хлорида натрия. В результате связывания флюоресцирующей антиглобулиновой сыворотки с фиксированными на антигене специфическими анти телами образуются светящиеся комплексы антиген — антитело, которые обнаруживаются при люминесцентной микроскопии.

Иммуноферментный анализ, иммуноблоттинг. Механизм, компоненты, применение.
Иммуноферментный анализ или метод — выявление антигенов с помощью соответствующих им антител, конъюгированных с ферментом-меткой (пероксидазой хрена, бета-галактозидазой или щелочной фосфатазой). После соединения антигена с меченной ферментом иммунной сывороткой в смесь добавляют субстрат/хромоген. Субстрат расщепляется ферментом и изменяется цвет продукта реакции — интенсивность окраски прямо пропорциональна количеству связавшихся молекул антигена и антител. ИФА применяют для диагностики вирусных, бактериальных и паразитарных болезней, в частности для диагностики ВИЧ-инфекций, гепатита В и др., а также определения гормонов, ферментов, лекарственных препаратов и других биологически активных веществ, содержащихся в исследуемом материале в минорных концентрациях (1010-1012 г/л).
Твердофазный ИФА — вариант теста, когда один из компонентов иммунной реакции (антиген или антитело) сорбирован на твердом носителе, напр., в лунках планшеток из полистирола. Компоненты выявляют добавлением меченых антител или антигенов. При положительном результате изменяется цвет хромогена. Каждый раз после добавления очередного компонента из лунок удаляют несвязавшиеся реагенты путем промывания,
I. При определении антител (левый рисунок) в лунки планшеток с сорбированным антигеном последовательно добавляют сыворотку крови больного, антиглобулиновую сыворотку, меченную ферментом, и субстрат/хромоген для фермента.
II.
При определении антигена (правый рисунок)
в лунки с сорбированными антителами
вносят антиген (напр., сыворотку крови
с искомым антигеном), добавляют
диагностическую сыворотку против
него и вторичные антитела (против
диагностической сыворотки), меченные
ферментом, а затем субстрат/хромоген
для фермента.
Конкурентный ИФА для определения антигенов: искомый антиген и меченный ферментом антиген конкурируют друг с другом за связывание ограниченного количества антител иммунной сыворотки.
Другой тест - Конкурентный ИФА для определения антител: искомые антитела и меченные ферментом антитела конкурируют друг с другом за антигены, сорбированные на твердой фазе.
Иммуноблоттинг — высокочувствительный метод выявления белков, основанный на сочетании электрофореза и ИФА или РИА. Иммуноблоттинг используют как диагностический метод при ВИЧ-инфекции и др.
Антигены возбудителя разделяют с помощью электрофореза в полиакриламидном геле, затем переносят их из геля на активированную бумагу или нитроцеллюлозную мембрану и проявляют с помощью ИФА. Фирмы выпускают такие полоски с «блотами» антигенов. На эти полоски наносят сыворотку больного. Затем, после инкубации, отмывают от несвязавшихся антител больного и наносят сыворотку против иммуноглобулинов человека, меченную ферментом. Образовавшийся на полоске комплекс [антиген + антитело больного + антитело против Ig человека] выявляют добавлением хромогенного субстрата, изменяющего окраску под действием фермента.
Серологические реакции, используемые для диагностики вирусных инфекций.
Иммунные реакции используют при диагностических и иммунологических исследованиях у больных и здоровых людей. С этой целью применяют серологические методы, т. е. методы изучения антител и антигенов с помощью реакций антиген—антитело, определяемых в сыворотке крови и других жидкостях, а также тканях организма.
Обнаружение в сыворотке крови больного антител против антигенов возбудителя позволяет поставить диагноз болезни. Серологические исследования применяют также для идентификации антигенов микробов, различных биологически активных веществ, групп крови, тканевых и опухолевых антигенов, иммунных комплексов, рецепторов клеток и др.
При выделении микроба от больного проводят идентификацию возбудителя путем изучения его антигенных свойств с помощью иммунных диагностических сывороток, т. е. сывороток крови гипериммунизированных животных, содержащих специфические антитела. Это так называемая серологическая идентификация микроорганизмов.
В микробиологии и иммунологии широко применяются реакции агглютинации, преципитации, нейтрализации, реакции с участием комплемента, с использованием меченых антител и антигенов (радиоиммунологический, иммуноферментный, иммунофлюоресцентный методы). Перечисленные реакции различаются по регистрируемому эффекту и технике постановки, однако, все они основаны на реакции взаимодействия антигена с антителом и применяются для выявления как антител, так и антигенов. Реакции иммунитета характеризуются высокой чувствительностью и специфичностью.
Особенности взаимодействия антитела с антигеном являются основой диагностических реакций в лабораториях. Реакция in vitro между антигеном и антителом состоит из специфической и неспецифической фазы. В специфическую фазу происходит быстрое специфическое связывание активного центра антитела с детерминантой антигена. Затем наступает неспецифическая фаза — более медленная, которая проявляется видимыми физическими явлениями, например образованием хлопьев (феномен агглютинации) или преципитата в виде помутнения. Эта фаза требует наличия определенных условий (электролитов, оптимального рН среды).
Связывание детерминанты антигена (эпитопа) с активным центром Fab-фрагмента антител обусловлено ван-дер-ваальсовыми силами, водородными связями и гидрофобным взаимодействием. Прочность и количество связавшегося антигена антителами зависят от аффинности, авидности антител и их валентности.
(МЕДИЦИНСКИЕ ИММУНОБИОЛОГИЧЕСКИЕ ПРЕПАРАТЫ)
Вакцины. Определение. Современная классификация вакцин. Требования, предъявляемые к вакцинным препаратам.
Вакцины — иммунобиологические препараты, предназначенные для активной иммунопрофилактики, то есть для создания активной специфической невосприимчивости организма к конкретному возбудителю. Вакцинация признана ВОЗ идеальным методом профилактики инфекционных заболеваний человека. Большинство вакцин разделяют на:
живые,
инактивированные (убитые, неживые),
молекулярные (анатоксины)
генно инженерные и
химические;
по наличию полного или неполного набора Аг — на корпускулярные и компонентные, а по способности вырабатывать невосприимчивость к одному или нескольким возбудителям — на моно- и ассоциированные.
Живые вакцины
Живые вакцины — препараты из ослабленных либо генетически изменённых патогенных микроорганизмов, а также близкородственных микробов, способных индуцировать невосприимчивость к патогенному виду (в последнем случае речь идёт о так называемых дивергентных вакцинах).
Поскольку все живые вакцины содержат микробные тела, то их относят к группе корпускулярных вакцинных препаратов. Основное достоинство живых вакцин— полностью сохранённый набор Аг возбудителя, что обеспечивает развитие длительной невосприимчивости даже после однократной иммунизации. Живые вакцины обладают и рядом недостатков. Наиболее характерный — риск развития манифестной инфекции в результате снижения аттенуации вакцинного штамма.
Ослабленные ( аттенуированные ) вакцины
Ослабленные (аттенуированные) вакцины изготавливают из микроорганизмов с пониженной патогенностью, но выраженной иммуногенностью. Введение вакцинного штамма в организм имитирует инфекционный процесс: микроорганизм размножается, вызывая развитие иммунных реакций. Наиболее известны вакцины для профилактики сибирской язвы, бруцеллёза, Ку-лихорадки, брюшного тифа. Однако большая часть живых вакцин — противовирусные. Наиболее известны вакцина против возбудителя жёлтой лихорадки, противополиомиелитная вакцина Сэбина, вакцины против гриппа, кори, краснухи, паротита и аденовирусных инфекций.
Дивергентные вакцины
В качестве вакцинных штаммов используют микроорганизмы, находящиеся в близком родстве с возбудителями инфекционных болезней. Аг таких микроорганизмов индуцируют иммунный ответ, перекрёстно направленный на Аг возбудителя. Наиболее известны и длительно применяются вакцина против натуральной оспы (из вируса коровьей оспы) и БЦЖ для профилактики туберкулёза (из микобактерий бычьего туберкулёза).
Инактивированные вакцины.
В настоящее время также применяют вакцины, изготовленные из убитых микробных тел либо метаболитов, а также из отдельных Аг, полученных биосинтетическим или химическим путём. Вакцины, содержащие убитые микроорганизмы и их структурные компоненты, относят к группе корпускулярных вакцинных препаратов.
Неживые вакцины обычно проявляют меньшую (по сравнению с живыми вакцинами) иммуногенность, что диктует необходимость многократной иммунизации. В то же время неживые вакцины лишены балластных веществ, что значительно уменьшает частоту побочных эффектов, часто развивающихся после иммунизации живыми вакцинами.
Корпускулярные (цельновирионные) вакцины
Для их приготовления вирулентные микроорганизмы убивают либо термической обработкой, либо воздействием химических агентов (например, формалина или ацетона). Подобные вакцины содержат полный набор Аг. Спектр возбудителей, используемых для приготовления неживых вакцин, разнообразен; наибольшее распространение получили бактериальные (например, противочумная) и вирусные (например, антирабическая) вакцины.
Компонентные ( субъединичные ) вакцины
Компонентные (субъединичные) вакцины — разновидность корпускулярных неживых вакцин; они состоят из отдельных (главных, или мажорных) антигенных компонентов, способных обеспечить развитие невосприимчивости. В качестве Аг применяют иммуногенные компоненты возбудителя. Для их выделения используют различные физико-химические методы, поэтому препараты, получаемые из них, также известны как химические вакцины. В настоящее время разработаны субъединичные вакцины против пневмококков (на основе полисахаридов капсул), брюшного тифа (О-, Н- и Vi-Ar), сибирской язвы (полисахариды и полипептиды капсул), гриппа (вирусные нейраминидазы и гемагглютинин). Для придания более высокой иммуногенности компонентные вакцины нередко сочетают с адъювантами (например, сорбируют на гидроксиде алюминия).
Генно-инженерные ( рекомбинантные ) вакцины.
Генно-инженерные вакцины содержат Аг возбудителей, полученные с использованием методов генной инженерии, и включают только высокоиммуногенные компоненты, способствующие формированию защитного иммунитета.
Синтетические вакцины
Принцип конструирования вакцин включает синтез или выделение нуклеиновых кислот или полипептидных последовательностей, образующих Aг-детерминанты, распознаваемых нейтрализующими AT. Непременные компоненты таких вакцин — сам Аг, высокомолекулярный носитель (винилпирролидон или декстран) и адъювант (повышающий иммуногенность вакцин).
Молекулярные вакцины. Анатоксины.
В подобных препаратах Аг служат молекулы метаболитов патогенных микроорганизмов. Наиболее часто в этом качестве выступают молекулы бактериальных экзотоксинов. Анатоксины используют для активной иммунопрофилактики токсинемических инфекций (дифтерии, столбняка, ботулизма, газовой гангрены, стафилококковых инфекций и др.).
Цель применения анатоксинов — индукция иммунных реакций, направленных на нейтрализацию токсинов; в результате иммунизации синтезируются нейтрализующие AT (антитоксины). Обычный источник токсинов — промышленно культивируемые естественные штаммы-продуценты (например, возбудители дифтерии, ботулизма, столбняка). Полученные токсины инактивируют термической обработкой либо формалином, в результате чего образуются анатоксины (токсоиды), лишённые токсических свойств, но сохранившие иммуногенность.
Анатоксины очищают, концентрируют и для усиления иммуногенных свойств адсорбируют на адъюванте (обычно, гидрооксид алюминия). Адсорбция анатоксинов значительно повышает их иммуногенную активность. С одной стороны, образуется депо препарата в месте его введения с постепенным поступлением в кровоток, с другой — действие адъюванта стимулирует развитие иммунного ответа, в том числе и в регионарных лимфатических узлах. Анатоксины выпускают в форме моно- (дифтерийный, столбнячный, стафилококковый) и ассоциированных (дифтерийно-столбнячный, ботулинический трианатоксин) препаратов.
Конъюгированные вакцины
В некоторых случаях для иммунизации применяют конъюгированные вакцины, представляющие собой комплексы бактериальных полисахаридов и токсинов. Подобные комбинации значительно усиливают иммуногенность компонентов вакцин, особенно полисахаридной фракции (например, сочетание Аг Haemophilus influenzae и дифтерийного анатоксина). В этой ситуации последний играет роль носителя, и в ответ на введение Аг полисахаридов формируется пул длительно циркулирующих клеток памяти. Предпринимаются попытки создать смешанные бесклеточные вакцины, включающие анатоксины и некоторые другие факторы патогенности, например адгезины. В настоящее время такие вакцины проходят клинические испытания для профилактики коклюша.
В большинстве случаев вакцины и анатоксины применяют для создания невосприимчивости к одному возбудителю (так называемые моновалентные вакцины). Путём одномоментной иммунизации возможно и достижение множественной невосприимчивости. Для этого создают ассоциированные (поливалентные) препараты, совмещая Аг нескольких микроорганизмов.
Требования, предъявляемые к современным вакцинам:
Иммуногенность;
Низкая реактогенность (аллергенность);
Не должны обладать тератогенностью, онкогенностью;
Штаммы, из которых приготовлена вакцина, должны быть генетически стабильны;
Длительный срок хранения;
Технологичность производства;
Простота и доступность в применении
Иммунные сыворотки. Классификация. Получение, очистка. Применение.
Иммунные сыворотки: иммунологические препараты на основе антител.
1.Антитоксические - сыворотки против дифтерии, столбняка, ботулизма, газовой гангрены, т.е. сыворотки, содержащие в качестве антител антитоксины, которые нейтрализуют специфические токсины.
2.Антибактериальные - сыворотки, содержащие агглютинины, преципитины, комплементсвязывающие антитела к возбудителям брюшного тифа, дизентерии, чумы, коклюша.
3.Противовирусные сыворотки (коревая, гриппозная, антирабическая) содержат вируснейтрализующие, комплементсвязывающие противовирусные антитела.
Иммунные сыворотки получают путем гипериммунизации животных (лошади) специфическим антигеном (анатоксином, бактериальными или вирусными культурами и их антигенами) с последующим, в период максимального антителообразования, выделением из крови иммунной сыворотки. Иммунные сыворотки, полученные от животных, называют гетерогенными, так как они содержат чужеродные для человека сывороточные белки.
Для получения гомологичных нечужеродных иммунных сывороток используют сыворотки переболевших людей (коревая, оспенная сыворотки) или специально иммунизированных людей-доноров (противостолбнячная, противоботулиническая), содержащие антитела к ряду возбудителей инфекционных болезней вследствие вакцинации или перенесенного заболевания.
Нативные иммунные сыворотки содержат ненужные белки (альбумин), из этих сывороток выделяют и подвергают очистке специфические белки- иммуноглобулины. Методы очистки: осаждение спиртом, ацетоном на холоде, обработка ферментами.
Иммунные сыворотки создают пассивный специфический иммунитет сразу после введения. Применяют с лечебной и профилактической целью. Для лечения токсинемических инфекций (столбняк, ботулизм, дифтерия, газовая гангрена), а также для лечения бактериальных и вирусных инфекций (корь, краснуха, чума, сибирская язва). С лечебной целью сывороточные препараты в/м. Профилактически: в/м лицам, имевшим контакт с больным, для создания пассивного иммунитета.
Антитоксические сыворотки. Получение, очистка, титрование. Применение. Осложнения при использовании и их предупреждение.
Антитоксические гетерогенные сыворотки получаются путем гипериммунизации различных животных. Они называются гетерогенными т.к. содержат чужеродные для человека сывороточные белки. Более предпочтительным является применение гомологичных антитоксических сывороток, для получения которых используется сыворотка переболевших людей (коревая, паротидная), или специально иммунизированных доноров(противостолбнячная, противоботулинистическая), сыворотка из плацентарной а так же абортивной крови, содержащие антитела к ряду возбудителей инфекционных болезней вследствие вакцинации или перенесенного заболевания.
Для очистки и концентрирования антитоксических сывороток используют методы: осаждение спиртом или ацетоном на холоде, обработка ферментами, аффинная хроматография, ультрафильтрация.
Активность иммунных антитоксических сывороток выражают в антитоксических единицах, т.е. тем наименьшим кол-вом антител, которое вызывает видимую или регистрируемую соответствующим способом реакцию с определённым кол-вом специфического антигена. активность антитоксической противостолбнячной сыворотки и соответствующего Ig выражается в антитоксических единицах.
Антитоксические сыворотки применяются для лечения токсинемических инфекций (столбняк, ботулизм, дифтерия, газовая гангрена).
После введения антитоксических сывороток возможны осложнения в виде анафилактического шока и сывороточной болезни, поэтому пред введением препаратов ставят аллергическую пробу на чувствительность к ним пациента, а вводят их дробно, по Безредке.
Препараты иммуноглобулинов. Получение, очистка, показания к применению.
Нативные иммунные сыворотки содержат ненужные белки (альбумин), из этих сывороток выделяют и подвергают очистке специфические белки- иммуноглобулины.
Иммуноглобулины, иммунные сыворотки подразделяют на:
1.Антитоксические - сыворотки против дифтерии, столбняка, ботулизма, газовой гангрены, т.е. сыворотки, содержащие в качестве антител антитоксины, которые нейтрализуют специфические токсины.
2.Антибактериальные - сыворотки, содержащие агглютинины, преципитины, комплементсвязывающие антитела к возбудителям брюшного тифа, дизентерии, чумы, коклюша.
3.Противовирусные сыворотки (коревая, гриппозная, антирабическая) содержат вируснейтрализующие, комплементсвязывающие противовирусные антитела.
Методы очистки: осаждение спиртом, ацетоном на холоде, обработка ферментами, аффинная хроматография, ультрафильтрация.
Активность иммуноглобулинов выражают в антитоксических единицах, в титрах вируснейтрализующей, гемагглютинирующей, агглютинирующей активности, т.е. тем наименьшим количеством антител, которое вызывает видимую реакцию с определенным количеством специфического антигена.
Иммуноглобулины создают пассивный специфический иммунитет сразу после введения. Применяют с лечебной и профилактической целью. Для лечения токсинемических инфекций (столбняк, ботулизм, дифтерия, газовая гангрена), а также для лечения бактериальных и вирусных инфекций (корь, краснуха, чума, сибирская язва). С лечебной целью сывороточные препараты в/м. Профилактически: в/м лицам, имевшим контакт с больным, для создания пассивного иммунитета.
При необходимости экстренного создания иммунитета, для лечения развивающейся инфекции применяют иммуноглобулины, содержащие готовые антитела.
Понятие об иммуномодуляторах. Принцип действия. Применение.
Иммуномодуляторы – вещества, оказывающие влияние на функцию иммунной системы, изменяющие активность иммунной системы в сторону повешения (иммуностимуляторы) или понижения (иммунодепрессанты) её активности.
К экзогенным иммуномодуляторам относится большая группа веществ различной химической природы и происхождения, оказывающих неспецифическое активирующее или супрессивное действие на иммунную систему, но являющихся чужеродными для организма. Антибиотики, левамизол, полисахариды, ЛПС, адъюванты.
Эндогенные иммуномодуляторы представляют собой достаточно большую группу олигопептидов, синтезируемых самим организмом, его иммунокомпетентными клетками, и способных активировать иммунную систему путем усиления функции иммунокомпетентных клеток. К ним относятся регуляторные пептиды: интерлейкины, интерфероны, гормоны тимуса.
Применение иммуномодуляторов: при первичных и вторичных имму-нодефицитах различного происхождения, при онкологических болезнях, при трансплантации органов и тканей, при лечении иммунопатологических и аллергических болезней, в иммунопрофилактике и лечении инфекционных болезней.
Созданы препараты, обладающие иммуномодулирующим действием: интерферон, лейкоферон, виферон.
Основные принципы применения иммуномодуляторов:
1. Препараты не применяются самостоятельно, а лишь дополняют традиционную терапию.
2. Перед назначением ИМ обязательна оценка характера иммунологических нарушений у больного.
3. Принимать во внимание зависимость изменений иммунологических показателей от возраста, биологических ритмов больного и других причин.
4. Необходимо определить степени выраженности иммунологических расстройств.
5. Учитывать иммунотропные эффекты традиционных лекарственных средств.
6. Принимать во внимание мишени действия избранных корректоров и их комбинаций.
7. Учитывать побочные реакции препаратов и их комбинаций.
8. Помнить, что профильность действия модуляторов сохраняется при различных заболеваниях, не только при наличии однотипных иммунологических расстройств.
9. Характер иммунологических нарушений у больного может изменить спектр действия ИМ.
10. Выраженность эффекта коррекции в остром периоде выше, чем в стадии ремиссии.
11. Продолжительность устранения иммунологических нарушений составляет от 30 дней до 6-9 месяцев и зависит от свойств препарата, маркерного показателя и характера заболевания.
12. При многократном введении ИМ спектр их действия сохраняется, а выраженность эффекта возрастает.
13. ИМ, как правило, не влияют на неизмененные иммунологические показатели.
14. Устранение дефицита одного звена иммунитета, как правило, компенсирует стимуляцию другого звена.
15. Препараты полностью реализуют свои эффекты только при использовании в оптимальных дозах.
16. Проводить определение отвечаемости больного на те или иные ИМ.
Интерфероны. Природа, способы получения. Применение.
Интерфероны — гликопротеины, вырабатываемые клетками в ответ на вирусную инфекцию и другие стимулы. Блокируют репродукцию вируса в других клетках и участвуют во взаимодействии клеток иммунной системы.
Различают три ИФН:
1. альфа-ИФН синтезируют лейкоциты периферической крови (ранее был известен как лейкоцитарный ИФН); (подавление синтеза вирусных белков) связываясь со здоровыми клетками, защищает их от вирусов.
2. бета-ИФН синтезируют фибробласты (ранее был известен как фибробластный ИФН); (антивирусный эффект)
3.гамма-ИФН — продукт стимулированных Т-лимфоцитов, NK-клеток(естественные киллеры) и (возможно) макрофагов (ранее был известен как иммунный ИФН). Стимулирует активность Т- и В-лимфоцитов, моноци¬тов/макрофагов и нейтрофилов. Индуцирует апоптоз активированных макрофагов, кератиноцитов, гепатоцитов, клеток костного мозга, эндотелиоцитов и подавляет апоптоз периферических моноцитов и герпес-инфицированных нейронов.
Интерферон взаимодействует с интактными, ещё неинфицированными клетками, препятствуя реализации репродуктивного цикла вирусов за счёт активации клеточных ферментов (протеинкиназ).
Применение интерферона. Действие интерферона тем эффективнее, чем раньше он начинает синтезироваться или поступать в организм извне. Поэтому его используют с профилактической целью при многих вирусных инфекциях, например гриппе, а также с лечебной целью при хронических вирусных инфекциях, таких как парентеральные гепатиты (В, С, D), герпес, рассеянный склероз и др. Интерферон дает положительные результаты при лечении злокачественных опухолей и заболеваний, связанных с иммунодефицитами.
Получение интерферона. Получают интерферон двумя способами: а) путем инфицирования лейкоцитов или лимфоцитов крови человека безопасным вирусом, в результате чего инфицированные клетки синтезируют интерферон, который затем выделяют и конструируют из него препараты интерферона; б) генно-инженерным способом — путем выращивания в производственных условиях рекомбинантных штаммов бактерий, способных продуцировать интерферон. Обычно используют рекомбинантные штаммы псевдомонад, кишечной палочки со встроенными в их ДНК генами интерферона. Интерферон, полученный генно-инженерным способом, носит название рекомбинантного. В нашей стране рекомбинантный интерферон получил официальное название «Реаферон». Производство этого препарата во многом эффективнее и дешевле, чем лейкоцитарного.
Рекомбинантный интерферон нашел широкое применение в медицине как профилактическое и лечебное средство при вирусных инфекциях, новообразованиях и при иммунодефицитах.
Иммунотерапия и иммунопрофилактика инфекционных болезней.
Иммунопрофилактика и иммунотерапия являются разделами иммунологии, которые изучают и разрабатывают способы и методы специфической профилактики, лечения и диагностики инфекционных и неинфекционных болезней с помощью иммунобиологических препаратов, оказывающих влияние на функцию иммунной системы, или действие которых основано на иммунологических принципах.
Иммунопрофилактика направлена на создание активного или пассивного иммунитета к возбудителю инфекционной болезни, его антигену с целью предупреждения возможного заболевания путем формирования невосприимчивости к ним организма.
Иммунотерапия направлена на лечение уже развившейся болезни, в основе которой лежит нарушение функции иммунной системы.
Иммунопрофилактика и иммунотерапия применяются, когда необходимо:
а)сформировать, создать специфический иммунитет, активизировать деятельность иммунной системы;
б) подавить активность звеньев иммунной системы;
в)нормализовать работу иммунной системы.
Иммунопрофилактика и иммунотерапия применяются в профилактике и лечении инфекционных болезней, аллергий, иммунопатологических состояний, в онкологии, трансплантологии, при первичных и вторичных иммунодефицитах.
В лечении токсинемических инфекций (ботулизм, столбняк) значение имеет серотерапия, т.е. применение антитоксических сывороток, и иммуноглобулин.
В терапии онкологических болезней применяются иммуноцитокины.
Для всего этого – иммунобиологические препараты.
Микрофлора воздуха и методы ее исследования. Санитарно-показательные микроорганизмы воздуха.
В воздух попадают микроорганизмы из дыхательных путей и с каплями слюны человека и животных. Здесь обнаруживаются кокковидные и палочковидные бактерии, бациллы, клостридии, актиномицеты, грибы и вирусы. С целью снижения микробной обсемененности воздуха проводят влажную уборку помещения, очистку поступающего воздуха. Применяют также аэрозольную дезинфекцию и обработку помещений лампами ультрафиолетового излучения.
Микробиологический контроль воздуха проводится с помощью методов естественной или принудительной седиментации микробов. Естественная седиментация (по методу Коха) проводится в течение 10 мин путем осаждения микробов на поверхность твердой питательной среды в чашке Петри. Принудительная седиментация микробов осуществляется путем «посева» проб воздуха на питательные среды с помощью специальных приборов.
Санитарно-гигиеническое состояние воздуха определяется по следующим микробиологическим показателям:
1. Общее количество микроорганизмов в 1 м воздуха (обсемененность воздуха) — количество колоний микроорганизмов, выросших при посеве воздуха на питательном агаре в чашке Петри в течение 24 ч при 37С.
2. Индекс санитарно-показательных микробов— количество золотистого стафилококка и гемолитических стрептококков в 1 м3 воздуха. Эти бактерии являются представителями микрофлоры верхних дыхательных путей и имеют общий путь выделения с патогенными микроорганизмами, передающимися воздушно-капельным путем. Появление в воздухе спорообразующих бактерий — показатель загрязненности воздуха микроорганизмами почвы, а появление грамотрицательных бактерий — показатель возможного антисанитарного состояния.
В воздух попадают микроорганизмы из дыхательных путей и с каплями слюны человека и животных. Здесь обнаруживаются кокковидные и палочковидные бактерии, бациллы, клостридии, актиномицеты, грибы и вирусы.
Золотистый стафилококк и гемолитические стрептококки являются представителями микрофлоры верхних дыхательных путей и имеют общий путь выделения с патогенными микроорганизмами, передающимися воздушно-капельным путем. Появление в воздухе спорообразующих бактерий — показатель загрязненности воздуха микроорганизмами почвы, а появление грамотрицательных бактерий — показатель возможного антисанитарного состояния.
По эпидемиологическим показаниям в воздухе определяют наличие сальмонелл, микобактерий, вирусов.
Возбудители воздушно-капельных инфекций имеют общий путь выделения с бактериями (кокками), постоянно обитающими на слизистой оболочке верхних дыхательных путей, выделяющимися в окружающую среду (при кашле, чиханье, разговоре), поэтому в качестве санитарно-показательных бактерий для воздуха закрытых помещений предложены гемолитические стрептококки и золотистые стафилококки.
Грамотрицательные бактерии– в связи с распространением госпитальной инфекции в воздухе больничных помещений.
Определяют наличие дрожжеподобных и плесневых грибов.
Методы санитарно-бактериологического исследования воды. Показатели качества воды: микробное число, коли-индекс.
Микрофлора воды отражает микробный состав почвы, так как микроорганизмы, в основном, попадают в воду с ее частичками. В воде формируются определенные биоценозы с преобладанием микроорганизмов, адаптировавшихся к условиям местонахождения, освещенности, степени растворимости кислорода и диоксида углерода, содержания органических и минеральных веществ.
В водах пресных водоемов обнаруживаются различные бактерии: палочковидные (псевдомонады, аэромонады), кокковидные (микрококки) и извитые. Загрязнение воды органическими веществами сопровождается увеличением анаэробных и аэробных бактерий, а также грибов. Микрофлора воды выполняет роль активного фактора в процессе самоочищения ее от органических отходов, которые утилизируются микроорганизмами. Вместе с сточными водами попадают представители нормальной микрофлоры человека и животных (кишечная палочка, цитробактер, энтеробактер, энтерококки, клостридии) и возбудители кишечных инфекций (брюшного тифа, паратифов, дизентерии, холеры, лептоспироза, энтеровирусных инфекций). Таким образом, вода является фактором передачи возбудителей многих инфекционных заболеваний. Некоторые возбудители могут даже размножаться в воде (холерный вибрион, легионеллы).
Микрофлора воды океанов и морей также содержит различные микроорганизмы, в том числе светящиеся и галофильные вибрионы,
поражающие рыб, при употреблении которых в пищу развивается пищевая токсикоинфекция.
В воде регистрируют кишечную палочку, БГКП (колиформные палочки), энтерококк, стафилококки. На основании количественного выявления этих санитарно-показательных бактерий вычисляются индекс БГКП (число БГКП в 1 л воды), титр энтерококка.
Общее микробное число— количество аэробных и факультативно-анаэробных бактерий в 1 мл воды — определяют у всех видов воды. Исследуемую воду вносят по 1 мл в две стерильные чашки Петри и заливают питательным агаром. Результат вычисляют путем суммирования среднего арифметического числа бактерий, дрожжевых и плесневых грибов.
Определение колиформных бактерий. Общие колиформные бактерии — это Гр- аспорогенные палочки, не обладающие оксидазной активностью и сбраживающие лактозу с образованием кислоты и газа. Их обнаружение свидетельствует о свежем фекальном загрязнении воды.
Определение колифагов. Присутствие колифагов (бактериофагов, паразитирующих на Е. coli) определяют в воде поверхностных источников и питьевой воде, в сточных водах. Исследование проводят методом агаровых слоев. При наличии колифагов образуются прозрачные бляшки.
Определение спор сульфитредуцирующих клостридий. Присутствие спор клостридий определяют в воде для оценки эффективности работы сооружений по подготовке питьевой воды. В результате прорастания спор, размножения клостридий и восстановления ими сульфита образуется сульфид железа, который придает среде черный цвет.
Пробы воды очищенной, используемой для приготовления лекарственных форм отбирают в количестве 500 мл в стерильные бутылки, закрытые ватными пробками и бумажными колпачками. Пробы отбирают из бюретки, у которой предварительно обжигают кончик с помощью ватного тампона, смоченного спиртом.
Пробы воды очищенной для приготовления инъекционных растворов и глазных капель отбирают в стерильные флаконы в количестве 20 мл.
Санитарно-микробиологическое исследование почвы. Микробное число, коли-титр, перфрингенс-титр почвы.
Состав микрофлоры почвы зависит от ее типа и состояния, состава растительности, температуры, влажности. В почве живут азотфиксирующие бактерии, способные усваивать молекулярный азот (Azotobacter,, Mycobacterium.). Почва является местом обитания спорообразуюших палочек родов Bacillus и Closlridium. Патогенные спорообразующие палочки (возбудители сибирской язвы, ботулизма, столбняка, газовой гангрены) способны длительно сохраняться, а некоторые даже размножаться в почве (Clostridium botulinum).
Кишечные бактерии (сем. Enterobacteriaceae) — кишечная палочка, возбудители брюшного тифа, сальмонеллезов, дизентерии — могут попадать в почву с фекалиями. Обнаружение их в значительных количествах является показателем загрязнения почвы фекалиями человека и животных.
В почве находятся грибы, они участвуют в почвообразовании. Токсинообразующие грибы, попадая в продукты питания – вызывают интоксикацию.
Состав микрофлоры почвы зависит от ее типа и состояния, состава растительности, температуры, влажности. Большинство почвенных микроорганизмов способны развиваться при нейтральном рН, высокой относительной влажности, температуре от 25 до 40С.
Общее микробное число определяют глубинным посевом (на плотной среде) Перфрингенс-титр почвы - минимальное количество почвы, в котором еще определяются Clostridium perfringens. При фекальном загрязнении почвы клостридии обнаруживают в титре 0,01 г. Определяют перфрингенс-титр глубинным посевом.
Оценка фекального заражения проводится по индексу БГКП – коли-титр(количество БГКП в 1 г почвы).
На свежее фекальное загрязнение указывают: обнаружение энтерококков, большое количество БГКП при отсутствии нитрифицирующих бактерий, относительно высокое содержание вегетативных форм клостридий.
Титр БГКП и перфрингенс-титр для сильно загрязненных почв – 0,009; для чистых почв – коли-титр 1,0; перфрингенс-титр – 0,01.
