- •Саратовский государственный технический университет
- •Краткий очерк истории развития физической химии
- •Разделы физической химии
- •1 Основы термодинамики
- •1.1 Природа энергии
- •1.2 Энергетические эффекты в химических реакциях
- •1.3 Энтальпия
- •1.4 Закон Гесса
- •1.5 Теплоты образования
- •1.6 Измерение изменений энергии, калориметрия
- •1.7 Теплотворная способность топлив и пищи
- •1.8 Потребление энергии: тенденции и перспективы
- •2 Химическая кинетика. Химическое равновесие
- •2.1 Скорость химических реакций
- •2.2 Зависимость скорости реакции от концентрации. Закон действия масс
- •2.3 Влияние температуры на скорость реакции. Правило Вант-Гоффа
- •2.4 Химическое равновесие и его смещение
- •2.4.1 Влияние изменения концентрации веществ на смещение химического равновесия
- •2.4.2 Влияние изменения давления на смещение химического равновесия, если в реакции участвуют газообразные вещества
- •2.4.3 Влияние изменения температуры на смещение химического равновесия
- •3 Свободная энергия. Энтропия и равновесие
- •3.1 Самопроизвольные процессы
- •3.2 Самопроизвольные процессы и изменение энтропии
- •3.3 Интерпретация энтропии на молекулярном уровне
- •3.4 Вычисление изменений энтропии
- •3.5 Функция свободной энергии
- •3.6 Свободная энергия и константа равновесия
- •4 Аналитические выражения основых законов термодинамики
- •4.1 Термодинамическая система и термодинамические функции.
- •Первый закон термодинамики
- •4.2 Второй закон термодинамики. Теорема Карно
- •4.3 Постулат Планка. Абсолютное значение энтропии
- •4.4 Характеристические функции. Приложение второго закона термодинамики
- •4.4.1 Изохорно-изотермический потенциал
- •4.4.2 Изобарно-изотермический потенциал
- •4.4.3 Уравнение максимальной работы (уравнение Гиббса-Гельмгольца)
- •4.4.4 Термодинамические потенциалы. Характеристические функции. Условия равновесия
- •4.5 Фазовые переходы. Уравнение Клайперона-Клаузиуса
- •4.5.1 Фазовые переходы первого рода. Плавление. Испарение
- •5 Поверхностные явления. Адсорбция
- •5.1 Изотеормы адсорбции газов. Уравнение Генри
- •5.2. Уравнение Лэнгмюра. Адсорбция смеси газов
- •5.3 Уравнение изотермы адсорбции паров Брунауера, Эммета и Теллера (уравнение бэт)
- •6 Правило фаз гиббса. Равновесие гетерогенных систем
- •6.1 Однокомпонентные системы
- •6.2 Двухкомпонентные системы с одной фазой переменного состава
- •6.2.1 Диаграмма плавкости двухкомпонентных систем, не образующих химических соединений и твердых растворов
- •6.2.2 Диаграммы плавкости систем, компоненты которых образуют химическое соединение
- •6.3 Термический анализ
- •6.4 Физико-химический анализ
- •7 Термодинамика и кинетика твердофазного
- •7.2 Основные типы реакций взаимодействия соединяемых материалов
- •I. Кристаллохимические реакции замещения катиона оксида.
- •III. Реакции взаимного растворения оксидов.
- •IV. Образование нового оксида при переменной валентности катиона.
- •V. Окисление металла в контакте с оксидами переменного состава.
- •VI. Реакции растворения оксида в металле.
- •VII. Реакции с частичным окислением свариваемого металла
- •7.3 Термодинамика и кинетика формирования соединений при слабом химическом взаимодействии материалов
1.5 Теплоты образования
Пользуясь
первым законом термодинамики, можно
вычислить изменения энтальпии многих
реакций по нескольким табулированным
значениям. Множество данных подобного
типа удобно суммировать в виде стандартных
теплот образования.
Теплота образования соединения
![]() –
это изменение энтальпии, происходящее
при образовании одного моля данного
соединения из составляющих его элементов.
Изменение энтальпии называется
стандартным
–
это изменение энтальпии, происходящее
при образовании одного моля данного
соединения из составляющих его элементов.
Изменение энтальпии называется
стандартным
![]() ,
когда все реагенты и продукты находятся
в ихстандартных
состояниях. Другими
словами, все вещества находятся при
этом в наиболее устойчивой форме при
заданной температуре и нормальном
атмосферном давлении. При составлении
таблиц температуру обычно выбирают
равной 250С.
Например, стандартная теплота образования
,
когда все реагенты и продукты находятся
в ихстандартных
состояниях. Другими
словами, все вещества находятся при
этом в наиболее устойчивой форме при
заданной температуре и нормальном
атмосферном давлении. При составлении
таблиц температуру обычно выбирают
равной 250С.
Например, стандартная теплота образования
![]() этанола
С2Н5ОН
есть изменение энтальпии следующей
реакции:
этанола
С2Н5ОН
есть изменение энтальпии следующей
реакции:
2С (графит) + 3Н2 (г.) + 1/2О2 (г.) → С2Н5ОН (ж.) (1.11)
Элемент кислород представляет собой О2, а не О или О3, поскольку О2 является устойчивой формой кислорода при 250С и нормальном атмосферном давлении. Аналогично в качестве элемента углерода указан графит, а не алмаз, поскольку первый из них является наиболее устойчивой формой (обладает минимальной энергией) при 250С и нормальном атмосферном давлении. Превращение графита в алмаз требует затраты энергии, как это следует из уравнения (1.12):
С
(графит) → С (алмаз)
![]() = 1,88 кДж(1.12)
= 1,88 кДж(1.12)
В табл. 1.1 приведены стандартные теплоты образования некоторых соединений: по определению, стандартная теплота образования наиболее устойчивой формы любого элемента равна нулю.
По
стандартным теплотам образования можно
вычислять стандартные изменения
энтальпии любых реакций. С этой целью
следует просуммировать теплоты
образования всех продуктов реакции,
умножив каждую молярную теплоту
образования на коэффициент, который
стоит перед данным веществом
в полном уравнении реакции, а затем
вычесть из полученной суммы аналогичную
сумму теплот образования всех реагентов.
Например, стандартное изменение энтальпии
![]() для реакции горения глюкозы, описываемой
уравнением (1.13), определяется уравнением
(1.14):
для реакции горения глюкозы, описываемой
уравнением (1.13), определяется уравнением
(1.14):
С6Н12О6 (тв.) + 6О2 (г.) → 6СО2 (г.) + 6Н2О (ж.) (1.14)
![]() реакции=[6×
реакции=[6×![]() (СО2)+6×
(СО2)+6×![]() (Н2О)]
- [
(Н2О)]
- [![]() (С6Н12О6)+6×
(С6Н12О6)+6×![]() (О2)]
(О2)]
Пользуясь
данными о теплотах образования (Правильнее
говорить не «теплоты образования», а
«изменения энтальпии образования». Тем
не менее, принято пользоваться более
общим термином - «теплоты образования»),
приведенными в табл. 1.1. получаем для
рассматриваемого процесса:
![]() реакции
= [(6 моль СО2
)
× (- 393,5 кДж/моль СО2)
+ (6 моль Н2О)×(-
285,9 кДж/моль Н2О)]
- [(1 моль С6Н12О6)
× (- 1260кДж/моль С6Н12О6)
+ (6моль О2)
× (0 кДж/моль О2)]
= - 2816 кДж.
реакции
= [(6 моль СО2
)
× (- 393,5 кДж/моль СО2)
+ (6 моль Н2О)×(-
285,9 кДж/моль Н2О)]
- [(1 моль С6Н12О6)
× (- 1260кДж/моль С6Н12О6)
+ (6моль О2)
× (0 кДж/моль О2)]
= - 2816 кДж.
ТАБЛИЦА 1.1
Стандартные
теплоты образования
![]() при 250С
при 250С
|
Вещество |
Формула |
|
Вещество |
Формула |
|
|
Алмаз |
С (тв.) |
1,88 |
Метан |
СН4(г) |
-74,85 |
|
Аммиак |
NH3 (г.) |
-4619 |
Метанол |
СН3ОН(ж) |
-238,6 |
|
Ацетилен |
С2Н2 (г.) |
226,7 |
Моноксид углерода |
СО(г) |
-11,5 |
|
Бензол |
С6Н6 (ж.) |
49,04 |
Оксид кальция |
СаО(тв) |
-635,5 |
|
Бикарбонат натрия |
NaHCO3 (тв.) |
-947,7 |
Сахароза |
С12Н22О11(тв) |
-2221 |
|
Бромид водорода |
НВr (г.) |
-36,23 |
Фторид водорода |
HF(г) |
-268,6 |
|
Вода |
Н2О (ж.) |
-285,8 |
Хлорид натрия |
NaCl(тв) |
-411,0 |
|
Водяной пар |
Н2О (г.) |
-241,8 |
Хлорид серебра |
AgCl(тв) |
-127,0 |
|
Глюкоза |
С6Н12О6 (тв.) |
-1260 |
Хлорид водорода |
НСl(г) |
-92,30 |
|
Диоксид углерода |
СО2 (г.) |
-393,5 |
Этан |
С2Н6(г) |
-84,68 |
|
Иодид водорода |
НI (г.) |
25,9 |
Этанол |
С2Н5ОН(ж) |
-277,7 |
|
Карбонат кальция |
СаСО3 (тв.) |
-1207,1 |
Этилен |
С2Н4(г) |
52,30 |
|
Карбонат натрия |
Na2CO3 (тв.) |
-1130,9 |
Сульфат меди |
СuSО4(тв.) |
-771,4 |
Иллюстрируемое
уравнением (1.14) общее правило непосредственно
следует из того, что
![]() является
функцией состояния.
Это
позволяет вычислить изменение энтальпии
любой реакции по энергиям, требуемым
для превращения исходных реагентов в
элементы, а затем для превращения этих
элементов в продукты реакции.
является
функцией состояния.
Это
позволяет вычислить изменение энтальпии
любой реакции по энергиям, требуемым
для превращения исходных реагентов в
элементы, а затем для превращения этих
элементов в продукты реакции.
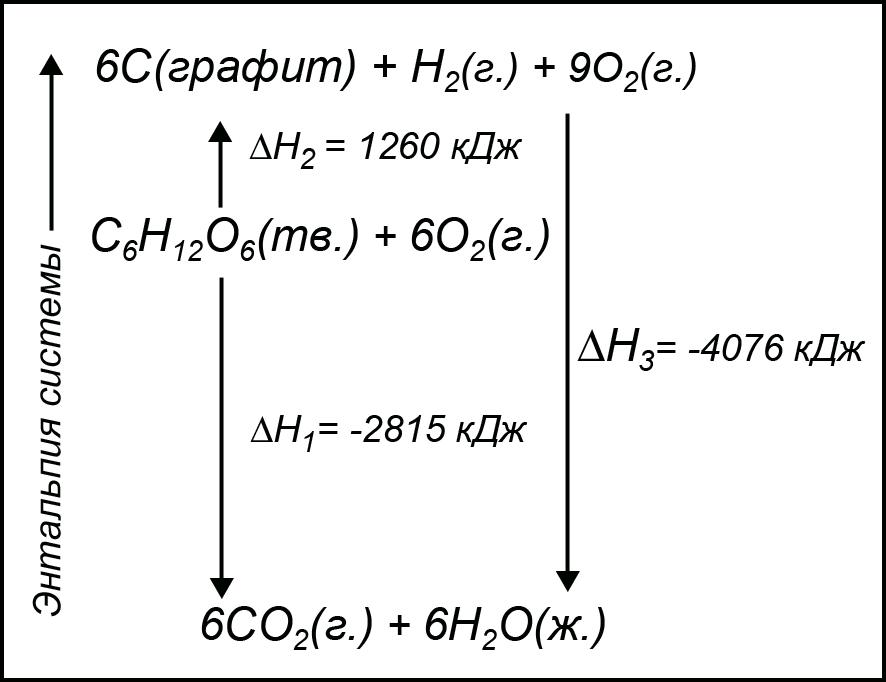
|
Рис. 1.3. Путь реакции горения глюкозы. |
Подобный путь реакции горения глюкозы схематически изображен на рис.1.3.
Поскольку
|
УПРАЖНЕНИЕ 1.5
Сравните количество теплоты, образующееся при сгорании 1,00 г глюкозы С6Н12О6, с количеством теплоты, которое выделяется при сгорании 1,00 г сахарозы С12Н22О11.
Решение:
Пример,
разобранный в тексте, показывает, что
при сгорании одного моля глюкозы
![]() = - 2816 кДж. Молекулярная масса глюкозы
равна 180 а. е. м. Следовательно, теплота,
выделяемая в расчете на грамм глюкозы,
должна быть равна
= - 2816 кДж. Молекулярная масса глюкозы
равна 180 а. е. м. Следовательно, теплота,
выделяемая в расчете на грамм глюкозы,
должна быть равна![]() (- 2816 кДж/моль) × (1 моль/180 г) = - 15,6 кДж/г.
Для сахарозы находим:
(- 2816 кДж/моль) × (1 моль/180 г) = - 15,6 кДж/г.
Для сахарозы находим:
С12Н22О11 (тв.) + 12СО2 (г.) → 12О2 (г.) + 11Н2О (ж.)
![]() реакции
= [12×
реакции
= [12×![]() (СО2)+11×
(СО2)+11×![]() (H2O)]
– [
(H2O)]
– [![]() × (C12H22O11)
+ +12×
× (C12H22O11)
+ +12×![]() (О2)
= 12×(-393,5 кДж) + 11×(-285,9 кДж) - (-2221 кДж) =
(О2)
= 12×(-393,5 кДж) + 11×(-285,9 кДж) - (-2221 кДж) =
= (-4722 – 3145+2221) кДж = - 5646 кДж/моль С12Н22О11.
Молекулярная
масса сахарозы равна 342 а.е.м. Следовательно,
теплота, выделяемая при сгорании 1 г
сахарозы, должна быть равна
![]() (-
5646 кДж/моль)(1 моль/342 г) = -16,5 кДж/г.
(-
5646 кДж/моль)(1 моль/342 г) = -16,5 кДж/г.
Сахароза и глюкоза относятся к классу соединений, называемых углеводами. При сгорании любого углевода выделяется приблизительно одинаковое количество энергии – примерно 17 кДж (иначе, 4 ккал, или 4 Кал).
УПРАЖНЕНИЕ 1.6
Стандартное изменение энтальпии реакции СаСО3 (тв.) → СаО (тв.) + СО2 (г.) равно 178,1 кДж. По стандартным теплотам образования, приведенным в табл. 1.1, вычислите стандартную теплоту образования СаСО3 (тв.).
Решение: Стандартное изменение энтальпии данной реакции можно записать следующим образом:
![]() реакции
= [
реакции
= [![]() (СаО) +
(СаО) +![]() (СО2)]
–
(СО2)]
–
![]() (CаСО3)
(CаСО3)
Подставляя сюда известные значения, получим:
178,1
кДж = - 635,5 кДж – 393,5 кДж -
![]() (СаСО3)
(СаСО3)
![]() (СаСО3)
= - 1207,1 кДж/моль
(СаСО3)
= - 1207,1 кДж/моль