
- •Методы количественного анализа
- •Весовой метод
- •Объемный анализ (титриметрия)
- •Классификация методов объемного анализа
- •Посуда, применяемая в объемном анализе
- •Способы приготовления титрованных растворов
- •1.Растворы с концентрацией, рассчитанной по точной навеске.
- •2. Растворы с установленной концентрацией
- •3. Использование фиксаналов Методы проведения титриметрического анализа
- •Расчеты в объемном анализе. Применение закона эквивалентов
- •Например: в реакции:
- •Метод нейтрализации
- •Определение эквивалентной точки
- •Метод перманганатометрии
- •Метод йодометрии
- •Комплексонометрический метод
Метод йодометрии
I. Сущность метода
В этом методе используются окислительные свойства свободного йода и восстановительные свойства йодид-ионов:
I2 + 2e = 2I- φo = + 0,54 B
1. Применяя рабочий раствор йода, можно определить количество различных восстановителей, окислительно-восстановительный потенциал которых меньше потенциала системы I2/2I-.
2. Используя растворы йодидов, например KI, можно определять количество окислителей, окислительный потенциал которых выше, чем потенциал системы I2/2I-.
Окисление восстановителей производят непосредственным титрованием раствора восстановителя рабочим раствором йода. Примером может служить определение сульфита натрия, который реагирует с I2 по уравнению:
I2 + Na2SO3 + H2O = Na2SO4 + 2HI
Аналогичным образом можно определить количество SnCl2, H2S и сульфидов, H3AsO3. и других восстановителей.
Однако йодометрическсе определение восстановителей прямым титрованием рабочим раствором иода не находит широкого применения. Гораздо чаще их определяют титрованием по остатку. Для этого к раствору, содержащему восстановитель, прибавляют в избытке рабочий раствор I2, как это делают, например, при определении содержания серовсдорсда в сероводородной воде:
H2S + 12 = S0 + 2HI
Остаток I2 оттитровывают рабочим раствором тиосульфата натрия.Na2S2O3 по реакции:
2Na2S2O3 + I2 = Na2S4O6 + 2NaI
f(Na2S2O3) = 1; f(I2) = 1/2.
Наиболее широкое применение иодометрический метод находит для определения количества окислителей по методу замещения. Так определяют перманганат, дихромат, Cu2+, Fe3+, ClO- и др.
Например, при определении количества КMпО4 к раствору перманганата в кислой среде приливают раствор КI (который является вспомогательным раствором), причем выделяется I2, количество которого эквивалентно содержанию КМпО4, (первая стадия):
2KMnO4 + 10KI + 8H2SO4 = 5I2 + 2MnSO4 + 6K2SO4 + 8H2O.
f(KMnO4) = 1/5; f(KI) = 1.
Выделившийся йод оттитровывают рабочим раствором тиосульфата натрия (вторая стадия):
2Na2S2O3 + I2 = 2NaI + Na2S4O6 .
Осуществить такое определение непосредственно титрованием окислителей раствором KI невозможно, т.к. не удается заметить окончание образования 12, резкого изменения внешнего вида раствора не наблюдается.
Прямое титрование окислителей раствором тиосульфата натрия также невозможно, потому что реакция протекает очень сложно и образуется смесь продуктов неопределенного состава, вследствие чего нельзя произвести расчет.
3. Кроме окислителей и восстановителей методом йодометрии можно определять количество сильных кислот. Определение их основано на том, что в нейтральной среде KI и КIO3 не взаимодействуют, но если к смеси KI + К103 добавить кислоты, то идет выделение свободного иода по уравнению:
KIO3 + 5KI + 6HCl = 3I2 + 6KCl + 3H2O
f(KIO3) = 1/5; f(KI) = 1; f(HCl) = 1/6.
Из уравнения реакции следует, что кислота участвует в реакции и количество выделившегося йода эквивалентно количеству имевшейся в растворе кислоты.
Определение точки эквивалентности
Точку эквивалентности в йодометрии можно определить по появлению или исчезновению 12, водный раствор которого в присутствии КI довольно интенсивно окрашен в желто-коричневый цвет(комплекс KI3) . Однако гораздо более точные результаты получается при введении индикатора - раствора крахмала. Крахмал с I3- адсорбционное соединение темно-синего цвета. В этом соединении молекула йода деформирована, благодаря чему она меняет свою окраску из коричневой в темно-синию.
При непосредственном титровании восстановителей. например SnCI2, Na2HAsO3 и др., крахмал прибавляют перед началом титрования.
При титровании восстановителей по остатку, а также при определении окислителей и кислот по методу замещения крахмал прибавляют к реакционной смеси в конце титрования, когда раствор из бурого станет бледно-желтым. Иначе крахмал будет адсорбировать большие количества йода и медленно его отдавать в раствор, вследствие чего будет затрачен избыток тиосульфата натрия и искажены результаты титрования.
Условия выполнения иодометрических определений
1) Свободный йод летуч и при нагревании летучесть его увеличивается. Чувствительность крахмала как индикатора (адсорбция) с повышением температуры понижается.
Поэтому титрование следует вести на холоду.
2) Иод реагирует со щелочами согласно уравнению:
3I2 + 6NaOH = NaIO3 + 5NaI + 3H2O
Поэтому иодометрические определения нельзя проводить в сильно- щелочной среде. Результат анализа при этом не может быть точным.
3) Реакции, протекающие при иодометрических определениях, являются не очень быстрыми.
Для увеличения скорости реакции иодида калия с окислителем берется избыток серной кислоты и иодида. Реакционной смеси дают постоять 5-6 мин
4) Конец титрования устанавливают по исчезновению (или появлению) синей окраски, присущей крахмалу в присутствии свободного йода.
Следует помнить, что раствор должен обесцветиться от одной капли тиосульфата натрия. Дальнейшее прибавление последнего не изменит окраски титруемого раствора, но сделает анализ неверным.
С помощью йодометрических титровании находят количество сахара в крови, определяют константу скорости реакции окисления KI действием Н2О2 и т.д.
Приготовление рабочих растворов
В иодометрии используется два рабочих раствора: I2 и Na2S2O3 , а также вспомогательный раствор KI(произвольной концентрации – обычно 10%).
а) Рабочий раствор йода.
Свободный йод, очищенный возгонкой, удовлетворяет требованиям, предъявляемым к исходным веществам, поэтому титрованный раствор его готовят растворением точной навески I2 в водном растворе KI. При этом происходит образование комплексного соединения: KI + I2 = K[I3]
Образование комплекса не отражается на скорости взаимодействия рабочего раствора иода с восстановителем из-за малой прочности [I3]-
б) Рабочий раствор тиосульфата натрия
В отличие от йода тиосульфат натрия Na2S2O3 · 5H2O
является сравнительно нестойким веществом, и при растворении его в дистиллированной воде, в которой имеется углекислый газ, происходит следующая реакция:
Na2S2O3 + CO2 + H2O = NaHCO3 + NaHSO3 + S
Этот процесс идет очень медленно, т.к. концентрация СО2 невелика (закон действия масс), и заканчивается дней через 10. Тиосульфат натрия может также разлагаться тиобактериями и окисляться кислородом воздуха. Поэтому необходимо:
а) взвешивать рассчитанное количество Na2S2O3 · 5H2O на технохимических весах;
б) растворять в свежепрокипяченной и охлажденной без доступа CO2 дистиллированной воде;
в) определять концентрацию раствора не раньше, чем через 10 дней;
г) защищать раствор тиосульфата от углекислого газа и света(способствует
размножению тиобактерий).
В качестве исходного вещества для установления концентрации раствора Na2S2O3 обычно применяют дихромат калия K2Cr2O7.
Лабораторная работа
ОПРЕДЕЛЕНИЕ КОНЦЕНТРАЦИИ РАСТВОРА Na2S2O3 по K2Cr2O7
Kак уже отмечалось выше, непосредственное титрование раствора дихромата раствором тиосульфата натрия невозможно, т.к образуется несколько продуктов реакция – Na2SO4,Na2S4O6 и другие, т.е. не соблюдается одно из основных требований к реакциям объемного анализа.
Титрование ведут по методу замещения. Реакция идет в две стадии:
I) Дихромат калия – К2Сг2О7,, взаимодействуя с KI, выделяет эквивалентное количество I2 в соответствии с уравнением:
K2Cr2O7 + 6KI + 7H2SO4 = Cr2(SO4)3 +4K2SO4 + 3I2 + 7H2O
f(K2Cr2O7) = 1/6; f(KI) = 1.
2) Выделившийся I2 оттитровывают раствором Na2S2O3 – количество Na2S2O3, пошедшее на титрование, эквивалентно вступившему в реакцию количеству K2Cr2O7.
I2 + Na2S2O3 = 2NaI + Na2S4O6
f(I2) = 1/2; f(Na2S2O3) = 1.
В соответствии с законом эквивалентов:
C(1/6 K2Cr2O7) · V(K2Cr2O7) = C(Na2S2O3) · V(Na2S2O3)
Приготовление раствора исходного вещества - дихромата калия по точной навеске
Расчет навески
m(K2Cr2O7) = C(1/6 K2Cr2O7) · M(1/6 K2Cr2O7) · Vколбы
Например, необходимо приготовить 250 мл 0,02н K2Cr2O7 .
m(K2Cr2O7) = 0,02 · 49,04 · 0,25 = 0,2452 г
Порядок титрования
В бюретку наливают раствор тиосульфата натрия. В колбу для титрования – растворы дихромата калия, серной кислоты и иодида калия. Индикатор - раствор крахмала (добавляет в конце титрования).
Ход определения
В колбу для титрования пипеткой переносят из мерной колбы 3 мл раствора K2Cr2O7, прибавляют 3 мл раствора KI и 3 мл 2н раствора Н2SO4, отмеривая их мерной пробиркой или пипеткой. Колбу закрывают часовым стеклом и дают стоять 5 минут, защищая от прямых солнечных лучей.
По истечении указанного срока (не ранее) к реакционной смеси добавляют 10 мл дистиллированной воды и титруют раствором тиосульфата натрия до светло-желтой окраски. Затем прибавляют 0,5 мл раствора крахмала (10 капель). Раствор при этом окрасится в интенсивно синий цвет. Не фиксируя расход Na2S2O3 и не доливая раствор его в бюретку, продолжают титрование до исчезновения синей окраски. Во время титрования необходимо энергично размешивать содержимое колбы, чтобы уловить тот момент, когда от одной капли раствора Na2S2O3 синяя окраска исчезнет.
Нужно помнить, что раствор при этом не станет совсем бесцветным, а будет слабо окрашен в светло-зеленый цвет, присущий ионам Cr3+(точнее [Cr(H2O)6]3+ ), возникающим в результате реакции Титрование повторяют до получения сходящихся результатов и производят расчет концентрации тиосульфата натрия. Результаты экспериментов оформляются в виде таблицы:
|
№ опыта |
V(K2Cr2O7) |
V(Na2S2O3) |
|
1 2 3
|
3,0 3,0 3,0
|
V1 V2 V3 Vср. |
С(Na2S2O3) = C(1/6 K2Cr2O7) V(K2Cr2O7) / V(Na2S2O3)
Лабораторная работа
ОПРЕДЕЛЕНИЕ МАССЫ ХЛОРАМИНА Б
Хлорамин Б – кристаллогидрат N-хлорбензолсульфамида натрия
C6H5SO2N(Cl)Na · 3H2O. M (C6H5SO2N(Cl)Na · 3H2O) = 267,5 г/моль.
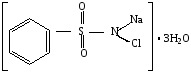
2% раствор хлорамина Б в воде используется в целях дезинфекции. При растворении хлорамина Б в воде образуется гипохлорит-ион ClO-:
C6H5SO2N(Cl)Na + H2O = C6H5SO2NH2 + ClO- + Na+
Дезинфицирующее действие гипохлорит-иона объясняется его сильной окислительной способностью:
ClO- + H2O + 2e = Cl- + 2OH- φo = + 0,88 B
Определение гипохлорит-иона, эквивалентное содержанию хлорамина Б, также как и других окислителей, основано на следующих реакциях:
ClO- + 2I- + 2H+ = I2 + Cl- + H2O
f(хлорамин Б) = 1/2
I2 + S2O32- = 2I- + S4O62-
Ход определения
Раствор хлорамина Б получают от преподавателя в мерной колбе на 100 мл, содержимое колбы разбавляют дистиллированной водой до метки и тщательно перемешивают. В колбу для титрования пипеткой переносят из мерной колбы 3 мл раствора хлорамина Б, прибавляют 3 мл раствора KI и 3 мл 2н раствора Н2SO4, отмеривая их мерной пробиркой или пипеткой. Колбу закрывают часовым стеклом и дают стоять 5 минут, защищая от прямых солнечных лучей. По истечении указанного срока (не ранее) к реакционной смеси добавляют 10 мл дистиллированной воды и титруют раствором тиосульфата натрия до светло-желтой окраски. Затем прибавляют 0,5 мл раствора крахмала (10 капель). Раствор при этом окрасится в интенсивно синий цвет. Не фиксируя расход Na2S2O3 и не доливая раствор его в бюретку, продолжают титрование до исчезновения синей окраски. Во время титрования необходимо энергично размешивать содержимое колбы, чтобы уловить тот момент, когда от одной капли раствора Na2S2O3 синяя окраска исчезнет. Титрование повторяют до получения сходящихся результатов. Результаты опытов представляются в виде таблицы:
|
№ опыта |
V( хлорамина Б) |
V(Na2S2O3) |
|
1 2 3 |
3,0 3,0 3,0 |
V1 V2 V3 Vср. |
C(1/2 C6H5SO2N(Cl)Na ∙ 3H2O )∙ V(C6H5SO2N(Cl)Na ∙ 3H2O) = C(Na2S2O3) ∙Vср.(Na2S2O3)
Отсюда
C(1/2 C6H5SO2N(Cl)Na
∙ 3H2O
) =

m(хлорамин Б) = C(1/2 C6H5SO2N(Cl)Na ∙3H2O) ∙ M(1/2 C6H5SO2N(Cl)Na ∙3H2O) ∙ V(колбы).
