
Posobie_farmakologia_chast_1
.pdf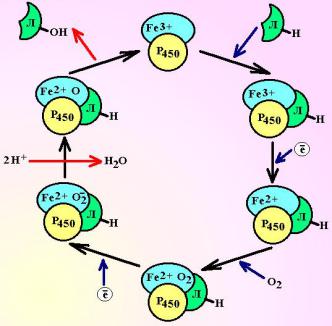
21
ствляет фермент псевдохолинэстераза (бутирилхолинэстераза), который имеет низкую субстратную специфичность и может гидролизовать любую эфирную связь.
Путем гидролиза протекает метаболизм эналаприла, тестостерона пропионата (эфирный гидролиз), лидокаина (амидный гидролиз).
Окисление. Окисление биологических субстратов – универсальный механизм инактивации ксенобиотиков, который обеспечивают микросомальные ферменты печени. Это группа липофильных белков, сосредоточенная в мембранах эндоплазматического ретикулума гепатоцитов. Основой микросомальной системы ферментов являются 2 энзима: флавопротеин- НАДФ·Н-зависимая цитохром Р450 редуктаза и гемопротеин цитохром Р450.
Первоначально, окисленный Р450 присоединяет лекарственное вещество. Затем, комплекс цитохром-лекарство восстанавливается НАДФ·Н-зависимой редуктазой и присоединяет кислород. Для активации молекулы кислорода НАДФ·Н-зависимая редуктаза повторяет цикл восстановления. На финальном этапе, один из атомов кислорода включается в молекулу воды, а второй – в лекарственное вещество, после чего цитохром регенерирует в исходное состояние.
Цитохром Р450 является не 1 ферментом, а суперсемейством из более чем 300 изоформ, способных катализировать около 60 типов окислительных реакций, с сотнями потенциальных субстратов. Фактически, цитохромы способны обеспечить окисление не только всех существующих в
Схема 6. Цикл микросомального окисления. Пояснения настоящее время молекул лекарств, но и
в тексте. Л – лекарственное вещество. |
все лекарства, которые когда-либо еще бу- |
|
|
|
дут синтезированы. |
Молекулы цитохрома Р450, которые функционируют в клетках человека могут быть объединены в 17 семейств: CYP1-CYP17. Наибольшую роль в метаболизме лекарств играют первые 3 семейства CYP1-CYP3 (из них изоформы CYP3A4/3A5 и CYP2D6 метаболизируют 75% всех лекарств).
II фаза – синтетические реакции метаболизма. Как правило, эти реакции протекают только после того, как завершиться фаза I. Синтетические реакции метаболизма призваны повысить гидрофильность ксенобиотика. Все реакции этой группы могут быть разделены на 2 вида:
Реакции, в которых активируется конъюгирующее вещество:
Глюкуронизация;
Ацетилирование;
Сульфатирование;
Метилирование.
Реакции, в которых активируется ксенобиотик:
Глицилирование.
Основной реакцией конъюгации в организме взрослого человека является глюкуронизация.
Индивидуальные различия в скорости метаболизма лекарств
Индивидуальность скорости метаболизма лекарственных веществ в организме человека связана со следующими факторами:
1.Возрастом и полом. У плода система ферментов печени начинает функционировать уже на 6-8 неделе беременности, однако, активность ферментов биотрансформации к моменту

22
рождения ребенка составляет только 20-80% активности взрослого. Отмечаются и качественные различия: глюкуронизация и сульфатирование лекарств в полной мере формируются только к концу первого года жизни. Основной реакцией метаболизма в организме ребенка является метилирование (так, теофиллин трансформируется у него в кофеин), а основным цитохромом CYP3A7 изоформа (которая у взрослого практически не принимает участия в окислении лекарств).
Схема 7. Синтетические реакции метаболизма. 1 – глюкуронизация; 2 – ацетилирование; 3 – метилирование; 4 – сульфатирование; 5 – глицилирование (обратите внимание, что в данном случае реакция протекает с активированным ксенобиотиком, а не конъюгирующим веществом).
В пожилом возрасте наблюдается снижение скорости метаболизма лекарств, обусловленное дегенеративными изменениями в клетках печени, снижением кровотока через нее. Снижается интенсивность процессов ацетилирования и усиливается доля окислительных реакций.
Половые различия наиболее четко сказываются на активности цитохрома Р450. Андрогены являются индукторами микросомальных ферментов, поэтому скорость оксилительного метаболизма в организме мужчины выше, чем у женщины (эстрогены и гестагены являются ингибиторами микросомальных ферментов).
2.Заболеваниями, влияющими на метаболизм лекарств. Острые и хронические заболе-
вания печени, связанные с гибелью гепатоцитов (гепатиты, циррозы) приводят к замед-
23
лению метаболизма лекарств в связи с потерей ферментативных систем, развитием пор- то-кавальных анастомозов и сбросом крови из воротной вены в нижнюю полую вену минуя печень. Заболевания сердца, приводящие к хронической застойной сердечной недостаточности снижают интенсивность кровотока в печени и могут нарушать метаболизм лекарств путем снижения скорости их поступления в печень.
3.Воздействием лекарственных веществ на системы метаболизма. Некоторые лекарственные вещества не только метаболизируются ферментативными системами нашего организма, но и оказывают на них непосредственное воздействие. Различают индукторы и ингибиторы биотрансформации.
Индукторы метаболизма это вещества, которые повышают скорость метаболизма лекарств при регулярном применении. Это связано с их способностью стимулировать синтез ферментов биотрансформации. Наиболее важными индукторами являются производные барбитуровой кислоты, фенитоин (противоэпилептическое средство), антибиотики рифампицин и гризеофульвин, глюкокортикостероиды и анаболические стероиды. Индукция микросомальных ферментов приводит к парадоксальному ослаблению эффектов лекарств, которые назначаются совместно с лекарствамииндукторами.
Ингибиторы биотрансформации – это вещества, которые снижают скорость метаболизма лекарств при повторном регулярном применении. Механизмы ингибирования различны и могут быть связаны как с прямой инактивацией цитохромов, так и с нару-
шением переноса электронов по цепи НАДН2-зависимых флавопротеинов. Наиболее известными ингибиторами являются циметидин (Н2-гистаминоблокатор), эритромицин (макролидный антибиотик), кетоконазол (противогрибковое средство). Ингибирование ферментов приводит к парадоксальному усилению эффектов лекарственных веществ, которые назначаются совместно с лекарствами-ингибиторами. Иногда это может даже спровоцировать развитие интоксикации, несмотря на то, что лекарство применяют в обычных терапевтических дозах.
4.Генетические особенности организма. Гены, кодирующие синтез белков-ферментов могут быть представлены несколькими аллелями с разной степенью экспрессии. Так, например, по активности ацетилирования все люди могут быть разделены на группы быстрых, умеренных и медленных ацетиляторов. При лечении лекарственными средствами, которые метаболизируются путем ацетилирования (прокаинамид, гидралазин, изониазид) у людей из группы медленных ацетиляторов биотрансформация лекарств будет замедлена. Это не скажется на общей эффективности терапии, но может привести к проявлению токсического действия лекарства. Кроме того, установлена корреляция между развитием рака мочевого пузыря и медленным фенотипом ацетилирования, а также раком кишечника и быстрым фенотипом ацетилирования. Среди эскимосов доля медленных ацетиляторов составляет 5%, у японцев – 5-10%, у жителей Западной Европы и Америки – 45-50%.
Эффект первого прохождения. Пролекарства. «Суицидальные» лекарства.
Эффектом первого прохождения или пресистемным метаболизмом называют процесс биотрансформации лекарства, который приводит к его инактивации еще до того, как лекарство попадет в системный кровоток. В пресистемной элиминации при пероральном введении лекарства участвуют ферментативные системы кишечника, крови воротной вены и гепатоциты.
Величина пресистемной элиминации может достигать 90-95%, что делает пероральное введение такого лекарства бессмысленным. Естественно, что при внутривенном введении пресистемный метаболизм отсутствует.
Для того, чтобы лекарство оказало полезное действие можно увеличить его дозу, что и выполняют на практике. Например, при пероральном введении доза пропранолола составляет 40-120 мг, тогда как при внутривенном введении используют дозы от 3 до 5 мг этого лекарства.
Пролекарства – это фармакологически неактивные вещества, которые при введении в
организм, подвергаются метаболизму и приобретают фармакологическую активность. Наи-
24
более распространенный способ создания пролекарств – это получение их сложных эфиров, которые в организме гидролизуются и выделяют активное вещество. Например, ингибитор АПФ эналаприл является малеиновым эфиром эналаприлата. При введении в организм, гидролазами печени он расщепляется и выделяет активный эналаприлат, который блокирует АПФ в 100 раз активнее, чем сам эналаприл.
Как уже было упомянуто выше, конечная цель метаболизма – лишение лекарства фармакологической активности. Однако, в ряде случаев, метаболизм лекарств приводит к иным результатам:
При метаболизме фармакологически активного вещества могут образовываться фармакологически активные метаболиты. Например, при метаболизме диазепама образуется транквилизирующее соединение оксазепам, при метаболизме морфина – весьма активный анальгетик морфин-глюкуронид. Образование фармакологически активного метаболита способствует продлению фармакологического эффекта лекарства.
«Суицидальный» метаболизм. Иногда в процессе метаболизма лекарства образуется метаболит, который оказывает на метаболизирующую клетку токсическое действие. Классическим примером такого суицидального метаболизма является метаболизм парацетамола. Основным путем его биотрансформации является конъюгация (реакция II фазы). Однако, при приеме высоких доз парацетамола или в том случае, если количество конъюгирующих субстратов низкое, парацетамол начинает метаболизироваться минорным путем в реакциях I фа-
зы метаболизма. При этом он окисляется цитохромом Р450 до N-ацетилбензохинона, который необратимо повреждает белки и нуклеиновые кислоты гепатоцитов.
Выведение лекарственных средств из организма
Лекарственные вещества и их метаболиты выводятся из организма следующими путями:
через почки (с мочой);
через печень (с желчью);
через легкие (с выдыхаемым воздухом, мокротой);
через кожу и слизистые с секретами расположенных в них желез (сальные, потовые, слизистые, слюнные);
через молочные железы (с молоком).
Выведение через почки. Почечная экскреция – основной путь выведения для большинства лекарств. Она представляет собой совокупность 3 процессов – клубочковой фильтрации, проксимальной канальцевой секреции и дистальной канальцевой реабсорбции.
Фильтрация – процесс фильтрации лекарства протекает пассивно и зависит только от наличия градиента гидростатического давления между петлями сосудов клубочка и капсулой канальца, а также концентрации лекарственного средства. Процесс фильтрации протекает через специальные поры – фенестры, диаметр которых составляет 2-4 нм, что в 10 раз больше диаметра пор в обычных капиллярах. В связи с этим, процессу фильтрации в почках подвергаются лекарственные вещества с молекулярной массой не более 5.00010.000 Да. Фильтруются только не связанные с белком молекулы лекарства, а скорость
экскреции лекарства пропорциональна его несвязанной фракции (fu) и скорости фильтрации крови в клубочке (СФК=120 мл/мин): СЭ=fu СФК.
Проксимальная секреция. Клетки проксимального отдела нефрона содержат особые бел- ки-переносчики, которые имеют низкую субстратную специфичность и способны транспортировать вещества лишь на основании их принадлежности к классу слабых кислот или слабых оснований. В настоящее время установлено, что по меньшей мере имеется 2 типа белков-переносчиков: транспортеры слабых кислот и и транспортеры слабых оснований. Выделение лекарств путем секреции не зависит ни от заряда молекулы, ни от ее размера или связи с белками плазмы.
В клинической практике иногда используют вещества, которые блокируют систему проксимальной секреции лекарств, чтобы замедлить выведение лекарств и продлить их эффект. Например, пробенецид блокирует систему белков переносчиков для слабых кислот и замедляет элиминацию пенициллина, продлевая его терапевтический эффект.
25
Дистальная канальцевая реабсорбция. По мере продвижения лекарственного вещества по канальцу нефрона за счет концентрирования мочи уровень лекарственного вещества в ней повышается. Как только концентрация лекарства в моче превысит его уровень в окружающей нефрон ткани, начинается процесс обратной реабсорбции. Процесс реабсорбции протекает путем липидной диффузии, т.е. зависит от концентрационного градиента и липофильности молекул лекарства. Количественно он характеризуется уже рассмотрен-
ной выше зависимостью Henderson-Hasselbach и может регулироваться путем изменения рН мочи.
Выведение через печень. Экскреция лекарства с желчью протекает в основном в виде конъюгатов с глюкуроновой кислотой и включает 2 процесса – перенос лекарства из крови в гепатоцит с его последующей конъюгацией и затем выделение в просвет желчного капилляра. Перенос лекарства в гепатоцит осуществляется как путем фильтрации, так и при помощи активного транспорта переносчиками для слабых кислот и оснований (фактически аналогичными почечным переносчикам).
После конъюгации лекарства выделяется с током желчи в 12-перстную кишку. В дальнейшем, продвигаясь по кишечнику, конъюгат лекарства может подвергаться бактериальному гидролизу, с высвобождением активной формы лекарства, которая вновь способна всасываться и поступать в кровоток. Движение лекарства по циклической системе: кровоток → печень → желчные пути → кишечник → кровоток называется энтерогепатической циркуляцией лекарства. Благодаря такой циркуляции эффект лекарства сохраняется более длительное время. Печеночная элиминация и энтерогепатическая циркуляция характерны для дигоксина, морфина, хлорамфеникола.
Феномен энтерогепатической циркуляции используют для лечения отравлений. Например, при передозировке опиоидных анальгетиков (даже при условии их внутривенного введения), проводят промывание желудка и назначают активированный уголь. Эти мероприятия позволяют связать ту часть лекарства, которая проходит цикл энтерогепатической циркуляции и значительно понизить его концентрацию в организме.
Выведение через легкие. Через легкие выделяются, главным образом, пары летучих жидкостей и газов, которые применяются в анестезиологии. Кроме того, альвеолярным путем выводятся из организма спирт, соли брома и йода, камфара.
Выведение с грудным молоком. Этот путь элиминации не является, как правило, ведущим для лекарств (единственным исключением, пожалуй, следует считать соли ртути – грудное молоко является для соединений ртути основным путем элиминации). Элиминация веществ с молоком имеет важное значение при использовании у кормящих матерей лекарств, которые обладают потенциально токсичными для ребенка свойствами. В таких случаях следует отлучать ребенка от груди и переводить его на искусственное вскармливание.
Кожная элиминация лекарств может применяться с фармакотерапевтическими целями. Например, противогрибковое средство тербинафин концентрируется в сальных железах кожи и выводится с их секретом, создавая на коже фунгицидные концентрации лекарства.
Количественные законы элиминации лекарств. Кинетика элиминации первого и нулевого порядка.
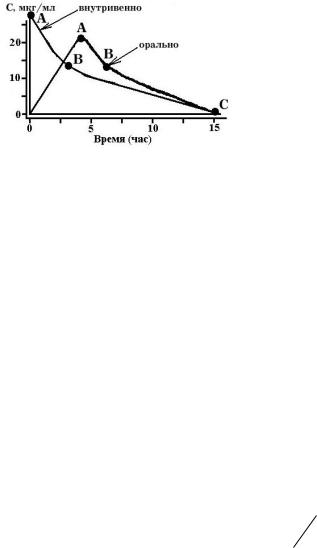
После введения лекарства в организм, его концентрация в крови вначале возрастает от нуля до некоторого уровня (при внутривенном введении это происходит практически мгновенно), а затем начинает снижаться, вследствие процессов элиминации и распределения. Таким образом, на графике зависимости концентрации лекарства в крови, от времени после его введения можно выделить 3 отрезка (см. схему 8):
0А – участок возрастания концентрации лекарственного вещества, отражает, главным образом, процесс его абсорбции. Элиминация и распределение вещества в этот промежуток незначительны и начинают играть существенную роль лишь к его концу. При внутривенном введении определить эту фазу невозможно.
26
АВ – участок, отражающий, главным образом, распределение лекарства в ткани, процессы абсорбции к этому времени практически завершились, а элиминация продолжает нарастать.
ВС – участок элиминации лекарственного вещества, отражает, главным образом, процесс удаления активной формы лекарства из организма. К этому времени фаза абсорбции практически завершилась, а распределение лекарственного вещества находится в состоя-
нии равновесия.
Схема 8. Фармакокинетические кривые изменения концентрации лекарства в крови, после его однократного введения в организм.
Поскольку процесс элиминации лекарства носит вид ферментативной реакции (в случае его биотрансформации) или простого массопереноса (в случае экскреции), то очевидно, что он подчиняется законам химической кинетики и описывается классическим уравнением Михаэлиса-Ментен:
dC |
|
Vmax C |
dt |
V C |
|
|
|
50 |
При этом, фактически, при введении в организм лекарственного средства возникают 2 возможные ситуации:
Если уровень концентрации лекарства в организме (С) значительно меньше, чем величина его полумаксимальной скорости элиминации (V50), т.е. С<<V50, уравнение сводится к виду:
dC |
|
Vmax |
C или |
dC |
kC . |
|
|
|
|||
dt |
|
V50 |
dt |
|
|
Это дифференциальное уравнение 1-го порядка (поэтому и кинетика такой элиминации получила название кинетики первого порядка), которое показывает, что скорость элиминации лекарства пропорциональна его концентрации в организме. Решая это уравнение находим, что: С=С0 е-kt.
Таким образом, кинетикой элиминации первого порядка называют такой вид элиминации лекарства, при котором скорость удаления лекарственного вещества из крови пропорциональна его концентрации в организме и в единицу времени элиминируется постоянная доля (фракция) лекарства. График кинетики элиминации первого порядка имеет вид экспоненциальной кривой и может быть линеаризован в полулогарифмических координатах. Большинство современных лекарств элиминируется кинетикой первого порядка.
Если уровень концентрации лекарства в организме значительно превышает полумаксимальную скорость его элиминации (C>>V50), то уравнение сводится к виду:
dC |
Vmax |
|
или |
dC |
k . |
|
dt |
V50 |
dt |
||||
|
|
|
Это дифференциальное уравнение нулевого порядка, поэтому такой вид кинетики называют кинетикой элиминации нулевого порядка. Данное уравнение показывает, что скорость элиминации лекарства является величиной постоянной и не зависит от его концентрации в организме. Решая уравнение можно найти, что С=С0-kt.
Таким образом, кинетикой элиминации нулевого порядка называют такой вид элиминации, при котором скорость удаления лекарственного вещества из организма постоянна и в единицу времени элиминируется постоянное количество лекарственного вещества. График кинетики нулевого порядка имеет вид прямой линии в обычных координатах.
Кинетика элиминации нулевого порядка встречается относительно редко:
При инфузионном капельном введении лекарственного средства с постоянной скоростью. В этом случае она описывает фазу поступления лекарства.
При абсорбции лекарства из депо-форм (лекарственные формы продленного действия), которая протекает также с постоянной скоростью.
При насыщаемом метаболизме, т.е. в тех случаях, когда вводимая доза лекарства превышает возможности ферментов метаболизма по утилизации лекарственного средства. Та-

27
кая ситуация возникает при введении высоких доз этанола, ацетилсалициловой кислоты, фенитоина.
Схема 9. Типичные формы фармакокинетических кривых при различных вариантах кинетики. Слева пред-
ставлена кривая элиминации лекарства в соответствии с кинетикой первого порядка. В центре – та же кривая после преобразования оси концентраций в логарифмическую форму. Справа представлена кривая кинетики нулевого порядка.
Крайне редко может возникнуть ситуация, при которой концентрация лекарственного средства, которая создается в организме, сопоставима с его полумаксимальной скоростью элиминации (СV50). В этом случае наблюдается классическая нелинейная кинетика Миха- элиса-Ментен, которая может быть представлена как результирующая суммы 2 кинетических процессов: при высоких дозах имеет место кинетика нулевого порядка, а по мере их снижения она трансформируется в кинетику первого порядка.
Возникает этот вариант кинетики редко, например, при использовании высоких доз клофибрата или дизопирамида у пациентов с гипоальбуминемией (т.к. это лекарственные средства имеют насыщаемую кинетику связывания с белком и обычную кинетику элиминации первого порядка).
Клиренс и период полуэлиминации, их значение для управления режимом дозирования.
Процесс элиминации первого порядка может быть охарактеризован величиной клиренса, константы скорости элиминации и периодом полуэлиминации, которые являются величинами постоянными для каждого лекарственного средства.
Константа скорости элиминации (kel, мин-1) – показывает, какая часть лекарственного средства элиминируется из организма в единицу времени. Значение kel обычно находят путем решения фармакокинетического уравнения, описывающего процесс элиминации лекарства из крови, поэтому kel называют модельным показателем кинетики. Непосредственного отношения к планированию режима дозирования kel не имеет, но ее значение используют для расчета других фармакокинетических параметров.
Клиренс (Cl, мл/мин). Клиренс можно определить как объем крови, который очищается от лекарственного средства за единицу времени. Поскольку плазма (кровь) выступает как «видимая» часть объема распределения, то, иными словами, клиренс – фракция объема распределения, из которой лекарство выделяется в единицу времени. Если обозначить общее количество лекарства в организме через Аобщ, а количество, которое выделилось через Авыд, то тогда:
Cl Авыд Vd *.
Аобщ
С другой стороны, из определения объема распределения следует, что общее количество лекарства в организме составляет Аобщ=Vd Cтер/плазма. Подставляя это значение в формулу клиренса, мы получим:
* Сравните с классической формулой, которую используют в физиологии для определения почечного клирен-
са: Cl Смоча Vмоча . Здесь и далее все формулы и расчеты приводятся для однокамерной модели фармако-
Сплазма
кинетики, т.е. исходят из положения о том, что лекарственное средство равномерно и с одинаковой скоростью распределяется по всем органам и тканям.

28
Cl |
Авыд |
|
скорость выделения |
. |
Стер / плазма |
Стер/плазма |
Таким образом, клиренс – отношение скорости выведения лекарственного средства к его концентрации в плазме крови. В таком виде формулу клиренса используют для расчета поддерживающей дозы лекарства (Dп), т.е той дозы лекарственного средства, которая должна скомпенсировать потерю лекарства и поддержать его уровень на постоянном уровне:
Скорость введения = скорость выведения = Cl Cтер (доза/мин) Dп = скорость введения ( - интервал, между приемом лекарства)
Различают общий клиренс, который отражает сумму всех процессов элиминации лекарства и клиренс каждого из органов элиминации (печени, почек, кожи, легких и др.). Таким
образом, Clобщий=Clпочки+ Clпечень+ Clдругие органы.
Период полуэлиминации (t½, мин-1) – это время, необходимое для снижения концентрации лекарственного вещества в крови ровно наполовину. При этом не играет роли каким путем достигается снижение концентрации – при помощи биотрансформации, экскреции или же за счет сочетания обоих процессов. Обычно период полуэлиминации определяют из соотношения:
t1 2 ln 2
kel
Все три показателя Vd, Cl и t½ связаны между собой следующими соотношениями:
t |
|
ln 2 Vd |
и k |
|
|
Cl |
. |
|
el |
|
|||||
1 2 |
|
Cl |
Vd |
||||
|
|
|
|||||
В случае кинетики нулевого порядка понятие константности клиренса, периода полуэлиминации и скорости элиминации утрачивает свой смысл – все эти параметры изменяются непрерывно, вместе с изменением концентрации лекарственного вещества в крови, т.е. они приобретают вид функциональной зависимости. Например, клиренс определяется как:
Cl |
Vmax |
, |
Km C |
где Кm – концентрация лекарства, при которой скорость его элиминации составляет 50% от максимальной.
Принципы дозирования лекарств. Доза, ее способы и варианты введения.
Дозой называют количество лекарства, предназначенное для введения в организм пациента. Доза может вводиться инъекционным способом, т.е. с нарушением целостности кожных покровов и неинъекционным способом (т.е. без нарушения целостности таковых).
Возможно 2 варианта введения доз:
Непрерывный, который осуществляют путем длительных внутрисосудистых инфузий (вливаний) лекарства капельным способом или через автоматические дозаторы – инфузоматы. При непрерывном введении лекарства, концентрация его в организме изменяется плавно и не подвергается значительным колебаниям.
Прерывистое введение, осуществляется как инъекционным, так и неинъекционным способами и представляет собой введение лекарства через определенные промежутки времени (интервалы дозирования). При прерывистом введении лекарства его концентрация в организме непрерывно колеблется. После приема определенной дозы она вначале повышается, а затем постепенно снижается, достигая минимальных значений перед очередным введением лекарства. Колебания концентрации тем значительнее, чем больше вводимая доза лекарства и интервал между введениями.
Основной целью лекарственной терапии является обеспечение в организме терапевтического уровня лекарства. Для этого используют введение вначале нагрузочной, а затем – поддерживающих доз лекарства. Напомним формулы для расчета этих доз:
Dн=Vd Cтер
Dп=Cl Cтер , где - интервал между введениями.

29
В случае инфузионного введения при расчете поддерживающей дозы множи-
|
тель принимают равным 1. |
|
|
Дискретное (прерывистое) введение |
|
|
|
лекарств |
|
При дискретном введении лекар- |
|
|
ственных средств между поддержи- |
|
|
вающей и насыщающей дозами суще- |
|
|
ствует следующая взаимосвязь: |
|
|
D D (1 е kel t ). |
|
|
п |
н |
|
Рассмотрим, как будет изменяться |
|
|
концентрация лекарства при его введе- |
|
|
нии в организм в постоянной дозе с по- |
|
|
стоянной скоростью (схема 11). |
|
|
Предположим, что мы назначили |
|
|
пациенту 50 ЕД некоторого лекарст- |
|
|
венного средства А, через каждый пе- |
|
|
риод полуэлиминации. Тогда, по про- |
|
|
шествии первого периода полуэлими- |
|
|
нации, когда в организме останется |
|
|
50% дозы (25 ЕД) мы введем вторую |
|
|
дозу лекарства и общий его уровень |
|
|
составит 25+50=75 ЕД. К концу второ- |
|
|
го периода полуэлиминации останется |
|
|
50% от этого количества лекарства или |
|
Схема 10. Способы введения лекарств и создаваемая в орга- |
37,5 ЕД (12,5 ЕД остаток от первой до- |
|
низме при этом концентрация лекарства. А – непрерывная |
зы и 25 ЕД – остаток от второй дозы), а |
|
инфузия (20 ЕД/сут), В - прерывистое введение 10 ЕД 2 раза в |
после введения вновь 50 ЕД уровень |
|
день, С – прерывистое введение 20 ЕД 1 раз в сутки. |
лекарства достигнет 87,5 ЕД. Рассуж- |
|
дая и дальше аналогичным образом, можно показать, что после третьего периода полуэлиминации общий уровень лекарства в организме достигнет 93,75 ЕД, а после 4-го периода – 96,875 ЕД и, наконец, после завершения пятого периода полуэлиминации (при продолжающемся введении лекарства) в организме будет 98,438 ЕД. Как не трудно заметить, уровень лекарства стремиться достигнуть в нашем примере 100 ЕД, вблизи которого он в дальнейшем и будет совершать колебания.
Схема 11. Концентрация вещества в плазме, которая создается при его постоянном введении в течение 8 периодов полувыведения и после прекращения введения. Пояснения в тексте.
Если принять уровень предела нарастания концентрации лекарства за 100%, то наше разложение примет вид:
1 период полуэлиминации (1-я доза) = 50% 2 период полуэлиминации (2-я доза) = 25%+50% = 75%
3 период полуэлиминации (3-я доза) = 12,5%+25%+50% = 87,5% 4 период полуэлиминации (4-я доза) = 6,25%+12,5%+25%+50% = 93,75%

30
Практически, можно утверждать, что после 4-5 периодов полуэлиминации концентрация лекарственного средства при его повторных введениях перестает существенно нарастать.
Чем объясняется прекращение дальнейшего роста концентрации лекарства при его повторных введениях в одной и той же дозе? Очевидно, что в начале, когда уровень концентрации лекарства невысок, скорость его элиминации (которая пропорциональна количеству лекарственного вещества в организме в условиях кинетики нулевого порядка) также невысока. По мере увеличения количества вещества в организме нарастает и скорость его элиминации, поэтому рано или поздно наступит такой момент, когда возросшая скорость элиминации уравновесит вводимую дозу лекарства и дальнейший рост концентрации прекратиться.
Концентрация лекарственного средства в плазме крови, которая достигается при условии, что скорость введения лекарства в организм уравновешивает скорость его выведения получила название стационарной концентрации лекарственного вещества (СSS). Из уравнения:
D |
Cl C |
|
следует, что C |
|
|
Dп |
*. |
тер |
SS |
|
|||||
п |
|
|
|
Cl |
|||
|
|
|
|
|
|
||
Возникает закономерный вопрос: что бы произошло с уравнением стационарной концентрации, если бы в нашем примере мы избрали иную дозу лекарственного средства или иной интервал между его введениями (равный не периоду полуэлиминации, а более редкий или частый)? Наконец, возможно нами умышленно был выбран такой пример и при других исходных данных мы бы не получили такой зависимости?
Вспомним, что t |
|
ln 2 Vd |
, подставив это значение в формулу CSS имеем: |
|||||||||||||
|
|
|||||||||||||||
|
1 2 |
|
|
Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
D |
|
|
Dп t1 2 |
|
|
|
t1 2 |
|
D |
k |
D |
|
С |
|
|
п |
|
|
или C |
|
|
п |
п |
|
|||||
SS |
Cl |
|
ln 2 Vd |
SS |
ln 2 Vd |
|
|
|||||||||
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|||||||
Таким образом, величина CSS прямо пропорциональна вводимой дозе и обратно пропорциональна интервалу между введениями лекарства. Иначе говоря, если бы в нашем примере мы увеличили вводимую дозу в 2 раза, то и уровень CSS тоже увеличился в 2 раза. Если бы мы увеличили интервал между введениями в 2 раза, то величина CSS уменьшилась бы во столько же раз. Но, особо отметим, что время достижения CSS при этом нисколько бы не изменилось (и по-прежнему составляло бы 4-5t½).
Поскольку лекарственное вещество вводится через дискретные интервалы времени, то очевидно, что величина СSS не будет постоянной, а начнет колебаться в каком-то диапазоне от максимального уровня (вскоре после введения лекарства) до минимального уровня перед очередным приемом лекарства. Эти границы колебаний не трудно рассчитать, они составляют:
СSS |
|
|
|
Dп |
|
и CSS |
|
Dп |
|
e kel |
CSS |
e kel |
V |
|
(1 e kel ) |
V (1 e kel ) |
|||||||||
max |
d |
min |
|
max |
|
|||||||
|
|
|
|
|
|
|
d |
|
|
|
||
Если ввести новою переменную N  t1 2 , т.е. параметр, который показывает, через сколько периодов полуэлиминации вводят поддерживающую дозу, то можно показать, что:
t1 2 , т.е. параметр, который показывает, через сколько периодов полуэлиминации вводят поддерживающую дозу, то можно показать, что:
СSS |
|
Dп |
|
и CSS |
CSS |
0,5N |
|
V (1 0,5N ) |
|||||||
max |
min |
max |
|
||||
|
|
d |
|
|
|
||
Таким образом, границы колебаний стационарной концентрации, как и она сама, зависят только от величины вводимой дозы и количества периодов полуэлиминации, проходящих между очередными введениями лекарства.
Рассмотрим теперь процесс элиминации лекарства после прекращения его введения в
организм. Примем стационарный уровень лекарства за 100%. Тогда:
через 1 период полуэлиминации останется ½ 100%=50% и выведется 50% лекарства; через 2 периода полуэлиминации останется ½ 50%=25% и выведется 50+25=75% лекарства; через 3 периода полуэлиминации останется ½ 25%=12,5% и выведется 50+25+12,5=87,5%;
* Мы исходим из предположения о 100% биодоступности лекарства. Естественно, что если она составляет менее 100% необходимо учитывать снижение биодоступности вводят соответствующий множитель в уравнение.
