
- •Основы молекулярной физики
- •Архангельск
- •Рассмотрены и рекомендованы к изданию
- •Рекомендации по решению задач расчетно-контрольных заданий
- •Уравнение состояния идеального газа.
- •Основное уравнение молекулярно-кинетической теории газов.
- •Распределение молекул по скоростям и энергиям.
- •Скорость молекул газа.
- •Барометрическая формула. Распределение Больцмана.
- •Основные законы термодинамики.
- •Соотношение между ними определяется уравнением Майера:
- •Адиабатный процесс.
- •Первое начало термодинамики.
- •Второе начало термодинамики.
- •Явления переноса.
- •Поверхностное натяжение. Капиллярные явления.
- •Примеры решения задач
- •Подставив в эту формулу числовые значения величин, найдем
- •Произведя вычисления по этой формуле, найдем
- •Сделав подстановку значений величин, получим
- •После вычисления по формуле (4) найдем
- •Задачи расчетно-контрольных заданий
- •1. Уравнение состояния идеального газа.
- •4. Распределения Максвелла
- •11. Поверхностное натяжение.Капиллярные явления.
Барометрическая формула. Распределение Больцмана.
Атмосфера,воздушная оболочка Земли, формируется благодаря тепловому движению молекул и воздействию внешнего силового поля – гравитационного поля Земли. При этом в поле силы тяжести устанавливается вполне определенное распределение молекул по высоте. В соответствии с этим устанавливается и определенный закон изменения давления газа с высотой.
Зависимость концентрации молекул газа от высоты во внешнем поле сил тяжести была установлена Больцманом в следующем виде:
![]()
где n иn0 - концентрации молекул газа,соответственно, на высотеhи на нулевом уровне.
В обобщенном виде для любого потенциального поля формула Больцмана принимает следующий вид:

где U – потенциальная энергия молекулы.
Уравнение,устанавливающее закон убывания давления газа с высотой получило название барометрической формулы:
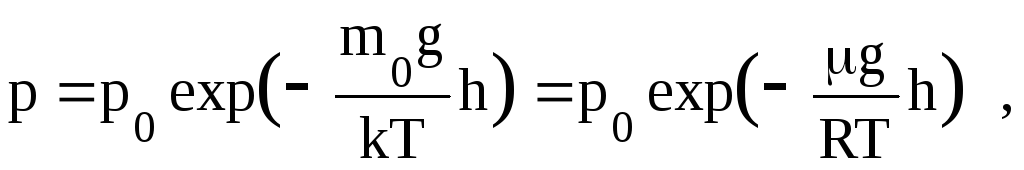
где p, p0 – давления газа,соответственно,на высотеh и на нулевом уровне.
Основные законы термодинамики.
Введем в рассмотрение понятие внутренней энергии и установим отличие ее от теплоты. Тепловой или внутренней энергией называется полная сумма всех видов энергии всех молекул, принадлежащих телу. Сюда входит кинетическая энергия движения самих молекул, кинетическая энергия атомов внутри молекул, потенциальная энергия взаимодействия между атомами внутри молекулы, а также энергия элементарных частиц, составляющих ядро атома. С другой стороны, теплота – это количество энергии, которое передается от одного тела к другому при непосредственном контакте (или через третье тело) либо излучением.
Для вычисления внутренней энергии более сложных газов (2-х, 3-х атомных, а также многоатомных) необходимо учитывать энергии вращательного и колебательного движения молекул. Для этого введем понятие числа степеней свободы, под которым понимается число независимых параметров (координат), описывающих положение и конфигурацию системы в пространстве.
В общем, виде система, состоящая из N частиц имеет 3N степеней свободы. Каждая жесткая связь между частицами уменьшает число степеней свободы на единицу, каждая упругая связь не изменяет числа степеней свободы системы. Тогда в простейших ситуациях полагаем, что молекула одноатомного газа имеет 3 степени свободы, 2-х атомного (с жесткой связью между атомами) - 5 степеней свободы, 3-х и многоатомного (с жесткой связью) – 6 степеней свободы..
Важным положением молекулярно-кинетической теории является принцип равнораспределения энергии по степеням свободы. Этот принцип гласит, что энергия распределяется поровну между активными степенями свободы и каждая отдельная активная степень свободы обладает в среднем энергией (1kT. Таким образом, средняя энергия одной молекулы некоторого газа определяется уравнением:
![]()
Вычислим внутреннюю энергию молей идеального газа:
![]()
таким образом, внутренняя энергия идеального газа определяется только температурой и количеством вещества.
В природе существует два способа изменения внутренней энергии системы:
- теплопередача (совершение микроскопической работы),
- совершение макроскопической работы.
Теплопередача может осуществляться тремя способами:
- теплопроводностью (молекулярный перенос теплоты),
- конвекцией (молярный перенос теплоты),
-излучением (перенос энергии электромагнитными волнами).
Работа по изменению объема в термодинамике в общем, виде определяется следующей зависимостью:
dA= рdV,
тогда работа в изопроцессах определяется следующими формулами:
- в изобарном процессе (р=const)
A=p(V2-V1),
где V1, V2 – объемы газа, соответственно начальный и конечный;
- в изотермическом процессе (T=const)

- в изохорном процессе (V=const)
А=0 .
Расчет количества теплоты, переданного от одного тела к другому, зависит от процесса теплопередачи. В процессах нагревания (охлаждения) тел теплопередача сопровождается изменением температуры, в этом случае количество переданной теплоты определяется по формуле:
dQ=СdT,
где С – теплоемкость тела, Джкг.
Теплоемкостью тела С называется отношение бесконечно малого количества теплоты dQ, полученного телом, к соответствующему приращению dT его температуры:
С=dQdT.
Теплоемкость, относящаяся к единице массы тела, называется удельной (с), относящаяся к единице количества вещества – молярной (с). Между ними устанавливается связь:
с = с .
Особое значение имеют теплоемкости газов при постоянном объеме и постоянном давлении. Удельные теплоемкости при постоянном объеме и давлении соответственно равны:
![]()
Молярные теплоемкости при постоянном объеме и давлении соответственно равны:
![]()
